RhBMP-2对肝癌SK-Hep-1细胞生长影响的体内研究
2018-05-25刘书中刘祖德沈洪兴杨絮飞王以朋劳立峰
刘书中,钱 列,冯 帆,刘祖德,沈洪兴,杨絮飞,王以朋,劳立峰*
(1.上海交通大学医学院附属仁济医院 骨科,上海200127;2.中国医学科学院 北京协和医学院 北京协和医院 骨科,北京100730;3.中国医学科学院 北京协和医学院 北京协和医院 心内科,北京100730)
骨形态发生蛋白(bone morphogenetic protein,BMP)是转化生长因子β(transforming growth factor-β,TGF-β)超家族中的成员,由Urist等于1965年首次报道,迄今发现的BMPs已超过30种,其中BMP-2临床应用最为广泛[1,2]。近年来,BMP-2在调节细胞增殖、分化、迁移、凋亡等领域的生物学功能得到进一步证实,但多项研究显示BMP-2信号通路尚可参与多种肿瘤的发生与进展[3-5]。
美国食品及药品管理局(Food and Drug Administration,FDA)已批准将重组人骨形态发生蛋白-2(rhBMP-2)应用于临床,目前rhBMP-2多用于脊柱融合手术及骨不连等骨科疾患的治疗中,但近年来,国内外多项研究表明rhBMP-2的临床应用可增加多种恶性肿瘤的患病风险[4-8]。本研究选用肝癌SK-Hep-1 细胞系作为实验对象,探讨在体内条件下rhBMP-2对SK-Hep-1细胞生长的作用及其可能机制,为rhBMP-2应用于骨科疾病临床治疗并预防肿瘤发生发展提供一定的基础实验依据。
1 材料与方法
1.1材料
RhBMP-2,来自UCLA骨科实验室(加州,美国);人肝癌细胞系SK-Hep-1,来自上海市肿瘤研究所(上海,中国);胎牛血清(FBS)、RPMI1640培养基及胰蛋白酶均购自Gibco公司,其他细胞培养及动物实验相关试剂均为Gibco公司产品;Matrigel购自BD Biosciences公司;裸鼠(BALB/c nu/nu)购自上海第二军医大学动物实验室(上海,中国)。本研究经仁济医院动物伦理委员会批准,并遵照动物实验原则施行。
1.2方法
1.2.1细胞培养 人类肝细胞癌细胞系SK-Hep-1细胞培养于含10%胎牛血清、100 U/ml(纯度≥99%)青霉素、100 μg/ mL(纯度≥98%)链霉素的RPMI1640培养基中,所有细胞置于含5%CO2的37℃培养箱中常规培养,培养液每2-3天更换一次。
1.2.2设置实验组与对照组 本研究中共饲养16只6周龄裸鼠,并将其饲养在SPF级标准条件下(21±1℃、12h日夜交替)。所有裸鼠适应培养环境一周后,随机平均分为实验组与对照组,接受皮下注射SK-Hep-1细胞,构建裸鼠背部皮下成瘤模型。
1.2.3裸鼠皮下肿瘤模型的建立 实验中将16只裸鼠随机分为实验组(8只)与对照组(8只)。本研究中采用裸鼠背部皮下肿瘤异种移植模型,离心后将SK-Hep-1细胞(1×106)悬浮于30 μl PBS液中,各保存于冻存管中。随后用70%乙醇和碘伏消毒裸鼠背部皮肤,氯胺酮(4.0 mg/100 g)腹腔注射麻醉。麻醉成功后施行皮下注射,建立裸鼠背部皮下肿瘤模型。实验组成瘤方案为200 μl SK-Hep-1细胞+rhBMP-2+Matrigel+PBS,对照组成瘤方案为等量的200 μl SK-Hep-1细胞+Matrigel+PBS。建模成功并做好标记后,将实验组与对照组裸鼠分别培养于4只培养笼内,4只/笼。
1.2.4数据及标本采集 裸鼠皮下肿瘤模型建立后,每周测量实验组与对照组裸鼠成瘤大小并测算瘤体体积,计算公式为:体积(mm3) = (瘤体长径×瘤体短径2)×0.5。实验中的所有裸鼠在第9周处死,于裸鼠背部完整切取成瘤瘤体组织。肿瘤的重量使用精密电子天平仪器测量。测量瘤体重量后,将肿瘤标本在4%多聚甲醛中固定过夜,保存于4℃条件下,通过一系列浓度递增的乙醇溶液(40%-100%)进行脱水处理,包埋在石蜡中并制备5 μm切片用于免疫组化染色检测。
1.2.5免疫组化检测 首先将石蜡切片脱蜡并重新水合处理。在室温下,微波处理置于柠檬酸钠缓冲液中的切片标本。将切片置于H2O2中浸泡30 min以阻断内源性过氧化物酶,切片在4℃条件下与Ki-67单克隆抗体温育整夜。在37℃,将切片孵育于HRP标记的二抗中2 h。最后,将切片孵育于DAB溶液中30 min。图像通过使用Olympus显微镜(CX40,Olympus,日本)进行盲检。应用图像分析软件(Digital Micro System,Jena,Germany)扫描染色区域来分析免疫组织化学光密度(IOD),对Ki-67阳性细胞进行计数。在每张切片中选定四个区域计数并计算Ki-67阳性细胞百分比。
1.2.6统计学分析 数据处理和统计分析采用SPSS 17.0(SPSS Inc,Chicago,IL,USA)完成,数据采用均数±标准差的表示方法。Mann-Whitney U检验比较裸鼠皮下成瘤体积及瘤体重量,P<0.05为差异具有统计学意义。
2 结果
2.1实验组及对照组裸鼠皮下均建模成功,每周测量裸鼠皮下成瘤瘤体体积,直至建模9周后处死全部裸鼠。结果显示第4周至第9周,实验组裸鼠皮下瘤体体积均低于对照组(图 1),差异具有统计学意义(P<0.05)。处死全部裸鼠后,完整切取裸鼠背部皮下肿瘤,测量实验组及对照组裸鼠皮下瘤体重量,结果发现实验组裸鼠皮下瘤体重量明显低于对照组(图2),差异具有统计学意义(P<0.05)。
2.2通过免疫组织化学染色检测经rhBMP-2处理与否小鼠荷瘤组织中ki-67的表达差异,研究发现rhBMP-2处理后可显著降低裸鼠荷瘤组织中ki-67的表达水平(图3),结果表明体内条件下rhBMP-2对肝细胞癌SK-Hep-1细胞增殖具有一定的抑制作用。
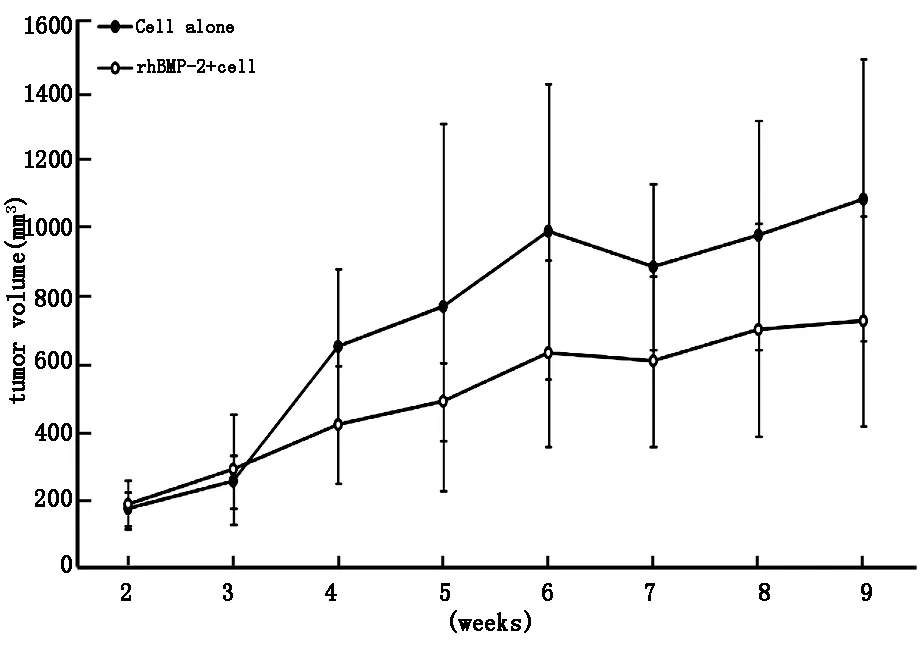
图1 对照组、实验组裸鼠皮下瘤体体积比较
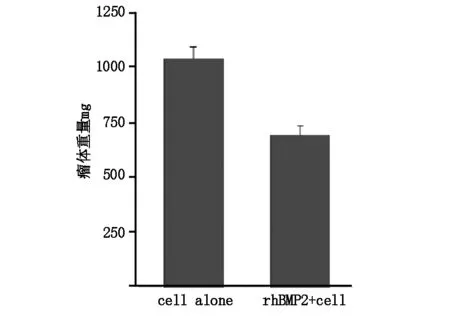
图2 对照组、实验组裸鼠皮下瘤体重量比较
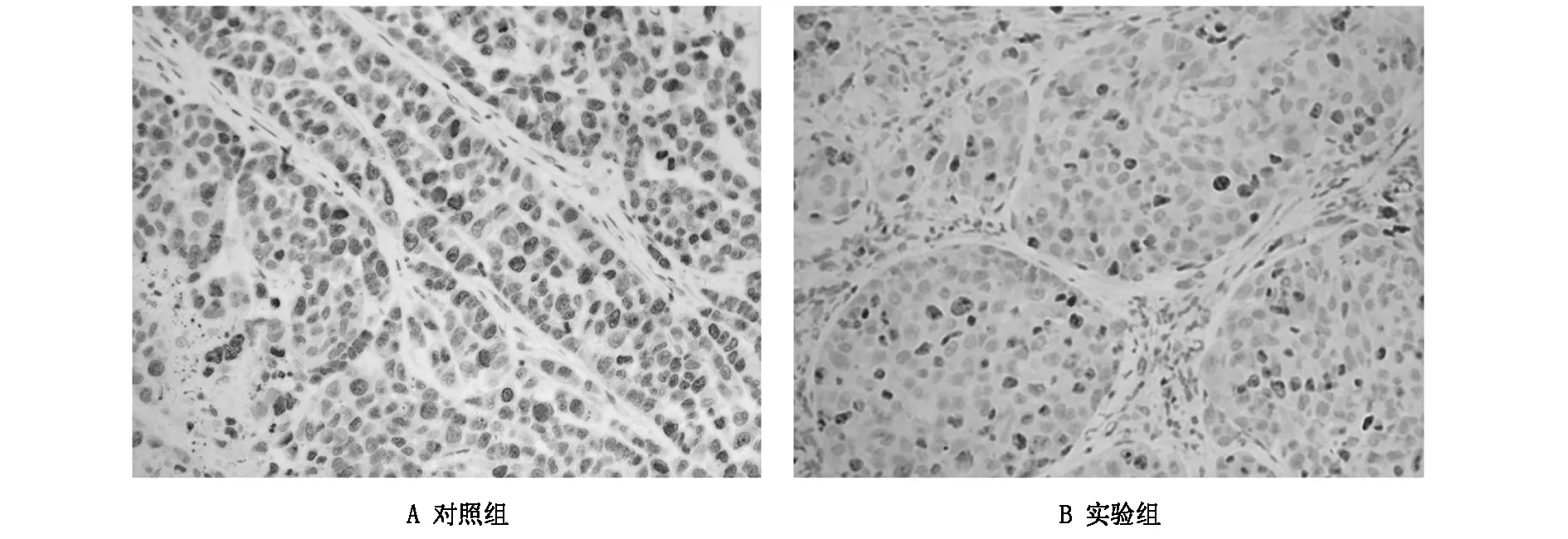
图3 免疫组织化学染色检测裸鼠荷瘤组织中ki-67的表达情况
3 讨论
自从2002年美国FDA批准rhBMP-2的临床使用,其较强的成骨潜力使其逐步成为自体骨移植或同种异体骨移植的有效替代物。在过去的十年中,rhBMP-2用于脊柱融合手术及骨不连愈合的临床治疗后,其显著促进骨质形成的作用得到国际上的广泛认可[9]。然而,在脊柱手术中广泛使用rhBMP-2也同时带来了一系列的副作用,如增加某些恶性肿瘤的患病风险、诱发神经炎症、逆行射精、异位骨化、局部组织肿胀等严重不良反应[10-13]。
肝细胞癌(hepatocellular carcinoma,HCC)在世界范围内所有癌症种类中患病率位列第五位,约占所有癌症的7.9%[14]。多种治疗策略如手术治疗、化疗、放疗、靶向治疗,已被广泛应用于肝癌患者的临床治疗中。但是,目前肝癌的临床治疗效果仍有待进一步提高,骨转移癌是肝癌的常见并发症,缺乏有效的治疗手段,临床预后较差。研究证实rhBMP-2对不同类型的肿瘤细胞可发挥刺激性或抑制性的作用,并在一定程度上依赖其剂量的增长、肿瘤细胞类型和肿瘤局部微环境,目前尚缺乏rhBMP-2在HCC细胞增殖、分化、转移、侵袭及凋亡等多种生物学行为中的作用及其机制的研究报道[4,5,7,8]。Zheng等[15]研究证实在体外条件下外源性的rhBMP-2可抑制肝细胞癌Hep G2、Hep 3B细胞的生长和迁移,其作用可能通过抑制PI3K/Akt信号传导和上调caspase信号通路来实现。Lao等[4]以肝细胞癌Hep G2细胞系为研究对象,发现rhBMP-2可以在体内条件下促进肝细胞癌的生长及骨转移过程,进一步证明分泌性磷蛋白24 kD(spp24)可以阻断rhBMP-2对Hep G2细胞生长及骨转移的作用,研究证明spp24有望成为肝细胞癌及肝细胞癌骨转移癌的有效治疗剂。而本研究中,结果显示实验组裸鼠皮下瘤体体积、重量均较对照组低,差异具有统计学意义(P<0.01),免疫组化检测显示rhBMP-2处理可显著降低瘤体组织中ki-67的表达水平。研究表明在体内条件下rhBMP-2对肝癌SK-Hep-1细胞生长能力发挥显著抑制作用,可能由rhBMP-2抑制肝细胞癌SK-Hep-1细胞增殖过程而导致。综上所述,我们可以为rhBMP-2应用于肝细胞癌及肝癌脊柱转移癌患者的治疗提供一定的基础科学依据。
本项研究尚存在诸多不足:(1)研究中没有设置spp24对rhBMP-2及肝细胞癌SK-Hep-1细胞系的影响,其相关性及机制尚需进一步探索。(2)我们在体内试验中建立的是裸鼠皮下肿瘤模型,皮下成瘤模型的病理生理条件与原位模型可能不完全相同,肝脏及骨骼原位肿瘤模型可能对于实验结果的阐明具有更大的优势。(3)本研究只是针对体外条件下rhBMP-2对肝细胞癌SK-Hep-1生长能力的影响,而对细胞不同生物学行为的作用需进一步深入探讨。
本研究通过上述实验证实在体内条件下rhBMP-2对肝细胞癌SK-Hep-1细胞生长具有显著的抑制作用,并可能由rhBMP-2抑制肝细胞癌SK-Hep-1细胞增殖过程而导致。从基础水平进一步论证了rhBMP-2的临床应用不能显著增加肝细胞癌的患病风险,为在脊柱融合手术及骨不连等骨科疾病的治疗中应用rhBMP-2提供了一定的理论基础。
参考文献:
[1]Urist MR.Bone:formation by autoinduction[J].Science,1965,150(3698):893.
[2]Salazar VS,Gamer LW,Rosen V.BMP signalling in skeletal development,disease and repair[J].Nat Rev Endocrinol,2016,12(4):203.
[3]Kang MH,Kang HN,Kim JL,et al.Inhibition of PI3 kinase/Akt pathway is required for BMP2-induced EMT and invasion[J].Oncol Rep,2009,22(3):525.
[4]Lao L,Shen J,Tian H,et al.Secreted phosphoprotein 24kD (Spp24) inhibits growth of hepatocellular carcinoma in vivo[J].Environ Toxicol Pharmacol,2017,51:51.
[5]Li CS,Tian H,Zou M,et al.Secreted phosphoprotein 24 kD(Spp24) inhibits growth of human pancreatic cancer cellscaused by BMP-2[J].Biochem Biophys Res Commun,2015,466(2):167.
[6]刘书中,张海英,张海龙.血清BMP-2检测在恶性肿瘤中的意义研究进展[J].中国实验诊断学,2015,19(6):1030.
[7]Faundez A,Tournier C,Garcia M,et al.Bone morphogenetic protein use in spine surgery-complications and outcomes:a systematic review[J].Int Orthop,2016,40(6):1309.
[8]James AW,LaChaud G,Shen J,et al.A Review of the Clinical Side Effects of Bone Morphogenetic Protein-2[J].Tissue Eng Part B Rev,2016,22(4):284.
[9]Bodalia PN,Balaji V,Kaila R,et al.Effectiveness and safety of recombinant human bone morphogenetic protein-2 for adults with lumbar spine pseudarthrosis following spinal fusion surgery:A systematic review[J].Bone Joint Res,2016,5(4):145.
[10]Vavken J,Mameghani A,Vavken P,et al.Complications and cancer rates in spine fusion with recombinant human bone morphogenetic protein-2(rhBMP-2)[J].Eur Spine J,2016,25(12):3979.
[11]Tannoury CA,An HS.Complications with the use of bone morphogenetic protein 2 (BMP-2) in spine surgery[J].Spine J,2014,14(3):552.
[12]Young A,Mirarchi A.Soft Tissue Swelling Associated with the Use of Recombinant Human Bone Morphogenetic Protein-2 in Long Bone Non-unions[J].J Orthop Case Rep,2015,5(3):18.
[13]Malham GM,Giles GG,Milne RL,et al.Bone Morphogenetic Proteins in Spinal Surgery:What Is the Fusion Rate and Do They Cause Cancer[J].Spine (Phila Pa 1976),2015,40(22):1737.
[14]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2010,66(2):115.
[15]Zheng Y,Wang X,Wang H,et al.Bone morphogenetic protein 2 inhibits hepatocellular carcinoma growth and migration through downregulation of the PI3K/AKT pathway[J].Tumour Biol,2014,35(6):5189.
