超声造影评估早期骨再生血管化的实验研究
2018-05-24刘帮燕王迎春
刘帮燕,金 琳,夏 晴,王迎春
(1. 潍坊医学院,山东潍坊261000;2. 上海市嘉定区中心医院,上海201800)
0 引 言
骨缺损、骨不连或延迟愈合是临床关注的难题。再血管化、骨再生、骨端融合是骨再生过程中三个密切相关的环节,其中再血管化是最基本的环节,往往对骨再生、骨愈合的方式和效果产生决定性的影响。研究表明,血供是骨再生的前提,具有维持骨的生长、重建及其生理功能的作用[1],因此早期检测血管化对评估骨再生不良及骨折患者预后有重要价值[2]。超声造影(Contrast Enhanced Ultrasound,CEUS)可实时显示组织内微血管及血流灌注情况,对组织内微血管进行实时动态观察、定量分析,弥补了彩色多普勒超声在检测微血管方面的不足,已在临床各个领域得到广泛应用[3-6],但将其用于评估移植骨早期血管化程度的研究,国内外尚少有报道[7]。本研究通过建立骨再生模型,采用CEUS观察早期骨再生新生血管形成情况,旨在探讨CEUS在早期骨再生过程中用于监测骨移植材料血管化的价值,以期为骨缺损、骨不连或延迟愈合的临床早期干预提供可靠的影像学依据。
1 材料与方法
1.1 实验动物与试剂
实验动物为SD级大鼠25只,雄性,4周龄,体质量 200~250 g,(平均 225g)。超声造影剂为Bracco Sono Vue(含六氟化硫气体 59 mg),CPC/rhBMP-2复合材料由上海瑞邦生物材料有限公司生成。
1.2 动物模型
实验组于大鼠左侧后肢剃毛、消毒, 经皮肤、皮下,分开肌肉,将 CPC/rhBMP-2植入大鼠左侧肌间隙内,逐层缝合伤口,术后正常喂养。
1.3 实验分组
将大鼠按术后3、7、14、21、28 d分为5组,每组5只。
1.4 实验方法
采用东芝Aplio 400型彩色多普勒超声诊断仪,随机配备CEUS成像软件,14-L5探头,探头频率为14 MHz,低机械指数0.13,检查时仪器参数设置一致。二维高频超声观察支架(支架在大鼠左侧肌间隙。方法:腹腔麻醉后,将大鼠左侧后肢剃毛、消毒,用眼科剪切开皮肤、筋膜以暴露其后肢大腿处肌肉,并钝性分离其肌间隙,将 CPC/rhBMP-2支架埋入大鼠左侧肌间隙内。支架就是 CPC/rhBMP-2)的大小、回声及形态。选取高频超声观察到支架的最佳切面,启动造影模式进行检查。将造影剂SonoVue(59 mg)和5.0 ml生理盐水混合,人工震荡混摇匀至白色乳状微泡悬浊液,使用剂量为0.1 ml.kg-1体质量,经尾静脉注入,随后立即注入1 ml生理盐水,注射造影剂同时启动计时器,检查时保持探头不动,观察支架周边及内部造影剂的增强强度,连续观察 2 min,并存储动态影像。根据支架的大小和形状,逐帧手动调整感兴趣区(Region Of Interest,ROI),于支架周围肌组织勾勒另一ROI作为参考区,应用时间-强度曲线(Time-Intensity Curve,TIC)分析造影剂灌注参数,包括达峰 PI、TTP、AUC。
1.5 病理学检测
术后3、7、14、21、28 d对植入部位取材,将材料连同周围肌肉一同取出。10%福尔马林溶液固定,经石蜡包埋、切片,切片厚度为5 µm,HE染色,观察支架内新生毛细血管数及成骨情况,计算切片下新生血管的面积占切片总面积的百分比,用来表示新生血管百分数。
1.6 统计学分析
采用SPSS 17.0软件进行统计学分析,计量数据用均数±标准差(x±s)表示。采用单因素方差分析比较各时间点超声检查结果存在的差异,以p< 0.05具有统计学意义。
2 结 果
2.1 超声结果
二维超声显示,各观察时间点支架大小未见明显改变。术后 3 d,支架呈高回声,内可见孔隙结构;术后7 d、14 d,支架回声较前期增强,边界欠光整,但孔隙仍清晰可见;术后21、28 d,支架回声明显增强,形态欠规则,孔隙逐渐模糊。

图2 术后 7 d,支架周边造影剂已向中间填充Fig.2 CEUS imaging on the 7th day
CEUS显示,术后3 d,周边可见点状造影剂灌注,内部无明显造影剂灌注(见图1);术后7 d,周边及内部均可见造影剂灌注(见图2),PI及AUC较3 d增加明显(见表1);术后14 d,周边及内部均见造影剂明显灌注,PI及AUC达最大值(见图3);术后21 d及28 d,支架周边及内部造影剂灌注量明显降低,PI及AUC较术后14 d减低,28 d时显著减少(见图4),各组间PI、AUC差异有统计学意义(检验统计量F=104.50,p=0.000;F=223.99,p=0.000),但TTP差异无明显统计学意义(F=1.760,p=0.177)。
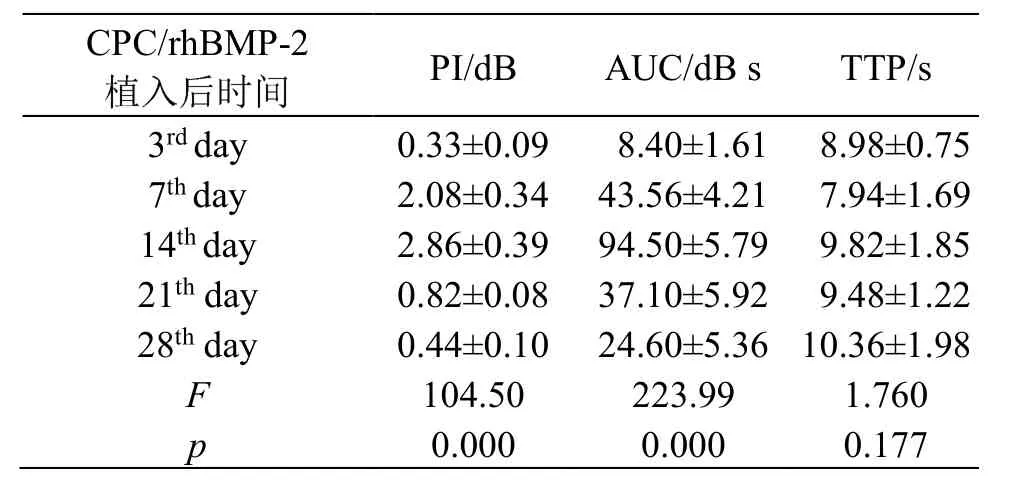
表1 各时间CEUS所测CPC/rhBMP-2内PI、AUC、TTP值(n=25)Table 1 PI、 AUC、TTP in CPC/rhBMP-2 was measured with CEUS in different observation days (n=25 )

图3 术后14 d,支架周边及内部均见大量造影剂灌注Fig.3 CEUS imaging on the 14th day

图4 术后28 d,支架周边及中央造影剂灌注区明显减少,灌注面积低于术后14 dFig.4 CEUS imaging on the 28th day
2.2 病理学结果
大体标本观察,术后 3 d,支架外周未见肌组织包裹,内孔隙清晰;术后7 d支架外周见少量肌组织包裹,内孔隙仍清晰可见,术后14 d,支架与周围肌组织结合紧密,外周肌组织增多,孔隙模糊,支架边界欠光整;术后21 d,支架外周除肌组织外,还可见少量淡黄色组织;术后28 d,支架外周肌组织及淡黄色组织增多,形态欠规则。整个实验过程,材料大小未发生明显变化。
HE染色显示,术后3 d,支架周边可见少量炎性细胞和新生血管萌芽,部分样本可见未分化的间充质细胞在植入部位和邻近肌组织之间增殖(见图5);术后7 d,支架周边可见排列紊乱的新生血管逐步向中央填充,外周可见大量增生的间充质细胞(见图6);术后14 d,支架外周及内部可见新生毛细血管显著增多,达到最高水平,外周及内部出现少量骨样组织,但主要集中在外周孔隙(见图7);术后21 d,支架内新生血管逐渐减少,趋向成熟,周边及内部可见大量间充质细胞及骨细胞,可见少量未成熟的骨组织逐步向支架内长入;术后28 d,支架周围及内部新生血管减少,外周新生骨趋于成熟(见图8,表2)。
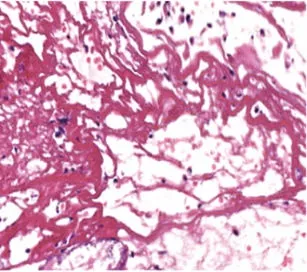
图5 术后3 d,支架周边可见少量新生血管Fig.5 Pathological image on the 3rd day

图7 术后14 d,支架周边及内部均可见大量新生血管,可见少量未成熟的骨组织Fig.7 Pathological image on the 14th day

图8 术后28 d,可见新生血管明显减少并趋向成熟,可见少量成熟的骨组织。Fig.8 Pathological image on the 28th day
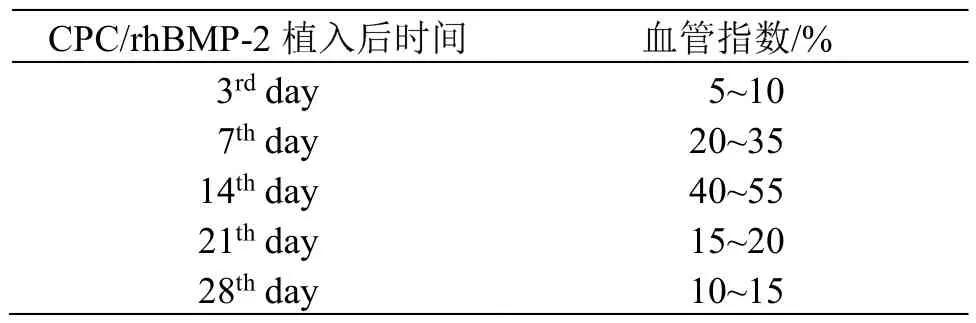
表2 各时间HE染色新生血管数Table 2 The number of new blood vessels with HE staining in different observation days
3 讨 论
骨骼生长、修复和骨重塑是一系列严格依赖于新生毛细血管快速生长的生物事件,血管网络在骨生成过程中除提供营养物质、生长因子、激素、细胞因子和趋化因子,清除代谢产物外,还发挥了沟通骨与邻近组织之间的作用,从而达到骨修复的目的[8-9],反之,血管化不足将限制营养物质的摄取及代谢产物的排出[10],从而表现为延迟愈合和不愈合,表明骨组织的生成与血管生成是紧密联系的过程,因此,评估移植骨血管化在骨再生过程显得尤为重要。目前检测血管化的影像学方法包括放射性骨显像、CT灌注成像及磁共振成像(Magnetic Resonance Imaging,MRI)。其中,放射性骨显像可反映局部骨骼的血供,有助于评价新生骨的成熟度;CT灌注成像可在毛细血管水平上准确反映局部的血管生成[11],但两者由于辐射性较大,限制了其在临床的应用;MRI以软组织分辨率高、无创、无辐射等优点成为临床评价移植骨植入后血管化的首选方法,其最大的不足在于,装有心脏起搏器,人工金属瓣膜或存在幽闭恐惧症的患者不能接受MRI检查[12],且检查时间过长,重复检查费用较高,临床不易接受。
CEUS是利用超声造影剂观察目标区域内流动的微气泡来显示新生血管的生成情况,对微小血管显示有较好的分辨力[13]。本研究应用CEUS动态观察 CPC/rhBMP-2的早期新生血管形成情况并定量分析,结果显示:术后 3 d,支架周边有少量造影剂灌注,内部无灌注,病理结果显示支架周边可见少量新生血管细胞;随着时间增加,造影剂逐步向支架内部延伸,术后14 d内部造影剂PI、AUC均达到最高水平,病理结果同样显示支架周边及内部新生血管密度最高,说明支架内新生血管达到顶峰,与Rabie等[14]下颌骨术后观察血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)水平的结果相符;术后21、28 d,支架周边及内部造影剂灌注量明显下降,但周边部灌注量多于支架内部,PI、AUC逐步降低,可能与支架内成骨细胞增多而血管退化有关,而二维超声显示支架形态欠规则,内孔隙结构模糊,回声反射明显增强,后方出现衰减,表明支架内已有新生骨形成,与病理结果显示支架外周及内部均可见骨组织及骨小梁的形成一致,但骨组织的分布趋势仍以外周为主,与新生血管的形成趋势一致,这与Wang等[15]将支架植入后,发现新生血管的形成及钙的沉积是从支架周边逐渐向中央推进的一个过程相符。在CEUS定量分析中还发现各时期TTP间并无差异,与凌茵等[5]利用CEUS观察珊瑚羟基磷灰石(CHA)内血管化的研究发现(TTP与时间呈显著负相关)不符,考虑是由于支架种类或血管同源性有关。上述研究结果表明,CEUS不仅可动态观察不同时期CPC/rhBMP-2血管化情况,与组织病理学检测高度一致,而且联合常规超声可观测骨化过程。但CEUS仍存在不足,当骨成熟后,超声波无法穿透高密度骨界面而造成成像困难。
综上所述,本研究通过CEUS动态观察支架内新生血管的形成,发现其与病理学所显示的血管分布一致,与骨组织早期生成密切相关。CEUS以其动态实时之优势揭示了血管形成方式、血管形成的达峰时期,而优于其他影像学检查方式,为评价早期移植材料内的血管化及骨再生不良的早期干预提供可靠方法。总之,随着超声影像学及超声造影剂的发展,CEUS技术将在骨组织工程中展现出更加广阔的应用前景。
参考文献
[1] 罗颜平. 兔同种异体骨异位再血管化的实验研究[D]. 新乡: 新乡医学院, 2015: 1-42.LUO Yanping. Ectopic revascularization of allograft segment in rabbits[D]. Xinxiang: Xinxiang Medical College, 2015: 1-42.
[2] FASSBENDER M, STROBEL C, RAUHE J S, et al. Local inhibition of angiogenesis results in an atrophic non-union in a rat osteotomy model[J]. Eur Cell Mater, 2011, 22(1): 1-11.
[3] 熊雯, 安绍宇, 刘健, 等. 乳腺癌超声造影表现与分子生物学指标的相关性研究[J]. 医学影像学杂志, 2014, 24(10): 1753-1757.XIONG Wen, AN Shaoyu, LIU Jian, et al. The correlation between contrast enhanced ultrasound and molecular biology of breast cancer[J]. Journal of Medical Imaging, 2014, 24(10):1753-1757.
[4] 林庆光, 邹如海, 王建伟, 等. 超声造影对肝细胞癌微血管形态术前分型的可行性[J]. 中华医学超声杂志, 2015, 12(6): 478-483.LIN Qingguang, ZOU Ruhai, WANG Jianwei, et al. The feasibility of contrast enhanced ultrasound in the preoperative classification of microvascular morphology of hepatocellular carcinoma[J].Chinese Journal of Medical ultrasound, 2015, 12(6): 478-483.
[5] 徐柒华, 陈惠英, 邹大中, 等. 羟基磷灰石眶内植入物的血管化程度: 超声造影与增强核磁共振成像评价比较[J]. 中国组织工程研究与临床康复, 2009, 13(47): 9353-9356.XU Qihua, CHEN Huiying, ZOU Dazhong, et al. The degree of vascularization in the orbital implant of hydroxyapatite: Comparison of contrast enhanced ultrasound and enhanced magnetic resonance imaging[J]. Chinese Tissue Engineering Research and Clinical Rehabilitation, 2009, 13(47): 9353-9356.
[6] SHALHOUB J, OWEN D R, GAUTHIER T, et al. The use of contrast enhanced ultrasound in carotid arterial disease[J]. Eur J Vasc Endovasc Surg, 2010, 39(4): 381-387.
[7] 凌茵, 王莎莎, 陈泽鹏, 等. 超声造影评估人工骨血管化的实验研究[J]. 中国医学物理学杂志, 2017, 34(5): 445-449.LING Yin, WANG Shasha, CHEN Zepeng, et al. An experimental study of artificial bone vascularization was performed by contrast enhanced ultrasound[J]. Chinese Journal of Medical Physics, 2017,34(5): 445-449.
[8] 董晤讯, 袁翰, 马勇, 等. 骨血管生成机制与功能的研究进展[J].中国现代医学杂志, 2017, 27(27): 1-58.DONG Wuxun, YUAN Han, MA Yong, et al. Advances in the mechanism and function of angiogenesis in bone[J]. Chinese Journal of Modern Medicine, 2017, 27(27): 51-58.
[9] 鲍小刚, 许国华. 组织工程骨的快速血管化[J]. 中国组织工程研究, 2015, 19(7): 1063-1069.BAO Xiaogang, XU Guohua. Rapid vascularization of tissue engineering bone[J]. Chinese Organization Engineering Research,2015, 19(7): 1063-1069.
[10] HARRIS G M, RUTLEDGE K, CHENG Q, et al. Strategies to direct angiogenesis within scaffolds for bone tissue engineering[J].Curr Pharm Des, 2013, 19(19): 3456-3465.
[11] 庄跃宏. CT血管造影在皮瓣外科的研究进展[J]. 中国临床解剖学杂志, 2010, 28(4): 469-472.ZHUANG Yuehong. The development of CT angiography in flap surgery[J]. Chinese Journal of Clinical Anatomy, 2010, 28(4):469-472.
[12] PARMAR R, REDFERN D R, HILL J C. Comments on: Role of bone scintigraphy[J]. Ann R Coll Surg Engl, 2006, 88(5): 516-517.
[13] 蒋彦彦, 朱建平, 孙立. 超声造影评价颈动脉斑块内新生血管的应用研究[J]. 中国超声医学杂志, 2016, 32(9): 776-779.JIANG Yanyan, ZHU Jianping, SUN Li. The application of contrast enhanced ultrasound in the evaluation of neovascularization in carotid artery plaques[J]. Chinese Journal of Ultrasonic Medicine, 2016, 32(9): 776-779.
[14] RABIE A B, SHUM L. VEGF and bone formation in the glenoid fossa during forward mandibular positioning[J]. Am J Orthod Dentofacial Orthop, 2002, 122(2): 202-209.
[15] WANG H, ZHI W, LU X, et al. Comparative studies on ectopic bone formation in porous hydroxyapatite scaffolds with complementary pore structures[J]. Acta Biomaterialia, 2013, 9(9): 8413-8421.
