腹膜透析后包裹性腹膜硬化的CT诊断及鉴别
2018-05-23张繁关键林芝王焕军肖煦阳张皓钦郭燕陈应明
张繁, 关键, 林芝, 王焕军, 肖煦阳, 张皓钦, 郭燕, 陈应明
包裹性腹膜硬化(encapsulating peritoneal sclerosis,EPS) 是长期腹膜透析(peritoneal dialysis,PD)患者少见但非常严重的并发症,是因腹膜增厚和硬化而导致的一系列综合征。EPS发病率差异较大,为0.4%~8.9%,但总体呈上升趋势,病死率可高达25.8%~57.1%[1-4]。随着透析时间延长,发病率和病死率逐渐升高[5]。目前,国内外关于EPS的影像学报道相对较少,国内以个案报道为主,尚缺乏详细的影像学表现总结与分析[6-8]。本文回顾性24例EPS患者的临床及影像学表现,旨在提高对该病的认识。
材料与方法
1.病例资料
搜集2015年1月-2017年12月在我院临床诊断为EPS的患者24例,病例纳入标准:①患者有明确长期PD病史;②临床需排查EPS;③出现动力性肠梗阻。排除标准:①PD后转行血液透析,或PD、血液透析交替进行的患者;②年龄<18岁或>70岁的患者;③机械性肠梗阻患者,合并其他脏器问题(心衰、心功能不全等);④甲旁亢、结核患者。
24例患者已有3~17年持续PD病史。24例中男8例,女16例,年龄24~68岁,其中6例最终行肾移植。临床表现为腹痛腹胀10例,肠梗阻3例,超滤状态2例,反复血性腹腔积液3例,上消化道出血、皮肤瘙痒、手足麻木、恶心纳差、腹透液浑浊及发热各1例。24例患者均行腹部CT平扫1~3次(共54次)。
2005年Nakamoto[9]根据不同时期的临床和病理特点将EPS分为四期:无症状期表现为超滤量下降、腹膜高转运状态、低蛋白血症;炎症期表现为炎性指标升高、发热、血性腹透液/腹腔积液;进展期或包裹期表现为感染症状消失、肠梗阻症状出现;梗阻期表现为食欲缺乏、完全性肠梗阻、腹胀。本文结合CT表现将Nakamoto提出的分期合并简化分为轻症(无症状期、炎症期)与重症(进展期或包裹期、梗阻期)。
2.检查方法
CT检查采用Toshiba Aquilion 64层螺旋CT机。扫描参数:管电压120 kV,管电流200 mA,无间距容积数据采集,扫描范围自膈顶至盆底。由两位经验丰富的放射科医师对影像图像进行分析和测量。
结 果
轻症组(14例)PD时间为3~9年,平均(6.1±2.4)年。重症组(10例)PD时间为7~17年,平均(9.9±4.7)年。在PD时间超过5年的患者中,重症EPS的发生率明显增高;PD时间超过10年的患者均为重症EPS。
14例轻症组患者CT平扫图像均出现腹膜轻度增厚,增厚腹膜位于壁层腹膜游离缘、肝右叶边缘脏层腹膜、左膈面壁层腹膜,增厚腹膜厚度为2.5~5.0 mm;其中9例伴壁层腹膜小钙化灶,钙化位于双侧壁层腹膜游离缘,散在分布,钙化呈小点状、沙粒状。2例伴有小肠壁增厚水肿,增厚小肠壁厚度为8~10 mm。1例随访复查病例可见钙化灶从无至有的变化过程,钙化灶位于肝右叶下缘壁层腹膜游离缘(图1)。3例表现为单纯性腹膜增厚水肿(图2)。可出现腹部血管壁钙化,其中脾动脉5例,肠系膜上动脉2例,肝总动脉1例。
10例重症组患者CT平扫均表现为广泛的壁层和脏层腹膜、大网膜、肠系膜和小肠壁增厚,增厚腹膜厚度大于5.0 mm,增厚小肠壁厚度大于10 mm,合并壁层和脏层腹膜、大网膜、肠系膜及小肠壁多发钙化,钙化呈轨道状、短线状、簇状、团块状,钙化范围广泛;其中7例小肠管壁钙化明显,小肠失去正常的袢状分布,肠管固定、僵硬,可表现为管腔扩张和狭窄并存,肠襻呈“饼状”(图3)。其中5例患者CT随访可见腹膜钙化范围的进展(图4)。可出现腹部血管壁钙化,其中脾动脉4例,肠系膜上动脉1例,肝总动脉1例。其他并发症包括腹壁疝2例,血肿1例,包裹性积液2例(表1)。
临床诊疗及预后情况:轻症EPS患者制定CT随访计划,定时观察,对症处理。重症EPS患者停止腹膜透析,改行血液透析,更严重者进行肾移植。

表1 轻症和重症组EPS各项主要指标比较

图1 轻症EPS患者,女,66岁,持续腹膜透析7年。a) 初次CT平扫冠状面重组图像,未见腹膜钙化; b) 两年后CT平扫冠状面重组图像,右侧腹膜游离缘新增线状、小条状钙化灶(虚线框)。 图2 轻症EPS患者,男,68岁,持续腹膜透析3年。CT平扫冠状面重组图像可见肝下缘区腹膜增厚、密度增高(白箭),为单纯性腹膜增厚水肿;盆腔内可见腹膜透析管(黑箭)。 图3 重症EPS患者,女,51岁,持续腹膜透析7年。a) 腹部正位X线片,可见右侧中下腹部数个短小气-液平,但未见明确钙化; b) CT平扫冠状面重组图像可见小肠壁边缘广泛钙化,呈勾边样,受累小肠肠壁增厚水肿、粘连; c) CT平扫横轴面重组图像。
讨 论
1980年Gandhi等[10]最早报道了EPS,其特征性表现为反复小肠梗阻和腹膜硬化。EPS的病因及发病机制尚无定论,被广泛接受的是由Kawanishi等[11]提出的“二次打击学说”。目前还没有特异性的实验室指标可以诊断EPS,EPS的诊断需结合临床表现、影像学检查及病理学检查。英国EPS临床实践指南提出了两个主要标准[12]:①阻塞性肠梗阻的症状伴或不伴不同程度的系统性炎症反应;②影像学表现为腹膜增厚、硬化、钙化,小肠聚集成团。可见反复的血性腹腔积液,但不是EPS的特异性征象。
1.CT检查的意义
MSCT扫描范围广,视野大,可在较短时间内完成扫描,更加全面、直观地显示腹膜、肠壁及肠周的相关改变,是目前EPS首选的检查方法和监测手段[13-15]。公认的EPS的征象包括:腹膜增厚、腹膜强化、腹膜钙化、肠壁增厚、肠壁钙化,并可显示多种并发症,如肠粘连、肠梗阻、腹腔积液、导管口渗液、脓肿、疝、血肿、急性胰腺炎及缺血性肠病等[16,17]。本组EPS患者主要表现为腹膜及小肠壁增厚、钙化,小肠粘连并出现动力性肠梗阻等肠道并发症,血肿、疝等并发症与PD后EPS无相关性,属于肾功能不全终末期相关并发症,对PD后EPS的程度判断也没有帮助。剖腹手术或腹腔镜手术是确诊EPS的唯一方法,但通常不用,原因是与高发病率和病死率相关[18]。EPS没有特征性的组织学改变,因此腹膜的病理学改变对于EPS的诊断没有帮助。
CT能通过平扫和增强扫描再配合重组技术全面而准确地提供诊断信息,同时有助于一些并发症的检出以及排除其他原因的肠梗阻。但是由于腹透患者肾功能不全或肾衰竭,增强扫描对比剂的使用会导致超滤降低或残余肾功能降低,因此PD患者较少行增强扫描。有研究表明,较年轻患者(特别是<50岁)和长期PD病史(>4年)是EPS发生的强烈预测因子[19]。本研究24例EPS患者PD时间为3~17年,提示临床对于长期PD达3年以上的患者需行CT检查,以监测及诊断EPS。随着PD时间的延长,发生EPS的可能性越大,症状越严重。本研究中PD时间超过5年的患者中,重症EPS的发生率明显增高; PD时间超过10年的患者均为重症EPS。CT检查还可动态监测病情变化,本组6例患者在初次就诊时CT显示局限性肠壁钙化,两年后复查CT可见典型弥漫的肠壁钙化、腹膜增厚等表现,范围较前进展。
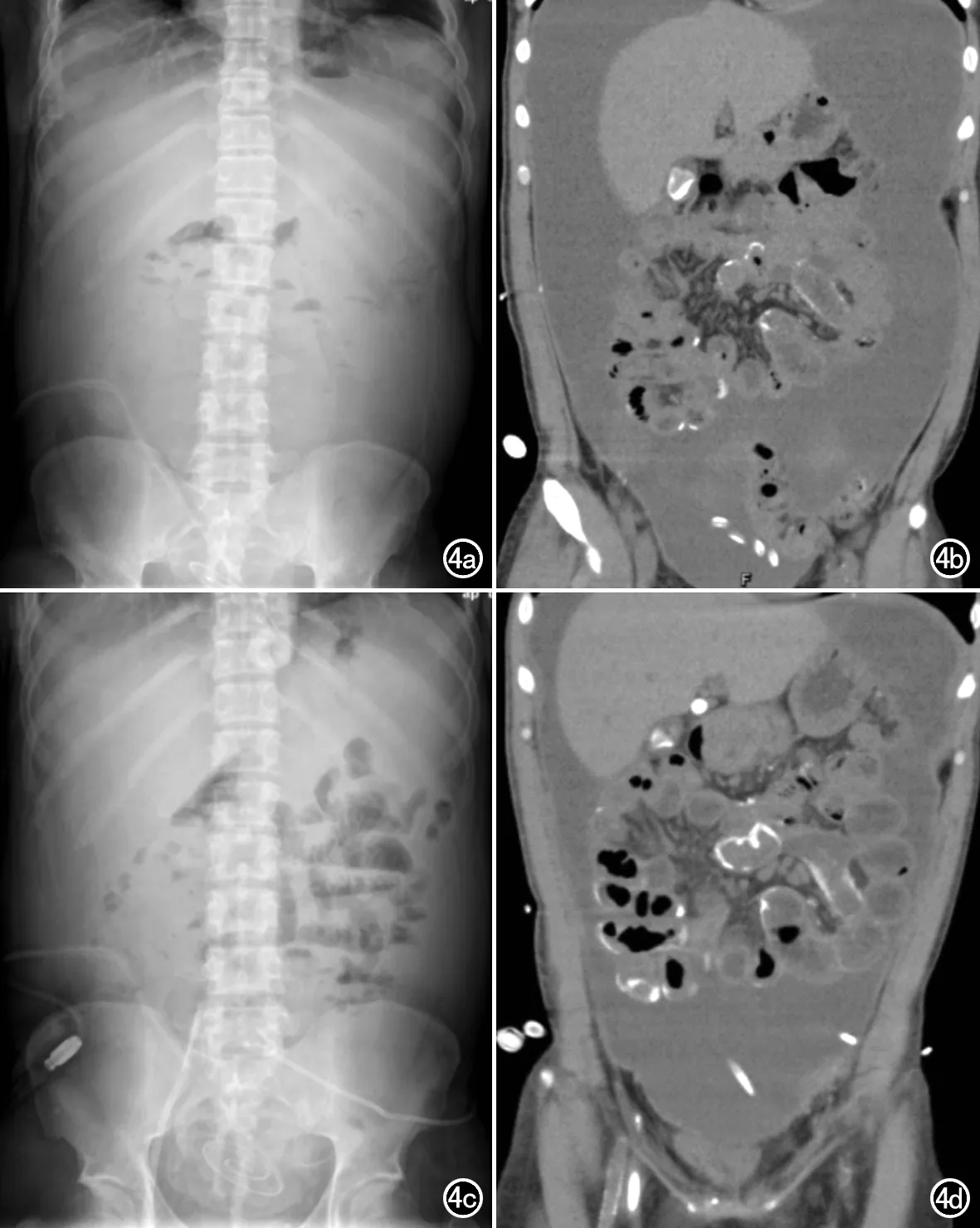
图4 重症EPS患者,男,33岁,持续腹膜透析6年。a) 初次就诊腹部正位X线片未见异常; b) 初次就诊CT平扫冠状面图像可见肠系膜及肠壁广泛增厚,腹膜散在小钙化灶,局部肠壁钙化,大量腹腔积液; c) 两年后复查腹部正位X线片示肠管扩张并多个液气平面分布,长短不一,多发气液平面; d) 两年后复查CT平扫冠状面重组图像可见弥漫性肠壁钙化,钙化范围明显进展;腹腔积液较前减少。
2.CT分型及表现
Nakamoto分期是结合患者的临床表现及病理特点进行分期,存在一定的交叉性和缺乏特异性,不能及时诊断及鉴别EPS。本研究结合CT表现,在Nakamoto分期的基础上,根据疾病在CT表现上的严重程度,将EPS分期合并简化,将CT上表现为腹膜局部轻度增厚,厚度小于5 mm,腹膜早期斑点状、小灶性钙化,钙化范围小于5处归类为轻症组(无症状期、炎症期);将腹膜、小肠钙化灶多于10处,并出现肠粘连、肠梗阻等归类为重症组(进展期或包裹期、梗阻期)。此种分类能更直观地通过分析其CT特点,对EPS进行诊断并分型。
本组病例中轻症组主要表现为腹膜增厚或伴腹膜小钙化灶,在EPS早期临床症状不明显时,影像上X线平片大多为阴性,但CT上若出现腹膜的增厚,伴或不伴腹膜少量钙化,应考虑轻症EPS的可能。随着疾病进展,CT检查显示腹膜密度增高、增厚,小肠扩张,腹膜、小肠壁增厚、钙化等征象,并且钙化呈边缘勾边状、块状广泛钙化,以及出现肠粘连、肠淤张,包裹性积液等并发症征象,则应考虑重症EPS的可能。多项研究比较了EPS患者与对照组PD患者的CT表现[20-22],一致认为EPS的主要CT表现为腹膜钙化、腹膜增厚、包裹性积液和小肠粘连,并且发现EPS患者与对照组之间有着非常显著的差异。
3.鉴别诊断
腹膜透析后发生的EPS需要与以下疾病相鉴别:①腹膜结核。腹膜结核多有结核密切接触史或肺结核病史,常继发于其他器官的结核病变[23]。可由腹腔内结核直接蔓延或血行播散,一般有发热、盗汗等全身症状。CT主要表现为腹膜呈饼状、结节状增厚,腹膜多有粘连,钙化不常见,钙化多位于腹膜、淋巴结和脏器;可见腹膜后淋巴结肿大、环形强化,常合并有其他部位结核。 ②静脉硬化性结肠炎。静脉硬化性结肠炎是以肠系膜上静脉的分支及结肠壁静脉管壁广泛钙化,合并右半结肠壁增厚为主要特征的一种罕见的缺血性结肠炎[24,25]。多发生于慢性肝病、门静脉高压患者。CT可见肠系膜上静脉及分支广泛钙化,肠系膜周围增多扭曲的侧支血管,右半结肠壁增厚,管壁及周围可见钙化。钙化多位于中远段回肠、右半结肠的系膜侧结肠壁及肠系膜上斑点状钙化,常合并有缺血性肠病。③血吸虫肠病。血吸虫病肠损害主要是由于虫卵沉积于肠壁导致的肉芽肿和纤维化,主要累及结肠[26,27]。腹部CT检查可见肠壁均匀不规则增厚及钙化,形成软组织团块。钙化主要位于直肠、降结肠和乙状结肠的黏膜及黏膜下,呈线状、轨道状。④腹茧症。腹茧症分为原发性和继发性,继发性腹茧症也可以是EPS的终末期改变,所以诊断腹茧症时应通过影像学表现及病史分析其真正病因,如果不是EPS导致,则继发性腹茧症可能与腹部结核性疾病、服用β-受体阻滞剂、开腹手术及胃肠道恶性肿瘤等相关[28]。继发性钙化多出现在腹膜,钙化特点与相关疾病类似。原发性腹茧症临床极少见,其特点是全部或部分小肠被一层致密、灰白色的纤维膜所包裹。CT上主要表现为小肠聚集成团,位置固定,系膜血管走行异常;可合并肠梗阻,肠襻周围及肠管间可见增厚的纤维包膜。
本研究存在以下不足:24例患者虽然按照经典的临床诊断标准纳入,但均未行外科手术探查,缺乏最终手术病理对照;其次,本研究为回顾性病例收集,因此病例资料的整齐性有所欠缺。
综上所述,轻症EPS在CT上表现为腹膜轻度增厚,伴或不伴腹膜少许钙化;重症EPS表现为腹膜、肠壁明显增厚伴广泛钙化,结合长期腹膜透析病史,可作出明确诊断。CT可作为EPS首选的检查方法,可诊断及动态监测EPS,并且可以通过以上指标鉴别腹膜透析后轻症与重症EPS,为临床后续治疗提供相关参考。
参考文献:
[1] Petrie MC,Traynor JP,Mactier RA.Incidence and outcome of encapsulating peritoneal sclerosis[J].Clin Kidney J,2016,9(4):624-629.
[2] Nakao M,Yamamoto I,Maruyama Y,et al.Risk factors for encapsulating peritoneal sclerosis: analysis of a 36-year experience in a University Hospital[J].Nephrology (Carlton),2017,22(11):907-912.
[3] Brown EA,Bargman J,van Biesen W,et al.Length of time on peritoneal dialysis and encapsulating peritoneal sclerosis[J].Perit Dial Int,2017,37(4):362-374.
[4] Vizzardi V,Sandrini M,Zecchini S,et al.Encapsulating peritoneal sclerosis in an Italian center:thirty year experience[J].J Nephrol,2016,29(2):259-267.
[5] Alatab S,Najafi I,Pourmand G,et al.Risk factors of severe peritoneal sclerosis in chronic peritoneal dialysis patients[J].Ren Fail,2017,39(1):32-39.
[6] 张紫媛,钟慧,程宗华,等.腹膜透析患者并发包裹性腹膜硬化一例[J].中华内科杂志,2012,51(7):562-563.
[7] 张贺,李振元,严豪,等.腹膜透析并发包裹性腹膜硬化症1例报道[J].上海交通大学学报(医学版),2016,36(11):1682-1684.
[8] 成梅初,肖娟,袁芳,等.维持性腹膜透析并包裹性腹膜硬化一例[J].医学临床研究,2008,25(11):2109-2110.
[9] Nakamoto H.Encapsulating peritoneal sclerosis- a clinician's approach to diagnosis and medical treatment[J].Perit Dial Int,2005,25(4):S30-S38.
[10] Gandhi VC,Humayun HM,Ing TS,et al.Sclerotic thickening of the peritoneal membrane in maintenance peritoneal dialysis patients[J].Arch Intern Med,1980,140(9):1201-1213.
[11] Kawanishi H,Moriishi M,Ide K,et al.Recommendation of the surgical option for treatment of encapsulating peritoneal sclerosis[J].Perit Dial Int,2008,28(3):205-210.
[12] Woodrow G,Augustine T,Brown EA,et al.Encapsulating peritoneal sclerosis clinical practice guidelines[J].UK EPS Clinical Guidelines Group,2009,29(6):595-600.
[13] George C,A1-Zwae K,Nair S,et al.Computed tomography appearances of sclerosing encapsulating peritonitis[J].Clin Radiol,2007,62(8):732-737.
[14] Cakir B,Kirbas I,Cevik B,et al.Complications of continuous ambulatory peritoneal dialysis:evaluation with CT[J].Diagn Interv Radiol,2008,14(4):212-220.
[15] Dejima K,Mitsuhashi H,Yasuda G,et al.Localization and extent of peritoneal calcification in three uremic patients on ontinuous ambulatory peritoneal dialysis[J].Ther Apher Dial,2008,12(5): 413-416.
[16] Choi JH,Kim JH,Kim JJ,et al.Large bowel obstruction caused by sclerosing peritonitis:contrast-enhanced CT findings[J].Br J Radiol,2004,77(916):344-346.
[17] Slim R,Tohme C,Yaghi C,et al.Sclerosing encapsulating peritonitis:a diagnostic dilemma[J].J Am Coll Surg,2005,200(6):974-975.
[18] Moinuddin Z,Summers A,Van Dellen D,et al.Encapsulating peritoneal sclerosis-a rare but devastating peritoneal disease[J].Front Physiol,2014,5(5):470.
[19] Johnson DW,Cho Y,Livingston BE,et al.Encapsulating peritoneal sclerosis:incidence,predictors,and outcomes[J].Kidney Int,2010,77(10):904-912.
[20] Tarzi RM,Lim A,Moser S,et al.Assessing the validity of an abdominal CT scoring system in the diagnosis of encapsulating peritoneal sclerosis[J].Clin J Am Soc Nephrol,2008,3(6):1702-1710.
[21] Upponi S,Butler AJ,Watson CJ,et al.Encapsulating peritoneal sclerosis-Correlation of radiological findings at CT with underlying pathogenesis[J].Clin Radiol,2014,69(1):103-109.
[22] Stuart S,Stott D,Goode A,et al.Can radiological assessment of abdominal computerized scans diagnose encapsulating peritoneal sclerosis in long-term peritoneal dialysis patients?[J].Nephrology,2017,22 (1) 19-24.
[23] Pereira JM,Madureira AJ,Vieira A,et al.Abdomineal tuberculosis:imaging features[J].Eur J Radiol,2005,55(2):173-180.
[24] Wang KC,Huang XY.Phlebosclerotic colitis:a rare disease in the Asian population[J].Chin Med J (Engl),2013,126(15):2998.
[25] Yen TS,Liu CA,Chiu NC,et al.Relationship between severity of venous calcifications and symptoms of phlebosclerotic colitis[J].World J Gastroenterol,2015,21(26):8148-8155.
[26] Zhang W,Wang PJ,Shen X,et al.CT presentations of colorectal cancer with chronic schistosomiasis:A comparative study with pathological findings[J].Eur J Radiol,2012,81(8):e835-e843.
[27] 海涌,田增喜,梁幼生.江苏省晚期血吸虫病现况调查[J].中国血吸虫病防治杂志,2009,21(5):400-403.
[28] Gadodia A,Sharma R,Jeyaseelan N.Tuberculous abdominal cocoon[J].Am J Trop Med Hygiene,2011,84(1):1-2.