SPME-GC-MS分析炭黑曲霉挥发性物质的条件优化
2018-05-23李梦华王国义张晓旭马丽艳李景明
李梦华,王国义,张晓旭,3,张 磊,程 湛,马丽艳,李景明,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京物资学院物流学院,北京 101149;3.天津科技大学食品工程与生物技术学院,天津 300457;4.新疆农业大学科研管理处,新疆 乌鲁木齐 830091)
炭黑曲霉(Aspergillus carbonarius)为曲霉属黑色曲霉菌,主要侵染葡萄、咖啡、可可和花生等食品[1],当食品受到炭黑曲霉污染后会出现腐败变质、营养散失等现象,甚至还会产生有毒的代谢物质——赭曲霉毒素(ochratoxin A,OTA)[2]。OTA对人体的危害仅次于黄曲霉毒素,它主要侵害人和动物的肾脏和肝脏[3],具有致畸[4]、致癌[5]、致突变[6]等作用,还具有免疫系统毒性[7]、神经毒性[8],被国际癌症研究机构定为2B级致癌物[9]。食品中有害微生物及真菌毒素的检测,通常使用微生物培养或液相色谱-质谱联用仪甚至分子学手段[10-12],这些方法不仅前处理复杂,检测耗时,而且所需设备投资大。因此,迫切需要建立一种快速、有效且较少损坏检测基质原有状态的方法,以便对食品和环境受微生物污染情况进行评价。
微生物在其代谢过程中通常会产生挥发性物质(microbial volatile organic compounds,MVOCs),它们是由微生物以乙酸盐、氨基酸、脂肪酸、酮酸和糖类等多种物质为底物,通过初级代谢和次级代谢过程形成的一类天然有机组分[13]。研究发现已有近1 000 种MVOCs被确定,可分为酮类、醇类、醛类、酯类、萜烯类、烃类和芳香类等[14-15]。这些物质往往具有较低的阈值,可以被人类的嗅觉所感知,并且在微生物菌落可见之前便可被检测到[16-17],因此具有广泛的应用前景。
不同种微生物产生的MVOCs具有种属特异性,因此MVOCs不仅可作为种属鉴别的标志物[18-19],在食品受微生物污染程度判断方面更具有应用潜力[20]。研究表明,3-辛酮、1-辛烯-3-醇等C8类物质多具有蘑菇、霉土气味,可作为食品腐败的标志性物质[21-22]。此外,MVOCs还与微生物毒素的产生有一定相关性[22],可用于探究微生物生长过程中特定生命活动(例如合成、积累真菌毒素等),从侧面阐明微生物代谢活动规律。综上可知,通过测定MVOCs的种类及含量,可为早期预测、预警食品腐败或毒素污染情况[23-24],尽早采取措施进行控制提供一种新的思路和途径。
固相微萃取-气相色谱-质谱联用(solid-phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)法[25]是近年来挥发性成分分析中较为经典的方法,具有简便操作、无需前处理及溶剂萃取、所需样品量少等优点,在食品、环境、天然产物、医药卫生、临床化学、毒理和法医学等诸多领域的研究中使用广泛[26-27],但针对真菌MVOCs的研究应用鲜有报道。本实验拟采用SPME-GC-MS法分析炭黑曲霉MVOCs,通过对萃取头涂层材料、萃取温度和萃取时间进行优化,以期得到基于SPME-GC-MS的炭黑曲霉MVOCs最佳分析鉴定方法,并对该方法进行评价,确立用于检测炭黑曲霉MVOCs的较好条件,为以后食品中霉菌污染情况的快速无损检测提供实验参考。
1 材料与方法
1.1 材料与试剂
2 株炭黑曲霉(Aspergillus carbonarius),编号分别为CCTCC AF2011004(AF菌)和CCTCC AF2015027(SD菌)获得于中国典型培养物保藏中心(CCTCC)。2 株菌筛选来源不同,其中AF菌从葡萄果实中分离得到[28],SD菌从葡萄干产品中分离得到[29]。
查氏酵母膏琼脂(CYA)培养基 北京奥博星生物技术有限责任公司;Milli Q water(电阻率≥18.2 Ω) 美国Millipore公司;正构烷烃C8~C20美国Supelco公司;挥发性组分标准样品(3-辛酮、1-辛烯-3-醇、2-辛烯-1-醇、棕榈酸甲酯、α-柏木烯、罗汉伯烯、β-法尼烯、β-花柏烯、花侧柏烯、反式-橙花叔醇、苯乙烯)、内标C14美国Sigma公司。
1.2 仪器与设备
LDZX-50FBS立式压力蒸汽灭菌器 上海申安医疗器械厂;XSZ-3G型显微镜 重庆国电仪器有限公司;DL-CJ-2ND型超净工作台 武汉爱斯佩科学仪器有限公司;DHP-9162型培养箱 上海一恒科技有限公司;固相微萃取手柄、固相微萃取头(50/30 μm DVB/CAR/PDMS、75 μm CAR/PDMS、100 μm PDMS、85 μm PA)、加热磁力搅拌器 美国Supelco公司;SPME样品瓶(30 mL) 中国安普公司;6890-5973 GC-MS联用仪、DB-5气相色谱柱(30 m×0.25 mm,0.25 µm)美国安捷伦公司。
1.3 方法
1.3.1 样品制备
菌株活化:从甘油管中吸取100 μL孢子悬液均匀涂布于CYA培养基平板上,25 ℃避光培养5 d,用接种环蘸取少量孢子在相同的培养条件下进行第二次活化,以获得活力较好的菌株。待培养基表面布满孢子后,加入10 mL 0.05%吐温80无菌溶液轻轻刮取,再用8 层纱布过滤掉菌丝,制得孢子悬液。显微镜计数,再用吐温80溶液稀释至孢子浓度为106个/mL。
样品培养:吸取10 mL配制好的CYA培养基到30 mL小瓶中,121 ℃高压灭菌20 min。灭菌后铺至斜面,待培养基凝固后,接种100 μL孢子悬液至斜面,摇匀,25 ℃避光培养5 d。
1.3.2 SPME分离
先将首次使用的固相微萃取头分别在GC的进样口于250 ℃老化至无杂峰。将10 μL 5 mg/L C14内标添加到培养炭黑曲霉的样品瓶内,放入一定温度的恒温水浴环境中。插入SPME装置到样品瓶中,推出萃取头,保持高度一致,顶空吸附一段时间,再将其从样品瓶中拔出,插入GC-MS进样口,推出萃取头于240 ℃解吸附7 min。
1.3.3 GC-MS分析
GC条件:参考Jeleń等[30]检测方法,色谱柱为极性色谱柱DB-5(30 m×0.25 mm,0.25 µm),进样口温度240 ℃,气相色谱升温程序:35 ℃保持1 min,以5 ℃/min的速度升温至230 ℃,再以20 ℃/min升温至280 ℃。载气为高纯氦气,流速1 mL/min,不分流进样。
MS条件:电子电离源,电离能量70 eV,离子源温度230 ℃;扫描模式为全扫描,质量范围为40~440 u。
1.3.4 定性定量方法
定性:鉴定结果由NIST08谱库检索保留指数、标准品共同确定。检索谱库结果按相似度大于800(最大值1 000)的原则作为鉴定结果。
定量:有标样的物质用线性回归方程进行定量,无标样的挥发性成分利用结构相似物质标准曲线进行定量[20,31]。
1.3.5 方法可行性评价
线性范围:对有标样的组分进行线性范围测定。分别配制不同浓度的混合标准溶液,在上述实验条件下找出它们的线性范围,绘制标准曲线。每条标曲由7 个浓度点组成,每个浓度点进行3 次方法学平行实验。
检出限(limit of detection,LOD)和定量限(limit of quantify,LOQ):符合信噪比为10的加标样品所对应的浓度为LOQ;符合信噪比为3的加标样品对应的浓度为LOD。
加标回收实验及精密度:加标实验要求在1 d内完成。将2 个水平的溶剂混标添加到空白培养基中,静置2 h以待标样浸入培养基中,每个水平重复6 次。当回收率在70%~120%范围内,相对标准偏差(relative standard division,RSD)低于20%时,可认为回收率符合要求;计算相对标准偏差作为精密度。
1.4 数据统计
实验结果以 ±s表示,数据采用SPSS 21.0数理分析统计软件进行单因素方差分析,P小于0.05为具有显著性差异,认为具有统计学意义。运用Excel软件进行图形绘制及处理。
2 结果与分析
2.1 固相微萃取头的选择结果
不同材质的萃取头对不同化合物的萃取效率不同,本实验选用了50/30 μm DVB/CAR/PDMS、75 μm CAR/PDMS、100 μm PDMS、85 μm PA四种萃取头在萃取温度45 ℃、萃取时间60 min的条件下,分别考察了其对炭黑曲霉MVOCs的萃取分离效果,得到的GC-MS总离子色谱图如图1所示。结果表明,DVB/CAR/PDMS萃取头能萃取到酯类、醇类、酮类、醛类物质和半萜烯类物质。尽管CAR/PDMS也萃取到了以上4 类化合物,但是萃取到的半萜烯类物质种类少于DVB/CAR/PDMS复合萃取头,且烃类物质萃取到的种类与响应也不如DVB/CAR/PDMS高。而PDMS和PA萃取头与DVB/CAR/PDMS复合萃取头相比,虽能萃取到更多的烃类物质,且响应水平高,但未能萃取到酯类物质,而且萃取到的半萜烯类物质种类较DVB/CAR/PDMS复合萃取头少、响应水平低。这与Jeleń[32]和Sun Dongdi[33]等的结果一致。本方法拟捕获较多种类物质以及达到较高响应度为原则,因此,最终选择DVB/CAR/PDMS复合涂层萃取头作为炭黑曲霉MVOCs的萃取涂层。

图1 4 种萃取头MVOCs总离子流图Fig. 1 Total ion current (TIC) chromatograms of MVOCs extracted with four different SPME fibers
2.2 SPME温度的选择结果
温度对SPME效果有双重效应。温度升高,一方面可加速样品中MVOCs的运动,有利于SPME;另一方面也会增加萃取头的解吸速度,从而降低萃取效率。本实验参考Jeleń等[21]的研究,用DVB/CAR/PDM萃取头在45、60 ℃和75 ℃条件下进行优化,结果如图2所示,随着提取温度升高,各类物质的相对含量(与内标峰面积的比值)总和也随之升高。但当温度升高至75 ℃时,培养基融化,无法维持原有形态,影响萃取效果。因此,最终选择60 ℃作为炭黑曲霉MVOCs的最佳萃取温度。
2.3 萃取时间的选择结果

图2 不同萃取条件下酯、醇酮醛、半萜烯和烃类物质相对含量和总峰面积比较Fig. 2 Comparison of relative content and total peak area of MVOCs under different extraction conditions
如图2所示,随着萃取时间延长,酯类、萜烯类和烃类物质呈现先升高后降低的趋势;而醇、酮、醛类物质则随着提取时间延长,提取效率一直升高,但30 min延长到60 min其相对含量显著升高,而60 min到90 min升高幅度不大。总峰面积的变化规律与醇、酮、醛类物质变化规律相似,随着时间的延长,提取效率升高,但60 min到90 min提升幅度不大。因此,综合考虑提取效率和高效省时问题,最终选择60 min为炭黑曲霉MVOCs的最佳萃取时间。
2.4 方法学评价
采用上述建立的提取检测方法,参考Jeleń等[34]检测到的炭黑曲霉MVOCs结果,选取各类物质中含量较高的组分标准品进行方法学评价实验。结果如表1所示,线性回归方程在相应的线性范围内,线性良好,回归系数均高于0.99。加标回收率均在80%~120%之间,符合方法学要求。全部标准品的LOD值在0.01~0.05 mg/L之间;LOQ值在0.03~0.17 mg/L之间。可见该方法的灵敏度较高,对于真菌生长初期的痕量挥发性组分也能准确定量。

表1 MVOCs加标回收率、线性回归方程以及回归系数Table 1 Recoveries, linear regression equations and regression coefficients of MVOCs
2.5 炭黑曲霉MVOCs分析鉴定

图3 炭黑曲霉GC-MS总离子流图Fig. 3 TIC chromatograms of MVOCs from A. carbonarius
实验采用上述建立的提取方法,结合GC-MS对SD菌和AF菌两株炭黑曲霉菌培养5 d过程中的MVOCs进行检测。如图3所示,共检测到32 种MVOCs。在这些MVOCs中,醛类物质1 种,酮类物质1 种,醇类物质2 种,酯类物质6 种,半萜烯类物质10 种,烃类物质11 种和环化二缩酸酐物质1 种。表2列出了全部物质的定性方式、保留指数。所有物质经过NIST库比对,相似度均在800以上,计算出的保留指数与文献进行比对,差值均在50以内,此外对于有标样的组分还根据保留时间进一步定性。因而本方法对检测到的32 个MVOCs定性准确。
两株炭黑曲霉生长过程中MVOCs的定量情况如表2所示。首先,2 株曲霉均检测到3-辛酮、2-辛醛、1-辛烯-3-醇和2-辛烯-1醇。这与先前研究中报道的C8化合物相一致[21-22]。这些C8类物质呈现蘑菇气味,被作为食品腐败的标志性物质[22]。且炭黑曲霉中检测到的这些C8化合物含量呈现先升高再降低的趋势,均在生长到第3天时达到最高值,这可能与第3天霉菌开始产孢、产毒素有着某种关联。其次,在2 株炭黑曲霉中检测到的酯类物质均为脂肪酸甲酯,包括辛酸、4-癸烯酸、十五烷酸、棕榈酸、亚油酸和油酸。在本实验中,酯类物质在真菌生长第2天的时候大量合成,第3天总量降低,而第3天时炭黑曲霉的黑色孢子开始产生,其代谢可能与真菌产孢相关。2 株炭黑曲霉共检测到11 种半萜烯类化合物,均检测到了反式橙花叔醇,其含量变化规律一致,均呈现先升高后降低的趋势。另外AF菌种还检测到了柏木烯、罗汉伯烯、长蒎烯、花柏烯、雪松烯等,SD菌中还检测到β-法尼烯。苯乙烯是2 种炭黑曲霉均产生的烃类物质,在2 株菌生长过程中,其含量变化规律一致,均呈现先升高后降低的趋势,并在第4天达到最大值。其他10 种烃类物质在不同的真菌中被检测到[35]。

表2 炭黑曲霉MVOCs及其保留指数、定性方法和气味描述Table 2 Retention index and odor description of MVOCs
将检测到的MVOCs,按照其嗅觉感官特征描述(表2)进行分类,可以将其划分为霉味、蘑菇味、木头味、化学烃味、脂肪味、水果味、草本味7 大类物质。将2 种菌中5 d生长过程中检测到的MVOCs按照上述感官特征分类进行汇总,根据其含量之和绘制雷达图,结果如图4所示。从图4可以看到,在5 d生长期内,2 种炭黑曲霉所产生的MVOCs总量均具有明显差异。尽管2 种菌生长过程中在不同的感官特性上的积累各有不同,但是具有蘑菇味的挥发性成分在2 种菌含量均为最高,这种高浓度的积累在两种菌生长到第3天时表现最为明显。蘑菇气味的贡献者主要是1-辛烯-3-醇,它是霉菌产生的典型MVOCs,可作为食品腐败的标志物[22]。化学烃气味化合物的积累仅次于蘑菇气味成分积累,2 株菌表现的规律一致,从第2天达到显著积累后,化学烃类挥发性成分就一直保持着较高水平的稳定存在。综上可知,2 株菌生长过程中产生的MVOCs具有显著差异,其种类和含量是不断变化的,但二者具有一定的共性。这与Poliziz等[18-19]的研究结果一致,微生物的MVOCs可能与微生物毒素的产生有一定相关性,可作为食品污染指示剂,用来判定食品是否发生腐败或发生腐败的程度。


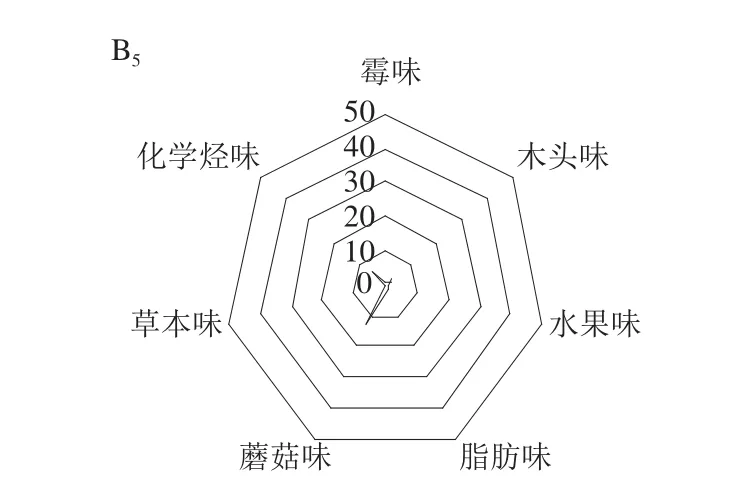
图4 两株菌MVOCs感官特征雷达图Fig. 4 Spider graphs for MVOCs from two strains
3 结 论
本实验采用SPME-GC-MS联用技术建立了一种检测炭黑曲霉生长过程中MVOCs的检测方法:选用3 种涂料复合萃取头(DVB/CAR/PDMS)、萃取温度60 ℃、萃取时间60 min。对2 株不同的炭黑曲霉MVOCs进行了分析,结果共检测到32 种挥发性组分,其中有1 种醛类物质、1 种酮类物质、2 种醇类物质、6 种酯类物质、10 种半萜烯类物质、11 种烃类物以及1 种环化二缩酸酐物质。通过对上述MVOCs的检测可以发现,2株炭黑曲霉在生长过程中,MVOCs的种类和含量均不断变化,并在不同生长期其挥发性成分表现出蘑菇味、化学烃味等不同的感官特性,证明挖掘其生长期间的标志性挥发性产物,可以为食品微生物污染的快速检测提供依据。
参考文献:
[1]蒋春美, 师俊玲, 刘延琳, 等. 葡萄中产赭曲霉毒素A炭黑曲霉的控制方法[J]. 食品安全质量检测学报, 2016, 7(6): 2168-2174.
[2]赵伟睿, 马海乐, 刘斌. 微生物挥发性物质及其在食品工业中的应用[J]. 食品科技, 2009(8): 32-37.
[3]BOZAICA R, RADOVAN F, MAJA P, et al. Ochratoxin A in human sera in the area with endemic nephropathy in Croatia[J]. Toxicology Letters, 1997, 91(2): 105-109. DOI:10.1016/S0378-4274(97)03877-0.
[4]HAYES A W, MELTON R, SMITH S J. Effect of aflatoxin B1,ochratoxin and rubratoxin B on a protozoan, Tetrahymena pyriformis HSM[J]. Bulletin of Environmental Contamination and Toxicology,1974, 11(4): 321-325.
[5]RACHED E, HARD G C, BLUMBACH K, et al. Ochratoxin A:13-week oral toxicity and cell proliferation in male F344/N rats[J].Toxicological Sciences, 2007, 97(2): 288-298. DOI:10.1093/toxsci/kfm042.
[6]MAVURA K, PARKER R, BEMDT W O, et al. Ochratoxin A-induced teratogenesis in rats: partial protection by phenylalanine[J]. Applied and Environmental Microbiology, 1984, 48(6): 1186-1188.
[7]MÜLLER G, ROSNER H, ROHRMANN B, et al. Effects of the mycotoxin ochratoxin A and some of its metabolites on the human cell line THP-1[J]. Toxicology, 2003, 184(1): 69-82. DOI:10.1016/S0191-2615(98)00007-1.
[8]SOLEAS G J, YAN J, GOLDBERG D M. Assay of ochratoxin A in wine and beer by high-pressure liquid chromatography photodiode array and gas chromatography mass selective detection[J].Agricultural Food Chemistry, 2001, 49: 2733-2740. DOI:10.1021/jf0100651.
[9]Some naturally occurring substances: Food items and constituents,heterocyclic aromatic amines and mycotoxins[C]. Carcinógenos:International Agency for Research on Cancer(IARC), 1993.
[10]MEDINA A, MATEO R, LOPEZOCANA L, et al. Study of Spanish grape mycobiota and ochratoxin A production by isolates of Aspergillus tubingensis and other members of Aspergillus section Nigri[J]. Applied and Environmental Microbiology, 2005, 71(8): 4696-4702. DOI:10.1128/AEM.71.8.4696-4702.2005.
[11]HAN Z, ZhENG Y, LUAN L, et al. Analysis of ochratoxin A and ochratoxin B in traditional Chinese medicines by ultra-highperformance liquid chromatography-tandem mass spectrometry using [13C20]-ochratoxin A as an internal standard[J]. Journal of Chromatography A, 2010, 1217(1217): 4365-4374. DOI:10.1016/j.chroma.2010.04.052.
[12]GALLO A, BRUNO K S, SOLFRIZZO M, et al. New insight into the ochratoxin A biosynthetic pathway through deletion of a nonribosomal peptide synthetase gene in Aspergillus carbonarius[J]. Applied Environmental Microbiology, 2012, 78: 8208-8218. DOI:10.1128/AEM.02508-12.
[13]JELEN H, WASOWICZ E. Volatile fungal metabolites and their relation to the spoilage of agricultural commodities[J].Food Reviews International, 1998, 14(4): 391-426.DOI:10.1080/87559129809541170.
[14]KORPI A, JAMBERG J, PASANEN A L. Microbial volatile organic compounds[J]. Critical Reviews in Toxicology, 2009, 39(2): 139-193.DOI:10.1080/10408440802291497.
[15]LEMFACK M C, NICKEL J, DUNKEL M, et al. MVOC: a database of microbial volatiles[J]. Nucleic Acids Research, 2014, 42(D1):744-748. DOI:10.1093/nar/gkt1250.
[16]ARGYRI A A, MALLOUCHOS A, PANAGOU E Z, et al. The dynamics of the HS/SPME-GC/MS as a tool to assess the spoilage of minced beef stored under different packaging and temperature conditions[J]. International Journal of Food Microbiology, 2015, 193:51-58. DOI:10.1016/j.ijfoodmicro.2014.09.020.
[17]KESHRI G, VOYSEY P, MAGAN N. Early detection of spoilage moulds in bread using volatile production patterns and quantitative enzyme assays[J]. Journal of Applied Microbiology, 2002, 92(1):165-172. DOI:10.1046/j.1365-2672.2002.01515.x.
[18]POLIZZI V, ADAMS A, MALYSHEVA S V, et al. Identification of volatile markers for indoor fungal growth and chemotaxonomic classification of Aspergillus species[J]. Fungal Biology, 2012, 116(9):941-953. DOI:10.1016/j.funbio.2012.06.001.
[19]POLIZZI V, ADAMS A, DE S S, et al. Influence of various growth parameters on fungal growth and volatile metabolite production by indoor molds[J]. Science of the Total Environment, 2012, 414:277-286. DOI:10.1016/j.scitotenv.2011.10.035.
[20]LAMANAKA B T, TEIXEIRA A A, TEIXEIRA A R R, et al. Potential of volatile compounds produced by fungi to influence sensory quality of coffee beverage[J]. Food Research International, 2014, 64: 166-170.DOI:10.1016/j.foodres.2014.06.017.
[21]GREENE-MCDOWELLE D M, INGBER B, WRIGHT M S, et al.The effects of selected cotton-leaf volatiles on growth, development and aflatoxin production of Aspergillus parasiticus[J]. Toxicon, 1999,37(6): 883-893. DOI:10.1016/S0041-0101(98)00209-8.
[22]HUNG R, LEE S, BENNETT J W. Fungal volatile organic compounds and their role in ecosystems Korpi[J]. Applied Microbiology and Biotechnology, 2015, 99(8): 3395-3405. DOI:10.1007/s00253-015-6494-4.
[23]KAMINŚKI E, LIBBEY L M, STAWICKI S, et al. Identifi cation of the predominant volatile compounds produced by Aspergillus flavus[J].Applied and Environmental Microbiolog, 1972, 24: 721-726.
[24]ABRAMSON D, SINHA R N, MILLS J T. Mycotoxin and odor formation in moist cereal grain during granary storage[J]. Cereal Chemistry, 1980, 57(5): 346-351.
[25]WERCINSKI S A. Solid phase microextraction: a practical guide[M].New York: CRC Press, 1999: 123-124.
[26]欧阳钢峰. 固相微萃取原理与应用[M]. 北京: 化学工业出版社,2012: 15-16.
[27]刘俊亭. 新一代萃取分离技术: 固相微萃取[J]. 色谱, 1997, 15(2):118-119.
[28]JIANG C, SHI J, LIU Y, et al. Inhibition of Aspergillus carbonarius,and fungal contamination in table grapes using Bacillus subtilis[J]. Food Control, 2014, 35(1): 41-48. DOI:10.1016/j.foodcont.2013.06.054.
[29]冯赛赛. 葡萄干中OTA污染调查、产生菌的分离鉴定及炭黑曲霉pks基因敲除盒的构建[D]. 北京: 中国农业大学, 2015.
[30]JELÉN H H, MIROCHA C J, WASOWICZ E, et al. Production of volatile sesquiterpenes by Fusarium sambucinum strains with different abilities to synthesize trichothecenes[J]. Applied & Environmental Microbiology, 1995, 61(11): 3815-3820.
[31]龙奇志, 黄永辉, 钟海雁. 茶油挥发性成分的固相微萃取-气相色谱-质谱分析[J]. 中国食品学报, 2009, 9(3): 187-194. DOI:10.3969/j.issn.1009-7848.2009.03.031.
[32]JELEŃ H H. Use of solid phase microextraction (SPME) for profi ling fungal volatile metabolites[J]. Letters in Applied Microbiology, 2003,36(5): 263-267. DOI:10.1046/j.1472-765X.2003.01305.x.
[33]SUN D, WOODJONES A, WANG W, et al. Monitoring MVOC profi les over time from isolates of Aspergillus fl avus using SPME GCMS[J]. Journal of Agricultural Chemistry & Environment, 2014, 3(2):48-63. DOI:10.4236/jacen.2014.32007.
[34]JELEŃ H H, GRABARKIEWICZ-SZCZESNA J. Volatile compounds of Aspergillus strains with different abilities to produce ochratoxin A[J]. Journal of Agricultural and Food Chemistry, 2005, 53:1678-1683. DOI:10.1021/jf0487396.
[35]SINHA M, SØRENSEN A, AHAMED A, et al. Production of hydrocarbons by Aspergillus carbonarius ITEM 5010[J]. Fungal Biology, 2015, 119(4): 274-282. DOI:10.1016/j.funbio.2015.01.001.
