采收期谷物中真菌毒素产毒菌的筛选鉴定
2018-05-23裴世春高建伟韩基东
裴世春,李 妍,高建伟,王 岩,王 琳,韩基东
(1.通化师范学院食品科学与工程学院,吉林 通化 134002;2.齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006;3.普菲特益斯生物科技(北京)有限公司,北京 101111;4.岭南大学生命应用科学学院,韩国 大邱 38541)
真菌毒素是真菌在一定的条件下分泌的有毒二次代谢产物,主要是由Fusarium sp.、Penicillium sp.和Aspergillus sp.中的部分产毒真菌代谢所产生,其中常见的真菌毒素主要包括玉米赤霉烯酮(zearalenone,ZON)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、T-2毒素、伏马毒素B1(fumonisin B1,FB1)、伏马毒素B2(fumonisin B2,FB2)、橘青霉素、展青霉素(patulin,Pat)、黄曲霉毒素B1(afulatoxin B1,AFB1)、黄曲霉毒素M1(aflatoxin M1,AFM1)和赭曲霉毒素A(ochratoxin A,OTA)等10余种[1-3]。
从国内外的研究结果可知[2-3],各种粮食作物、水果蔬菜和加工食品中均有不同程度的真菌及真菌毒素的污染,其中粮食作物中真菌毒素的污染普遍较为严重,因此世界多数国家和地区均制定了严格的真菌毒素法定残留限量标准,我国也在最新实施的食品安全国家标准GB 2761—2017《食品中真菌毒素限量》中对ZON、DON、Pat、AFB1、AFM1和OTA等真菌毒素在不同农产品及其加工制品中的残留限量进行了设定[4],该标准的出台不仅保障了我国农产品及其加工制品的安全性,同时也为我国农产品中真菌和真菌毒素污染相关的基础性调查研究提供了相关标准。
东北地区是我国主要的商品粮生产基地,该地区生产的商品粮安全性关系到全国消费者的饮食安全,特别是东北地区采收期间谷物是否污染有产毒性真菌,对后期商品粮的储藏、运输和加工中的安全性具有决定性的影响,因此有必要对东北地区采收期间谷物中的产毒性真菌开展调查研究。
本实验将利用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)、超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)联用技术和聚合酶链式反应(polymerase chain reaction,PCR)为分析工具,通过筛选和鉴定东北地区采收期间小麦、玉米和水稻中的产毒性真菌,分析东北地区采收期粮食中潜在的真菌毒素安全风险,以期为相关部门针对性的制定真菌危害防控措施和风险评估提供基础性资料。
1 材料与方法
1.1 材料与试剂
小麦、玉米和水稻东北粮食种植区采收期间田间采集;ZON、AFB1、FB、DON 美国Sigma公司;真菌毒素检测ELISA试剂盒 普菲特益斯生物科技(北京)有限公司;DNA提取试剂盒 杭州博日科技有限公司;DNA Marker、正反引物、蛋白酶K、Agarose M、1×TE等 生工生物工程(上海)股份有限公司;10×Buffer、dNTP、Taq酶 宝生物工程(大连)有限公司;PDA培养基 天津凯通化学试剂有限公司;其他化学试剂为国产分析纯。
1.2 仪器与设备
2720 Theraml Cycler PCR扩增仪 美国Applied Biosystems公司;UPLC-MS/MS联用仪(LC-30A色谱与LCMS-8040三重四极杆质谱联用系统(配置LC-30AD×2输液泵、DGU-20A5在线脱气、SIL-30AC自动进样器、CTO-30A柱温箱、CBM-20A系统控制器、LabSolutions Ver. 5.50色谱工作站)) 日本岛津公司;VICTOR X4多功能酶标仪、Wahser 400 96 孔洗板机 美国GE公司;超滤杯、超纯水系统 美国密理博公司;WP25AB台式电热恒温培养箱 天津市泰斯特仪器有限公司;WD-9413A凝胶成像分析仪、DYY-6C电泳仪 北京市六一仪器厂。
1.3 方法
1.3.1 镰刀菌分离
样品根据GB 4789.1—2010《食品微生物学检验 总则》[5]中样品的采集规则进行采样。于2016年10月采集东北三省粮食种植区的小麦、玉米和水稻样品共300 份。每份小麦、水稻和玉米样品中随机选取50~100 粒,分别放入50 mL的离心管内,加入20~30 mL的体积分数75%乙醇溶液表面消毒1 min后将离心管内的乙醇倒掉,无菌水重复清洗4 次,将清洗消毒好的样品,放置于无菌滤纸上干燥,干燥好的样品放到灭菌,马铃薯葡萄糖琼脂(potato dextrose agar,PDA)平板培养基中,25 ℃恒温培养,挑选长出的菌丝无菌接种到新的PDA培养基上,25 ℃的恒温培养,经多次反复分离,直至菌丝纯化后4 ℃保存待用。
1.3.2 基于ELISA的产毒菌初筛
将纯化菌丝无菌接种到10 mL灭菌PSC(peptone sucrose Czapek)培养基(蔗糖30 g、硝酸钾0.75g、酵母浸出膏0.5 g、蛋白胨10 g、硝酸钠3.0 g、硫酸镁0.25 g、磷酸氢二钾0.5 g、氯化钾0.25 g、硫酸铁0.012 5 g、500 mL蒸馏水)中,120 r/min,25 ℃的恒温振荡箱中培养14 d后进行高温灭菌,灭菌培养基利用Whatman No. 1滤纸过滤后,滤液离心取上清液,稀释后利用ELISA试剂盒筛选阳性样品。
1.3.3 基于LCMS-8040三重四极杆质谱仪的产毒性能定性分析
经ELISA初筛阳性的PSC培养基用正己烷和石油醚进行脱脂,脱脂菌液用苯(1∶1,V/V)为萃取剂萃取3 次,合并萃取液旋蒸至干后用甲醇定容,UPLC-MS/MS仪进行定性检测。
色谱柱:Shim-pack XR-ODS III(2.0 mm×75 mm,1.6 µm);流动相:A为0.02%乙酸和2 mmol/L乙酸铵溶液,B为甲醇;流速0.3 mL/min;进样体积3 µL;柱温40 ℃;梯度洗脱 0~1 min 20% B,1~11 min 35% B,11~13 min 50% B,13~14 min 50% B,14~18 min 95% B,18~20 min 95% B,20~21 min 10% B,21~21.1 min 20% B。
离子源:电喷雾电离,正负离子扫描;干燥气:氮气,流速15 L/min;离子源接口电压:4.5~3.5 kV;脱溶剂管温度:250 ℃;加热模块温度:450 ℃;扫描模式:多反应监测;驻留时间:10 ms。
1.3.4 基于PCR的产毒菌鉴定
基于PCR的产毒菌鉴定参照White[6]和Pei[7]等方法调整后进行,具体是将产毒菌提取DNA后,采用通用引物ITS1:5’-TCCGTAGGTGAACCTGCGG-3’和ITS4:5’-TCCTCCGCTTATTGATATGC-3’进行扩增,PCR体系为25 μL,所需试剂及用量如表1所示。反应条件为:95 ℃预变性 3 min,94 ℃变性40 s,各组引物53 ℃退火40 s,72 ℃延伸90 s,进行35 个循环,最后72 ℃延伸7 min。凝胶电泳检测PCR产物:用1.0×TAE电泳缓冲液制备1.0%的琼脂糖凝胶,将8 µL PCR产物加入到对应的凝胶孔中,另在一孔加入适量的DNA分子质量标记物,电泳后凝胶成像系统中观察PCR产物片段。
PCR产物由吉林省库美生物科技有限公司测序。测序结果在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)中使用BLAST程序进行比对。
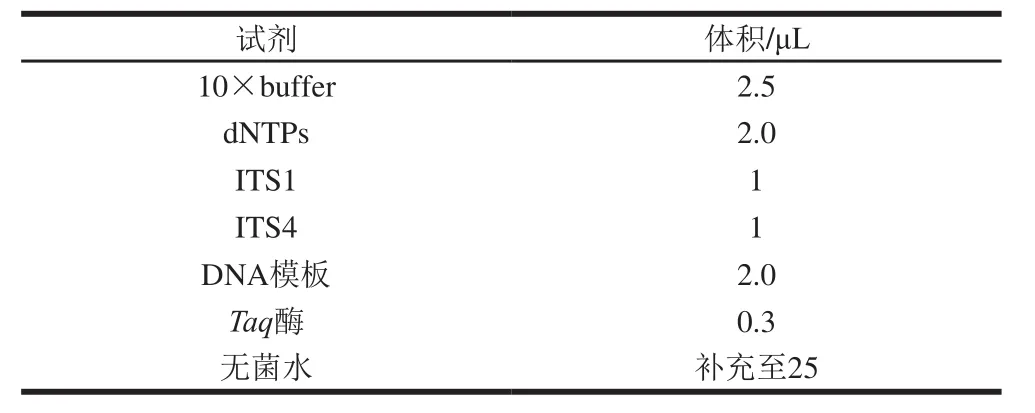
表1 PCR所需试剂及用量Table 1 Volumes of reagents used for PCR reaction
2 结果与分析
2.1 基于ELISA的产毒阳性菌初筛
通常真菌毒素的定性定量测定方法有薄层色谱、HPLC、气相色谱以及UPLC-MS/MS联用等方法[8-11],虽然色谱的方法具有精确可靠的优势,但是色谱方法通常需要进行真菌毒素的有机溶剂提取、浓缩、过柱和纯化等处理过程,对大量分离菌的培养液进行检测时需要耗费大量的样品前处理时间和前处理费用,而基于抗原抗体特异性反应的ELISA的方法筛选产毒性阳性菌的过程中可以省略繁琐的前处理过程,直接将培养液进行适当稀释后进行高通量检测[12-17]。
因此,本实验是采用ELISA试剂盒对采集的300 份谷物样品中分离出的菌进行了产毒性检测,其结果如图1所示,基于ELISA共初筛出73 株产毒阳性真菌,其中以产DON为主的阳性菌株有51株,产毒性在1.4~190.0 ng/mL之间,产ZON为主的菌株16 株,产毒性在4.9~161.3 ng/mL之间,产FB为主的阳性菌株6 株,产毒性在5.0~97.4 ng/mL之间,AFB1产毒菌没有筛选到。

图1 真菌毒素产毒性阳性真菌的ELISA初筛Fig. 1 Screening of positive mycotoxin-producing strains by ELISA
李妍等[18]对粮食样品中ZON的ELISA检测方法和UPLC法比较研究结果表明,ELISA检测为阴性的样品利用UPLC-MS/MS方法检测100%为阴性,而ELISA检测为阳性的样品中经UPLC-MS/MS法鉴定也有近60%的假阳性;余容等[19]对比国内外DON检测试剂盒的实验也显示ELISA的检测结果数据普遍高于HPLC的检测结果;刘师文等[20]对FB1的ELISA和HPLC检测方法对比结果表明,二者虽然具有良好的相关性,但是针对同一个阳性样品,ELISA的检测数据普遍高于HPLC的检测数据。分析以上研究结果可知ELISA检测方法假阳性率较高,但是基于这一点,可以利用ELISA检测结果排除阴性样品方面却具有良好的可行性,因此,本实验中分离菌的液体培养样品中利用ELISA检测为产毒性阴性的分离菌均判断为不产真菌毒素的菌株,实验中免去了后续进一步鉴定和分析的步骤,加快了产毒菌的筛选效率,对ELISA筛选出的阳性样品则通过质谱进行了进一步的阳性验证。
2.2 基于LC MS-8040三重四极杆质谱仪的阳性分离菌的验证
为了应用LC MS-8040三重四极杆质谱仪进一步验证ELSIA初筛阳性菌的产毒性,首先对DON、ZON、FB和AFB1等真菌毒素标准物质进行了定性测定,其结果如图2所示。DON出峰时间为2.152 min,AFB1出峰时间为13.955 min,FB1出峰时间为16.343 min,FB2出峰时间为17.351 min,ZON出峰时间为17.272 min,分离效果良好,可以同时精确定性分析5 种真菌毒素。

图2 标准毒素MRM色谱图Fig. 2 MRM chromatograms of standard toxins

表2 LC MS-8040三重四极杆质谱验证分离菌的产毒性Table 2 Identification of mycotoxin-producing strains by LC-MS/MS
利用LC MS-8040三重四极杆质谱仪对ELISA筛选出的73 株产毒性阳性菌进行验证分析结果如表2所示,共验证出6 株分离菌产DON毒素,其中有4 株分离菌产DON的同时也产ZON毒素,有一株分离菌产FB毒素。
本实验筛选经LCMS-8040-三重四极杆质谱仪验证的阳性菌株显著小于ELISA分离的阳性菌株,这一结果进一步说明了ELISA检测结果虽然灵敏度高,但是在痕量真菌毒素检测中极易产生假阳性,另外,由于本实验是从几百份谷物样品中分离真菌,分离菌的数量庞大,无法在短时间内采用固体培养基培养法制备富集高浓度的样品后进行产毒性UPLC-MS/MS分析,因此利用试管小量液体培养分离菌后经提取进行的质谱分析有可能因液体培养过程中受到基质等因素影响[21]以及分泌的毒素含量过低而未能检测出分泌微量真菌毒素的产毒菌。即便如此,也能联合运用ELISA和LCMS-8040三重四极杆质谱方法能够从大量分离菌中快速筛查到产毒性真菌,因此,该方法适用于高产毒性真菌的分离筛选,该方法体系对快速判断采收期谷物中是否污染有产毒性真菌,进而对采收的谷物运输、储藏和加工之前采取安全相关措施具有良好的实用价值。
2.3 基于PCR的产毒菌鉴定
PCR技术可以在真菌的鉴定过程中减少鉴定难度,是具有良好应用前景的技术方法,众多研究者[22-25]都对基于PCR技术的产毒性菌株的鉴定给予了良好的评价。

图3 利用ITs1和ITs4引物进行PCR扩增镰刀菌的电泳图Fig. 3 Electrophoresis of PCR amplified roducts from Fusarium using ITs1 and ITs4 primers
本实验利用通用引物ITS1、ITS4扩增了菌的基因组DNA,其扩增产物DNA条带如图3所示,DNA片段大小为520 bp左右,并且扩增产物条带单一且清晰可见,扩增产物进行测序后利用BLAST进行了基因序列比对,结果如图4、表3所示,所测定的菌与美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)中相应菌株的相似度均超过99%,进而可以判断本实验的分离菌分别为F. asiaticum、F. graminearum、F. poae和F. fujikuroi。


图4 F. poae(a)、F. asiaticum(b)、F. graminearum(c)和F. fujikuroi(d)测序结果比对Fig. 4 Comparison of sequencing results among F. poae (a),F. asiaticum (b), F. graminearum (c) and F. fujikuroi (d)

表3 所测菌株基因序列与基因库中现有序列比对结果Table 3 Comparison of the sequences of the tested strains with GenBank sequences
综合表2、3可知,本实验采集的东北地区采收期粮食中产DON和ZON的产毒菌种类经鉴定为F. asiaticum、F. graminearum、F. poae和F. fujikuroi等镰刀菌属菌株,其中分离的F. asiaticum和F. graminearum与史文琦等[26]的分析结果类似,均具有DON的产毒性能,说明我国DON产毒菌主要包括了F. asiaticum和F. graminearum。本实验分离的F. poae具有同时产DON和ZON的性能,而张枫等[27]分离的F. poae为产T-2毒素的产毒菌,由于本实验没有进行T-2毒素的检测,因此本实验中分离的F. poae是否同时具有T-2毒素产毒性还有待进一步验证。考虑到王晋等[28]也在小麦中分离出F. poae菌株,虽然没有进行产毒菌的测定,但是可以推测F. poae菌株也是我国粮食中常污染的镰刀菌之一。研究[29-30]表明,F. fujikuroi是产FB毒素的主要产毒菌之一,本实验调查中分离的C-130507-3-3菌株经与NCBI中相应菌株比对结果与F. fujikuroi真菌相同,同时经UPLC-MS/MS方法鉴定,该菌具有FB毒素的产毒性,由此可知,我国东北采收期粮食中污染有产FB毒素的产毒菌。
3 结 论
本实验利用ELISA的快速筛选和UPLC-MS/MS的精密鉴定的优势,结合PCR技术,通过基因比对发现我国东北地区粮食主产区采收期的小麦、玉米和水稻中存在一定的产DON、ZON和FB毒素的产毒性真菌污染,并成功分离鉴定了6 个产毒菌,由此可知,东北地区粮食主产区粮食具有潜在的真菌毒素污染的可能性,如果采收后的粮食在储藏、运输和加工过程中管理不善,将会危害粮食的安全性,因此,后期有必要持续跟踪开展采收后的粮食在储藏、运输和加工过程中真菌的生长情况和真菌毒素风险评估,同时也需要制定针对性的安全控制措施。
参考文献:
[1]杨恬然, 冯芬, 陈萍, 等. 常见真菌毒素与食品健康[J]. 生物学通报,2015, 50(11): 12-14.
[2]尹青岗, 王锋, 陈井旺. 粮食中真菌毒素污染现状及控制[J]. 粮食与油脂, 2009(4): 31-34. DOI:10.3969/j.issn.1008-9578.2009.04.011.
[3]胡佳薇, 田丽, 王敏娟, 等. 陕西省120 份市售玉米及其制品中真菌毒素的污染状况调查[J]. 现代预防医学, 2017, 44(9): 1593-1606.
[4]国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品中真菌毒素限量: GB 2761—2017[S]. 北京: 中国标准出版社, 2017.
[5]卫生部. 食品微生物学检验总则: GB 4789.1—2010[S]. 北京: 中国标准出版社, 2010.
[6]WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//INNIS M A, GELFAND D H, SNINSKY J J. PCR protocols. A guide to methods and applications. San Diego (USA): Academic Press, 1990:315-322.
[7]PEI S C, ZHEN Y P, GAO J W, et al. Screening and monitoring zearalenone-producing Fusarium species by PCR and zearalenonebymonoclonal antibodies in feed from China[J]. Food Additives and Contaminants: Part B: Surveillance, 2014, 7(4): 282-287. DOI:10.1080/19393210.2014.925981.
[8]张宇昊, 杨琳, 马良. 真菌毒素同时检测方法研究进展[J]. 中国粮油学报, 2011, 26(6): 123-127. DOI:10.13386/j.issn1002-0306.2016.17.070.
[9]孙娟, 李为喜, 张妍. 用超高效液相色谱串联质谱法同时测定谷物中12 种真菌毒素[J]. 作物学报, 2014, 40(4): 691-701. DOI:10.3724/SP.J.1006.2014.006913.
[10]梁颖, 刘邻渭, 张春晖, 等. 液质联用同时检测小麦中二种镰刀菌毒素[J].中国粮油学报, 2006, 21(6): 160-162.
[11]廉慧锋, 赵笑天, 王蓉珍, 等. 超高效液相色谱-串联质谱法同时测定玉米、花生、麦仁中的9 种真菌毒素[J]. 食品科学, 2010, 31(20): 360-366.[12]周晓, 谢体三, 刘运龙. ELISA技术在食品真菌毒素检测中的应用[J]. 粮食与食品工业, 2007, 14(5): 49-52. DOI:10.3969/j.issn.1672-5026.2007.05.016.
[13]何庆华, 许杨, 刘仁荣, 等. 脱氧雪腐镰刀菌烯醇ELISA定量检测试剂盒的研制[J]. 食品与发酵工业, 2008, 34(12): 160-162.
[14]王玉平. 玉米赤霉烯酮ELISA定量检测试剂盒研制高效液相色谱法的建立及标准比对研究[D]. 石家庄: 河北科技大学, 2005: 10-11.DOI:10.7666/d.y709464.
[15]邓舜洲, 游淑珠, 许杨. 脱氧雪腐镰刀菌烯醇酶联免疫检测方法的建立[J]. 食品科技, 2006, 32(8): 222-224. DOI:10.3969/j.issn.1005-9989.2006.08.065.
[16]路戈, 刘春霞, 计融. 玉米赤霉烯酮单克隆抗体酶联免疫测定方法的建立及初步应用[J]. 真菌学报, 1996(4): 292-296.
[17]甄玉萍, 裴世春, 王岩, 等. 玉米样品前处理方法和掩蔽剂对ELISA检测玉米赤霉烯酮的影响[J]. 食品科学, 2015, 36(16): 255-260.DOI:10.7506/spkx1002-6630-201516049.
[18]李妍, 裴世春, 王岩, 等. ELISA和UPLC-MS/MS联合检测粮食中玉米赤霉烯酮残留[J]. 食品科学, 2016, 37(16): 229-234. DOI:10.7506/spkx1002-6630-201616037.
[19]佘容, 杨发树, 杜雪莉, 等. 6 种酶联免疫试剂盒在饲料呕吐毒素检测中的准确性评价[J]. 中国畜牧杂志, 2015, 51(6): 73-77.DOI:10.3969/j.issn.0258-7033.2015.06.015.
[20]刘师文, 何庆华, 邹龙, 等. 谷物中伏马菌素B1酶联免疫分析法的建立[J]. 食品科学, 2010, 31(8): 350-354.
[21]甄玉萍, 裴世春, 高建伟, 等. 不同培养条件对禾谷镰刀菌产玉米赤霉烯酮的影响[J]. 食品科学, 2015, 36(21): 168-174. DOI:10.7506/spkx1002-6630-201521032.
[22]谢雪钦, 刘舟. 基于PCR技术的产真菌毒素镰刀菌分子诊断研究进展[J]. 食品科学, 2017, 38(11): 291-300. DOI:10.7506/spkx1002-6630-201711046.
[23]王琢, 闫培生. 真菌毒素产生菌的分子鉴定研究进展[J]. 中国农业科技导报, 2010, 12(5): 42-50. DOI:10.3969/j.issn.1008-0864.2010.05.08.
[24]郭鹏豪, 刘秀丽, 崔颖鹏, 等. 真菌通用引物 Its1和Its4在丝状真菌鉴定中的价值评价[J]. 中国微生态学杂志, 2013, 25(8): 922-924.
[25]柳凤, 詹儒林, 韦继光, 等. 现代生物技术在镰刀菌分类学中的应用[J]. 中国农学通报, 2012, 28(30): 166-170. DOI:10.3969/j.issn.1000-6850.2012.30.031.
[26]史文琦, 杨立军, 冯洁, 等. 小麦赤霉病流行区镰刀菌致病种及毒素化学型分析[J]. 植物病理学报, 2011, 41(5): 486-494. DOI:10.13926/j.cnki.apps.2011.05.006486-494.
[27]张枫, 张蕾, 张重阳, 等. 一株产T-2毒素镰孢菌的分离、鉴定及其产毒条件的研究[J]. 微生物学通报, 2015, 42(2): 340-348.DOI:10.13344/j.microbiol.china.140500.
[28]王晋, 赵淑娟, 王之梅, 等. 一株梨孢镰刀菌的分离与鉴定及其生长特性研究[J]. 食品工业科技, 2009, 30(8): 173-179. DOI:10.13386/j.issn1002-0306.2009.09.032.
[29]BOLTON S L, BRANNENAND P M, GLENN A E. A novel population of Fusarium fujikuroi isolated from southeastern U.S.winegrapes reveals the needto re-evaluate the species fumonisin production[J]. Toxins, 2016, 8(9): 2-14.
[30]ISMAIL N A, MOHD M H, NOR N M I M, et al. Fumonisin B1-producing Fusarium species from agricultural crops in Malaysia[J].Crop Protection, 2017, 98: 70-75.
