裸燕麦米和燕麦粉加工所得麸皮中β-葡聚糖和酚酸的分布
2018-05-23陈中伟赵芳芳
陈中伟,汪 玲,牛 瑞,赵芳芳,孙 俊,徐 斌
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.江苏大学 农产品加工工程研究院,江苏 镇江 212013)
裸燕麦(Avena nuda)是一种发源于我国的重要功能性谷物,主要种植在华北、西北、东北、西南等地区的高寒、丘陵地带[1]。与国外的皮燕麦相似,裸燕麦富含β-葡聚糖、不饱和脂肪酸、酚酸、燕麦碱等功能性组分[2-3]。研究证明,燕麦β-葡聚糖可覆盖在小肠黏膜上,减缓糖类、脂肪和胆固醇的吸收[4]。同时,β-葡聚糖可与胆汁酸结合,促使其随粪便排出体外,促进体内胆固醇的分解,降低血清胆固醇[5-6]。因此,燕麦是美国食品药品监督管理局和世界卫生组织公认的具有降胆固醇、平稳血糖功效的功能食品[7]。
目前,燕麦已被开发出多种食品。除燕麦片、燕麦面包等西式食品外[8],还包括莜面、燕麦挂面、燕麦米、燕麦全粉等传统主食产品或原料。其中,燕麦米和燕麦全粉在国内市场上供不应求[9]。燕麦米的加工起源于20世纪80年代,可分为“非破皮”和“破皮”两类[10]。原有燕麦米加工工艺无法破除果皮和种皮等疏水性结构,吸水性差,无法实现“同煮同熟”。因此,食用不便,推广受限[11]。近几年,已有生产单位在原有燕麦米工艺基础上,加入研磨工序,去除燕麦籽粒疏水结构,极大改善了燕麦米煮制特性[12]。虽然新工艺加工的燕麦米可与大米“同煮同熟”,但研磨制米易损伤糊粉层,导致β-葡聚糖的大量流失;同时,易导致脂肪和脂肪酶接触而导致哈败,降低燕麦米的贮藏稳定性。因此,新工艺加工燕麦米的过程中是否保留了β-葡聚糖、酚酸等成分,成为优化加工工艺的关键。燕麦全粉是加工燕麦面条、燕麦面包和饼干等食品的原料,其品质直接决定着燕麦食品的营养品质。然而,由于富含葡聚糖的燕麦麸皮难以破碎,影响燕麦产品的适口性,多被舍弃,极大降低了燕麦全粉的营养性。如何在尽量保证燕麦全粉中营养性的前提下,去除木质化表皮,是燕麦全粉加工的关键。
总之,优化燕麦米和燕麦全粉的加工适宜度,需明确燕麦籽粒外缘结构(果皮、种皮、糊粉层)中β-葡聚糖、酚酸等营养组分的分布特征,并探明其在加工过程中的去向。为此,本实验拟通过测定β-葡聚糖和主要酚酸在燕麦籽粒结构层中的分布,并分析燕麦碾磨制米和燕麦全粉的加工副产物中β-葡聚糖和酚酸的含量,确定其在加工过程中的主要流向,为燕麦主食产品和原料的适度加工评价提供理论支撑。
1 材料与方法
1.1 材料与试剂
燕麦籽粒(坝莜1号、3号、5号和6号) 山西太原六味斋实业有限公司;β-葡聚糖测定试剂盒 爱尔兰Megazyme公司;酸性品红、纯化琼脂粉、25%戊二醛溶液、无水乙醇、磷酸二氢钠、氢氧化钠、乙酸钠、冰醋酸、没食子酸、福林-酚试剂、浓盐酸、乙酸乙酯、氢氧化钠、三氟乙酸、甲醇(色谱纯)、乙腈(色谱纯)国药集团化学试剂有限公司;荧光增白剂(Fluent brighter 28)、3,4,5-三甲氧基肉桂酸、香豆酸、阿魏酸美国Sigma公司。
1.2 仪器与设备
1260高效液相色谱仪、Eclipse Plus Phenyl-Hexyl柱(250 mm×4.6 mm,5 μm) 美国安捷伦科技有限公司;DMI4000B倒置荧光显微镜 德国徕卡公司;Cary100紫外-可见分光系统 美国瓦里安公司;氮吹仪安普科技有限公司;气浴恒温振荡器、HH-S数显恒温水浴锅 上海精宏实验设备有限公司;RE-2000旋转蒸发器 上海亚荣生化仪器厂;pH计 赛多利斯仪器有限公司;KQ-300DE数控超声波清洗器 昆山市超声仪器有限公司;HB43-S卤素水分测定仪 梅特勒-托利多仪器(上海)有限公司;电热恒温鼓风干燥箱 上海一恒科技有限公司;6NS-33型金业牌碾米机 山西北晟机械制造有限公司;6F22型磨粉机 郑州双帆粮食机械有限公司。
1.3 方法
1.3.1 原料预处理
取约5 g的燕麦籽粒,将其在4 ℃去离子水中浸泡24 h,去除胚芽,利用镊子辅助剥离燕麦果皮,然后在继续浸泡至燕麦变软。用小刀沿纵向腹沟将燕麦切开,将内部胚乳轻轻刮下,分别得到包含燕麦中间层-糊粉层的种皮。将得到的种皮放在去离子水中使胚乳浸湿,进一步刮去种皮上的胚乳。对干燥后的果皮、糊粉层+种皮和胚乳分别于40 ℃烘干并称质量,计算燕麦果皮、糊粉层+种皮与胚乳的比例。最后,利用研钵将制得的样品研磨成粉,过60 目筛,保藏在干燥器中备用。
燕麦米和燕麦全粉委托山西太原六味斋实业有限公司加工获得。燕麦米的加工工艺流程:燕麦粒→清理打毛→着水→烘烤灭酶→烘干→脱皮→定量包装,脱辊转速250 r/min,进料速率10 kg/min;碾米两次,收集所得麸皮为第1~2道麸皮。燕麦全粉的加工工艺流程:燕麦原粮清理→淘洗→炒制→碾磨制粉→机械筛分→燕麦粉和麸皮。制粉共5 辊,在不同辊末端筛分收集所得麸皮为第1~5道麸皮。
1.3.2 燕麦麸皮的微观结构分析
表面微观结构分析:取适量燕麦结构层置于载玻片上,加入2~3 滴去离子水,使样品分散均匀,盖上盖玻片,置于显微镜下观测,选取具有代表性的图片。
截面结构切片的制备:取15 mL去离子水于25 mL烧杯中,加入1 g琼脂后置于沸水浴中溶解。添加0.5 g燕麦结构层粉末,搅拌均匀,利用超声脱气(脱气期间温度不低于45 ℃)。脱气后迅速将烧杯置于-18 ℃,待琼脂凝固后切成1 cm见方小块。将琼脂块置于1%戊二醛溶液中12 h,然后利用冷冻切片机切出厚度为8 μm薄片,置于载玻片上,晾干后,分别用1%酸性品红-乙醇溶液和0.01%荧光增白剂-水溶液染色2 min,洗净染色液(浸泡在去离子水中约2 min,重复3 次),晾干封片,然后进行荧光观测。利用荧光显微镜(400~410 nm)进行观测,选取具有代表性的样品图片。
1.3.3 样品中水分、蛋白质、粗脂肪、淀粉和β-葡聚糖的测定
分别参照GB/T 5009.3—2010《食品中水分的测定》方法、GB/T 5009.5—2010《食品中蛋白质的测定》方法、GB/T 5009.6—2003《食品中粗脂肪的测定》方法和AACC Method 76.13[13]食品中淀粉的测定方法进行测定。β-葡聚糖含量参照试剂盒中附带的操作方法进行测定。
1.3.4 燕麦籽粒结构中酚酸含量的测定
酚酸的提取方法[14]:称量20 mg样品置于瓶中,加入10 mL的2.0 mol/L的NaOH溶液,充入氮气后,添加50 μL质量浓度为1.02 mg/mL的3,4,5-三甲氧基肉桂酸(50%甲醇溶液溶解)作为内标物,放入恒温摇床中,在35 ℃、120 r/min的条件下黑暗中水解2 h;水解后利用6 mol/L的盐酸调整溶液pH值为2,利用40 mL的乙酸乙酯在分液漏斗中萃取2 次,注意多次混匀使萃取充分。将萃取的乙酸乙酯提取液合并,在旋转蒸发仪中浓缩至1~2 mL,利用氮气吹干,加入0.8 mL的50%甲醇溶液溶解,并使用0.45 μm有机相过滤,密封冷藏。
酚酸的高效液相色谱测定方法:色谱柱:Eclipse Plus Phenyl-Hexyl柱(250 mm×4.6 mm,5 μm);检测器:紫外检测器;波长:325 nm;进样量:20 μL;流动相:A:1 mmol/L三氟乙酸溶液;B:乙腈-1 mmol/L三氟乙酸溶液(90∶10,V/V);流速:1 mL/min;柱温:45 ℃;流动相梯度:0~15 min:85% A;15~20 min:82% A;20~25 min:80% A;25~55 min:72% A;55~58 min:55% A;58~60 min:85% A[15]。
以阿魏酸、香豆酸作为标准品绘制标准曲线(R2均为0.999),利用标准曲线对色谱峰进行定量分析。
1.4 数据统计
采用SPSS 22软件对实验数据进行显著性和方差分析,结果为3 次测定数据,以 ±s表示。
2 结果与分析
2.1 燕麦麸皮结构层的微观特征和比例分析
2.1.1 燕麦麸皮结构层的微观结构特征
在单子叶谷物中,麸皮一般由果皮、种皮和糊粉层组成[16]。燕麦麸皮结构层的微观特征是定性判定燕麦加工程度的基础。图1a显示,燕麦果皮由狭长纤维状细胞构成,色泽淡黄,在显微镜下透光率高;而种皮+糊粉层由多边形细胞构成,易分辨(图1b),色泽棕黄(源于种皮)。图1c、1d为破碎后的燕麦果皮、种皮+糊粉层结构层,在燕麦麸皮结构层细胞不被完全破碎的条件下,果皮和糊粉层也极易分辨。因此,利用光学显微镜可定性判定燕麦全粉或燕麦米加工所脱除组分的微观结构,从而判定其营养组分损失。

图1 燕麦麸皮结构层的表面微观结构Fig. 1 Microstructure of oat bran layers
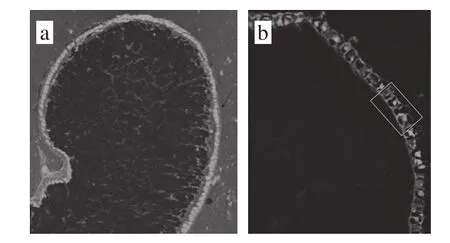
图2 燕麦籽粒及麸皮的显微结构(截面)Fig. 2 Microstructure of the cross section of oat kernel and bran on
从图2a可以看出,燕麦籽粒最外层为极薄果皮,其次为亮绿色的糊粉层(被荧光增白剂染色后),内层的胚乳(淀粉和蛋白)为蓝黑色,这与Chen Zhongwei等[17]对小麦籽粒的染色结果相似,由于所使用的显微镜为伪彩,所显示的颜色不同(糊粉层的实际颜色为亮蓝色);糊粉层截面微观结构在图2b中更加明显(已剥离果皮)。因此,从截面结构可以明确判定燕麦麸皮和胚乳的存在状态,从而定性判定燕麦麸皮的研磨程度和营养组分损失情况。
2.1.2 燕麦麸皮的含量

表1 燕麦籽粒中麸皮与胚乳的质量分数Table 1 Proportion of oat bran and endosperm
燕麦米的加工程度也可通过分析所脱除的燕麦麸皮的比例来判定,这需分析燕麦麸皮及胚乳含量。如表1所示,胚乳与麸皮的质量比约为3∶1,麸皮所占比例介于22.3%~24.4%,质量分数平均值为23.4%;胚乳所占比例为75.3%~77.4%,质量分数平均值为76.3%(在手工剥离过程中会损失少量的胚乳)。从表1可看出,4 个燕麦品种中麸皮与胚乳质量分数接近,但具体品种间存在一定差异。
另外,与小麦不同,燕麦中糊粉层与胚乳的界限不十分明显,因此一般的燕麦麸皮黏附着大量的次糊粉层[18]。因而,常规燕麦制粉所得燕麦麸皮质量分数远大于23%[19-20]。表1中所列燕麦麸皮的质量分数一般作为判定麸皮完全剥离的临界值,供判定燕麦米及燕麦制粉的加工程度。
2.2 燕麦籽粒结构及全粉中基本组分、β-葡聚糖和主要酚酸含量
2.2.1 4 个燕麦品种的基本成分分析
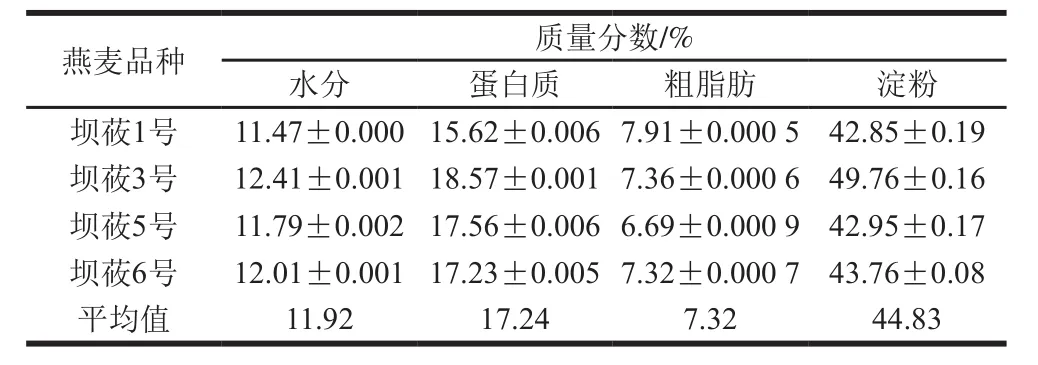
表2 4 个燕麦品种全粉的基本成分含量对比Table 2 Proximate composition of oat powder from four varieties
如表2所示,4 个燕麦品种的全粉水分质量分数介于11.47%~12.41%之间,平均值为11.92%。其中,坝莜3号的水分质量分数最高,为12.41%;坝莜1号水分质量分数最低,为11.47%。总体来讲,4 个燕麦品种水分含量差别不明显,但均在安全水分的下限;燕麦全粉的蛋白质质量分数介于15.62%~18.57%之间,平均值为17.24%。其中,坝莜3号蛋白质质量分数最高,为18.57%;坝莜1号蛋白质质量分数最低,为15.62%;粗脂肪质量分数为6.69%~7.91%,平均值为7.32%。坝莜1号粗脂肪含量最高,坝莜5号最低,质量分数为6.69%;而4 种燕麦品种的淀粉质量分数为42.85%~49.76%,其中坝莜1号含量最低,坝莜3号含量最高,淀粉质量分数平均值为44.83%。
2.2.2 燕麦籽粒结构及全粉中β-葡聚糖含量
采用基于AACC方法改良的试剂盒法对燕麦麸皮、胚乳及全粉中β-葡聚糖的含量进行分析,结果见表3。4 个品种燕麦的全粉中β-葡聚糖质量分数介于2.97%~4.02%,平均值为3.58%。郭丽娜[21]曾测定了31 种国内燕麦中β-葡聚糖的含量,其平均质量分数为4.56%,变幅为2.79%~5.63%,本实验测定结果在其范围内。
然而,燕麦麸皮β-葡聚糖含量明显高于胚乳。如表3所示,4 个品种燕麦麸皮中β-葡聚糖的质量分数介于6.43%~10.32%之间,平均质量分数为85.7%;而燕麦胚乳中β-葡聚糖平均质量分数只有1.89%,总体介于1.77%~2.18%之间。由此可见,对于裸燕麦而言,β-葡聚糖主要富集在麸皮中,其质量分数约为胚乳中质量分数的4.5 倍,为全粉的2.1 倍。申瑞玲[22]曾分析过内蒙古、山西和河北等地的燕麦麸皮中的葡聚糖含量。其结果也显示,燕麦麸皮中可溶性β-葡聚糖质量分数在6.7%~9.2%之间,而燕麦胚乳中β-葡聚糖质量分数为1.5%。也有研究表明,燕麦次糊粉层富含β-葡聚糖[23],但与本实验的目的不冲突。
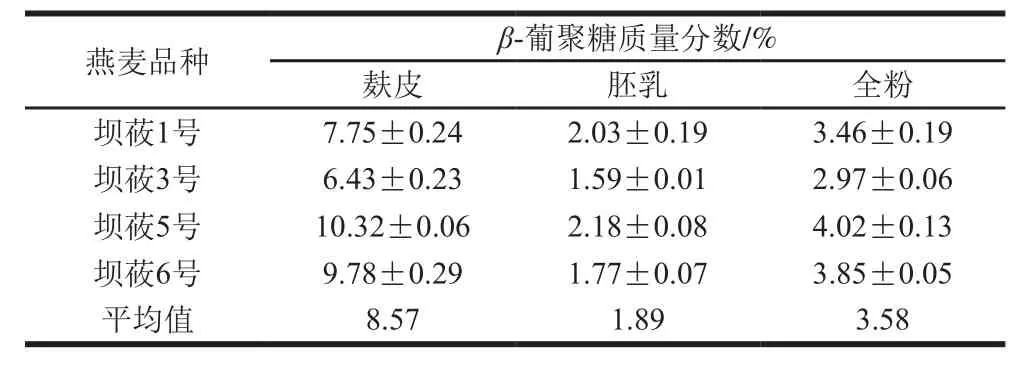
表3 燕麦麸皮、胚乳及全粉中β-葡聚糖质量分数(干基)Table 3 Contents of β-glucan in oat bran, endosperm and whole oat flour (on a dry basis)
结合表1中麸皮、胚乳的比例可知,燕麦麸皮中β-葡聚糖总量约占燕麦全粉的40%,是燕麦全粉功能组分的重要来源。因此,应在燕麦加工中尽可能保留麸皮,尤其是糊粉层[24]。同时,本实验数据也为燕麦加工适宜度判定提供了参考。
2.2.3 不同燕麦籽粒结构中的酚酸含量分析
采用高效液相色谱法测定燕麦籽粒结构中酚酸组成和含量。结果表明,燕麦麸皮与胚乳中酚酸以阿魏酸和香豆酸为主(出峰时间分别为11.82 min和14.77 min)。其中,阿魏酸含量最大,这与小麦等其他谷物中酚酸的组成相似[25]。主要酚酸的具体含量见表4。

表4 不同燕麦品种籽粒结构层中主要酚酸单体的含量Table 4 Contents of main phenolic acid monomers in oat seed tissues mg/g
从表4可知,4 种燕麦麸皮中阿魏酸含量介于0.73~1.24 mg/g之间,平均含量为1.00 mg/g。其中,坝莜3号的麸皮中含量明显高于其他3 个品种。麸皮中p-香豆酸含量介于0.08~0.14 mg/g之间,其中,坝莜1号麸皮中酚酸含量最高。另外,通过分析燕麦麸皮的果皮、种皮+糊粉层中所含酚酸可知,燕麦果皮中阿魏酸和p-香豆酸分别为3.27 mg/g和1.31 mg/g(表5),明显高于其在种皮+糊粉层中的含量,这与小麦等谷物中酚酸的分布相似[25]。

表5 坝莜3号果皮酚酸含量Table 5 Contents of phenolic acids in the pericarp of Bayou 3 cultivar mg/g
在胚乳中,4 种燕麦中胚乳阿魏酸和p-香豆酸平均含量分别为0.021 mg/g和0.004 mg/g,远低于燕麦麸皮中的含量。麸皮中阿魏酸和p-香豆酸的含量分别约为胚乳中含量的48 倍和24 倍,这与郝杰等[26]的研究结果相似。
综上,燕麦所含酚酸以阿魏酸为主,主要富集在麸皮中,此结果与燕麦籽粒荧光显色的结果一致。
2.3 燕麦米及燕麦全粉加工所得麸皮中β-葡聚糖、酚酸及总酚含量分析
2.3.1 燕麦米及燕麦全粉加工所得麸皮中β-葡聚糖含量分析
以坝莜3号加工燕麦米所得的1道和2道麸皮,以及加工燕麦全粉所得1~5道麸皮,分析其所含β-葡聚糖和酚酸的含量。

表6 燕麦制米及磨粉过程中所得麸皮的β-葡聚糖质量分数对比Table 6 Contents of β-glucan in oat brans obtained from the processing of oat rice and flour
如表6所示,燕麦米加工所得第1、2道麸皮中β-葡聚糖质量分数分别为1.75%和1.71%,对比表3结果可知,所采用的脱皮制米工艺可能只脱除了部分果皮,未破坏糊粉层细胞,β-葡聚糖损失不多。王超[27]的研究也证明,最新的燕麦米脱皮工艺主要目的在于减少糊粉层的损失。
在燕麦粉加工所得麸皮中,β-葡聚糖的含量随着研磨的程度逐渐升高,第4、5道麸皮中β-葡聚糖质量分数分别达6.73%和7.80%,与手工剥离燕麦麸皮中β-葡聚糖的含量相近。该结果表明,此时燕麦糊粉层细胞已破损,β-葡聚糖损失严重。杨金枝等[28]对比机械破碎和常规磨粉工艺的区别也发现,常规磨粉所得燕麦粉中葡聚糖的损失较大。因此,在燕麦粉加工过程汇总,应将第4道及第5道燕麦麸皮回填至燕麦粉中,以减少其功能组分的损失。
2.3.2 燕麦米及燕麦全粉加工所得麸皮中酚酸的含量分析

表7 燕麦制米及磨粉所得麸皮中主要酚酸含量对比Table 7 Contents of main phenolic acids in oat bran obtained from the processes of oat rice and flour mg/g
由表7可知,制米过程中所得的第1道麸皮和2道麸皮中香豆酸含量差异较明显;第1道麸皮中香豆酸的含量为0.264 mg/g,而第2道麸皮中仅为0.050 mg/g;第1道麸皮中阿魏酸含量为1.193 mg/g,第2道麸皮含量为0.347 mg/g。以上结果表明,在制米过程中香豆酸、阿魏酸等主要酚酸的损失也较多。由于果皮中p-香豆酸和阿魏酸的含量最高(表5),因此可推断,研磨法加工燕麦米可能主要去除了大量果皮。
在燕麦制粉过程中,随着燕麦粉加工精度增加,香豆酸和阿魏酸的含量从0.068 mg/g和0.227 mg/g分别逐渐增加至0.103 mg/g和0.475 mg/g;该结果表明,在燕麦粉制粉过程中香豆酸和阿魏酸等酚酸的损失量较大,这与郑俊等[29]的研究结果相似。应该适当减少燕麦麸皮的去除程度,保留第3~5道的燕麦麸皮,从而获得富含酚酸的燕麦粉[30]。
3 结 论
在裸燕麦籽粒中,β-葡聚糖主要富集在麸皮中,麸皮中β-葡聚糖平均质量分数为8.57%,约为胚乳中含量的4.5 倍。4 种裸燕麦全粉中β-葡聚糖平均质量分数为4.00%,种间无显著差异;燕麦籽粒所含主要酚酸为阿魏酸和p-香豆酸,尤其是阿魏酸,且主要富集在麸皮中。而在麸皮中,果皮中p-香豆酸和阿魏酸的含量远高于种皮+糊粉层中;在燕麦米脱皮加工中,研磨所去除的麸皮中β-葡聚糖质量分数为1.71%,远小于糊粉层中含量,阿魏酸与香豆酸的损失均较多,结合两者的结果,表明燕麦米去除大部分的果皮,保留了大部分β-葡聚糖,加工工艺适当;而在燕麦制粉过程中,从第3道麸皮开始,所去除的麸皮中β-葡聚糖质量分数高达5.6%,阿魏酸等酚酸的损失也较大,这表明燕麦制粉过程中损失了较多β-葡聚糖。因此,为保留燕麦中的葡聚糖,应该在第3道后的燕麦粉进行研磨制粉并回填,以保留更多的有益功能性成分。
参考文献:
[1]崔林, 李成雄. 我国裸燕麦品种资源的品质研究[J]. 作物品种资源,1989(3): 32-33.
[2]胡新中. 燕麦的加工与功能[M]. 北京: 科学出版社, 2012.
[3]李笑蕊, 王世霞, 幺杨, 等. 裸燕麦和皮燕麦的营养及功能活性成分对比分析[J]. 粮油食品科技, 2015, 23(5): 50-54. DOI:10.3969/j.issn.1007-7561.2015.05.012.
[4]KERCKHOFFS D A, HORNSTRA G, MENSINK R P.Cholesterol-lowering effect of beta-glucan from oat bran in mildly hypercholesterolemic subjects may decrease when beta-glucan is incorporated into bread and cookies[J]. American Journal of Clinical Nutrition, 2003, 78(2): 221-227.
[5]WOOD P J. Cereal β-glucans in diet and health[J]. Journal of Cereal Science, 2007, 46(3): 230-238. DOI:10.1016/j.jcs.2007.06.012.
[6]蔡凤丽. 燕麦产品的降血糖功效和机理研究[D]. 郑州: 郑州轻工业学院, 2011: 48-66.
[7]MARTÍNEZ-VILLALUENGA C, PEÑAS E. Health benefits of oat:current evidence and molecular mechanisms[J]. Current Opinion in Food Science, 2017, 14(5): 26-31.
[8]RASANE P, JHA A, SABIKHI L, et al. Nutritional advantages of oats and opportunities for its processing as value added foods: a review[J].Journal of Food Science and Technology, 2015, 52(2): 662-675.DOI:10.1007/s13197-013-1072-1.
[9]殷正明. 继稻米、小麦之后 燕麦可成为“第三主粮”[J]. 北京农业,2012(8): 4-5.
[10]朱蠡. 燕麦米的加工方法[J]. 粮油食品科技, 1985(3): 14-15.DOI:10.13684/j.cnki.spkj.1985.03.004.
[11]杨才, 张新军, 周海涛, 等. 国产裸燕麦米生产现状及存在的问题与对策[J]. 粮食加工, 2009, 34(5): 66-67. DOI:10.3969/j.issn.1007-6395.2009.05.021.
[12]姚岭柏. 裸燕麦方便米的加工工艺及燕麦米饭抗老化的研究[D].呼和浩特: 内蒙古农业大学, 2008.
[13]LORRAINE A, QUINTON J, KENNEDY F. American association of cereal chemists approved methods[J]. Carbohydrate Polymers, 2002,49(4): 515. DOI:10.1016/S0144-8617(01)00358-7.
[14]陈中伟. 麦麸糊粉层细胞簇的机械剥离及电场富集研究[D]. 无锡:江南大学, 2015.
[15]DOBBERSTEIN D, BUNZEL M. Separation and detection of cell wall-bound ferulic acid dehydrodimers and dehydrotrimers in cereals and other plant materials by reversed phase high-performance liquid chromatography with ultraviolet detection[J]. Journal of Agricultural and Food Chemistry, 2010, 58(16): 8927-8935. DOI:10.1021/jf101514j.
[16]陈中伟, 廉文蕾, 吴保承, 等. 小麦麸皮结构层中抗氧化物质的研究[J]. 食品工业科技, 2012, 33(23): 66-68; 72. DOI:10.13386/j.issn1002-0306.2012.23.039.
[17]CHEN Z, ZHA B, WANG L, et al. Dissociation of aleurone cell cluster from wheat bran by centrifugal impact milling[J]. Food Research International, 2013, 54(1): 63-71. DOI:10.1016/j.foodres.2013.05.032.
[18]MILLER S S, FULCHER R G. Oats: chemistry and technology,chapter 5: microstructure and chemistry of the oat kernel[M]. AACC International Inc, 2011: 77-94.
[19]GIRARDET N, WEBSTER F H. Oats: chemistry and technology,chapter 14: oat milling: specifications, storage, and processing[M].AACC International Inc, 2011: 301-319.
[20]任嘉嘉. 燕麦制粉及挤压膨化技术研究[D]. 北京: 中国农业科学院,2008: 13-19.
[21]郭丽娜. 燕麦品种品质及其降血脂功效研究[D]. 北京: 中国农业科学院, 2014: 42-50.
[22]申瑞玲. 燕麦β-葡聚糖的提取纯化及功能特性研究[D]. 无锡: 江南大学, 2005: 17-29.
[23]SIKORA P, TOSH S M, BRUMMER Y, et al. Identification of high β-glucan oat lines and localization and chemical characterization of their seed kernel β-glucans[J]. Food Chemistry, 2013, 137(1/2/3/4):83-91. DOI:10.1016/j.foodchem.2012.10.007.
[24]WOOD P J. Oats: chemistry and technology, chapter 11: oat β-glucan:properties and function[M]. AACC International Inc, 2011: 219-254.
[25]BARRON C, SURGET A, ROUAU X. Relative amounts of tissues in mature wheat (Triticum aestivum L.) grain and their carbohydrate and phenolic acid composition[J]. Journal of Cereal Science, 2007, 45(1):88-96. DOI:10.1016/j.jcs.2006.07.004.
[26]郝杰, 张长虹, 曹学丽. 七种谷物麸皮中的酚酸类成分分析[J]. 食品科学, 2010, 31(10): 262-267. DOI:1002-6630(2010)10-0263-05.
[27]王超. 燕麦脱皮工艺与设备实验研究[D]. 北京: 中国农业机械化科学研究院, 2015.
[28]杨金枝, 薛庆林. 机械粉碎燕麦全粉品质研究[J]. 粮油食品科技,2010, 18(4): 11-13. DOI:10.16210/j.cnki.1007-7561.2010.04.003.
[29]郑俊. 燕麦、青稞营养组分、蛋白和多酚理化性质分析及加工方式对燕麦粉品质影响研究[D]. 南昌: 南昌大学, 2017.
[30]任嘉嘉. 燕麦制粉及挤压膨化技术研究[D]. 北京: 中国农业科学院,2008.
