结核分枝杆菌RD区蛋白研究进展
2018-05-18,,2
,,2
研究表明,分枝杆菌起源于1.5亿年以前[1]。结核病(Tuberculosis,TB)是由结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex,MTBC)感染引起的一种慢性人兽共患传染病,MTBC主要包括结核分枝杆菌(Mycobacteriumtuberculosis)、非洲分枝杆菌(Mycobacterium.africanum) 、卡氏分枝杆菌(Mycobacterium.canetti) 、牛分枝杆菌(Mycobacterium.bovis)、田鼠型结核杆菌(Mycobacterium.microti)和卡介苗(Bacillus Calmette-Guérin , BCG)[2]。早在1882年,德国细菌学家柯赫(Robert Koch)就已证明结核分枝杆菌(Mycobacteriumtuberculosis,MTB)是结核病的病原菌[1]。Cole等[3]于1998年完成了对结核分枝杆菌 H37Rv全基因组测序,H37Rv基因组包含4 411 529个碱基对,约含4 000个基因,并且具有非常高的鸟嘌呤和胞嘧啶含量,与其他细菌的基因组相比,结核分枝杆菌基因组上存在很大一部分基因编码参与脂肪生成和脂肪分解的酶、以及两个富含甘氨酸的蛋白质家族,具有免疫学意义,可能是潜在的多态性抗原。随着比较基因组学技术的发展,通过全基因组比对研究发现,结核分枝杆菌复合群中不同种细菌(如结核分枝杆菌、牛分枝杆菌或卡介苗)的基因组中存在一些缺失片段,这些缺失片段被称为差异区域(Region of Differences,RD),通称为RD区。研究显示,RD区基因与结核分枝杆菌的毒力密切相关,且这些基因的功能在结核病新型疫苗研发及新型诊断方法建立中具有重要的潜在意义及应用价值[4]。本文主要综述结核分枝杆菌基因组RD区及其编码蛋白的研究进展。
1 RD区概述
通过人造细菌染色体(Bacterial Artificial Chromosome,BAC)数据库和比较基因组学等方法,发现结核分枝杆菌复合群基因组中共有16 个RD区,即RD1-RD16,含有129个开放阅读框,如表1所示。在不同的BCG 亚株和非结核分枝杆菌中缺失的片段又有所不同[5-6]。
表1 结核分枝杆菌差异区分布[7]
Tab.1 Distribution of regions of differences (RD) in M.tuberculosis
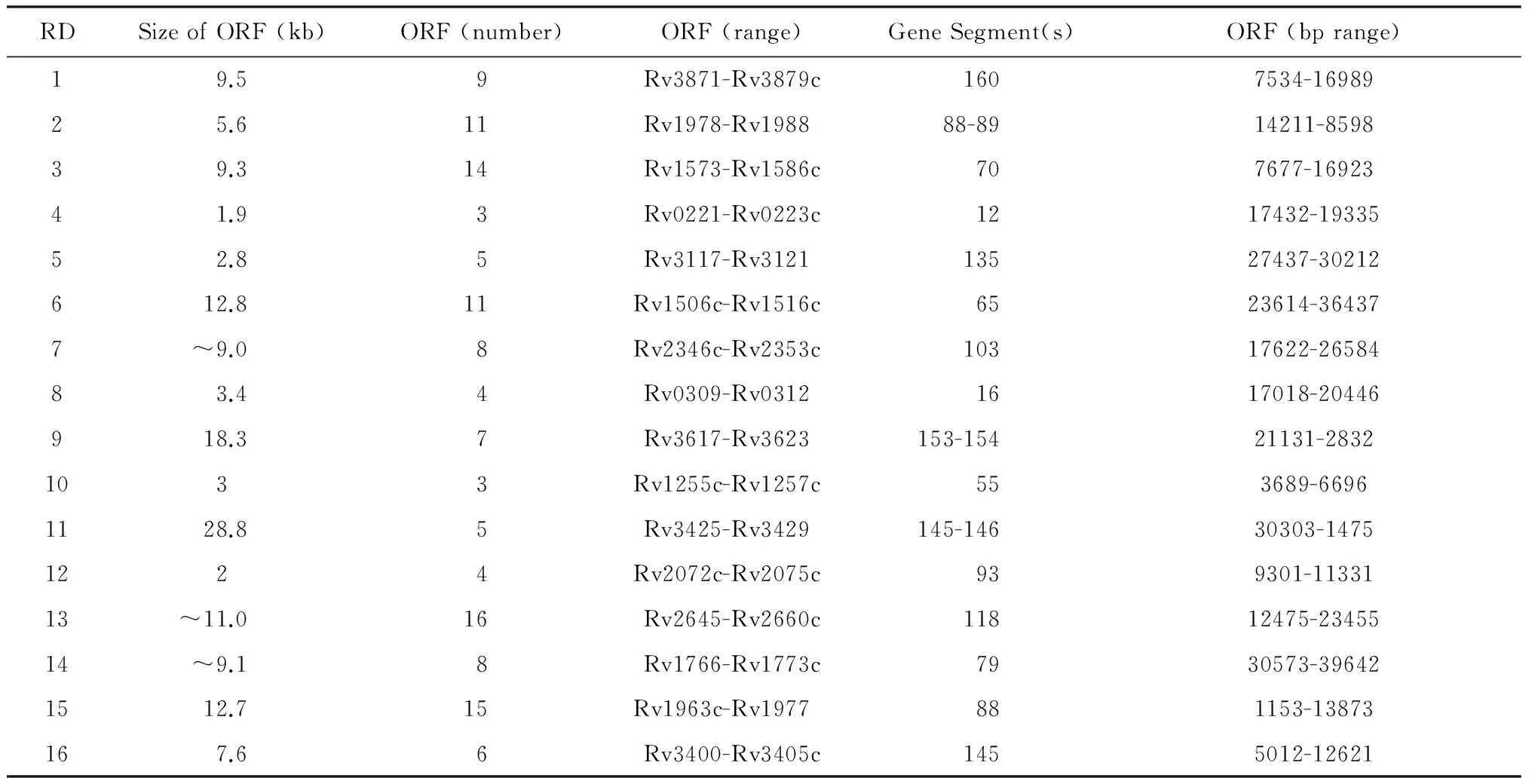
RDSizeofORF(kb)ORF(number)ORF(range)GeneSegment(s)ORF(bprange)19.59Rv3871-Rv3879c1607534-1698925.611Rv1978-Rv198888-8914211-859839.314Rv1573-Rv1586c707677-1692341.93Rv0221-Rv0223c1217432-1933552.85Rv3117-Rv312113527437-30212612.811Rv1506c-Rv1516c6523614-364377~9.08Rv2346c-Rv2353c10317622-2658483.44Rv0309-Rv03121617018-20446918.37Rv3617-Rv3623153-15421131-28321033Rv1255c-Rv1257c553689-66961128.85Rv3425-Rv3429145-14630303-14751224Rv2072c-Rv2075c939301-1133113~11.016Rv2645-Rv2660c11812475-2345514~9.18Rv1766-Rv1773c7930573-396421512.715Rv1963c-Rv1977881153-13873167.66Rv3400-Rv3405c1455012-12621
注:本文中的RD区命名依据实验室目前正在进行的RD区基因多态性分析的参考文献进行统一的校正,包括参考文献的替换。
通过检索 http://tuberculist.epfl.ch RD区基因功能如表2所示,所编码的蛋白主要功能包括:相关蛋白生命活动过程所需的酶、潜在的诊断抗原和疫苗候选成分等。研究显示RD区可能参与MTB的潜伏感染,并维持MTB的免疫自稳[8]。BCG是目前唯一批准使用的结核疫苗,但由于保护效力存在较大争议,尤其是对成人结核病的预防保护效果不明显,故新型结合疫苗的研发已经迫在眉睫。以往的研究已经证明,RD区的某些基因以重组BCG或DNA疫苗的形式在一定程度上可加强现行BCG的保护效率[9-10]。
表2 结核分枝杆菌差异区基因功能
Tab.2 M.tuberculosis RD region gene function
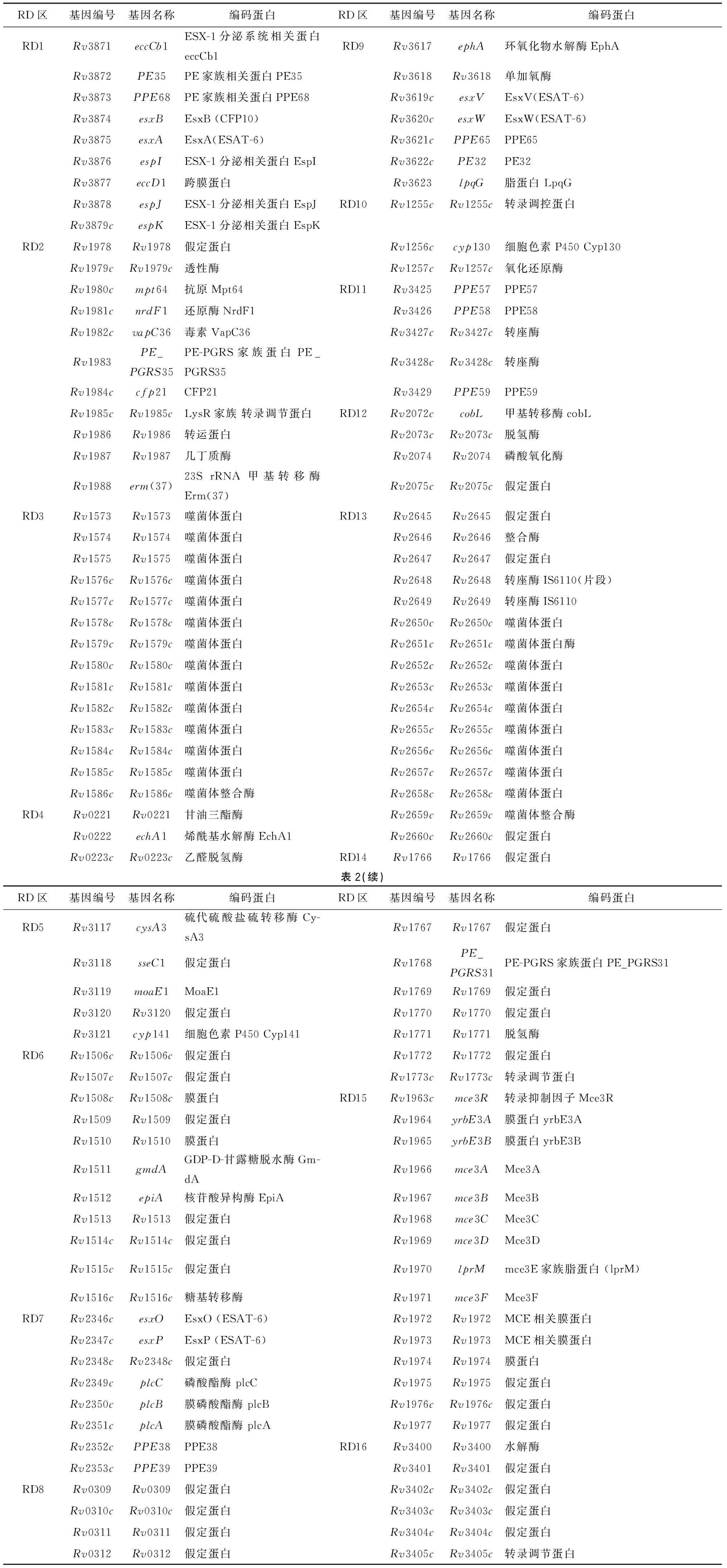
RD区基因编号基因名称编码蛋白RD区基因编号基因名称编码蛋白RD1Rv3871eccCb1ESX-1分泌系统相关蛋白eccCb1RD9Rv3617ephA环氧化物水解酶EphARv3872PE35PE家族相关蛋白PE35Rv3618Rv3618单加氧酶Rv3873PPE68PE家族相关蛋白PPE68Rv3619cesxVEsxV(ESAT-6)Rv3874esxBEsxB(CFP10)Rv3620cesxWEsxW(ESAT-6)Rv3875esxAEsxA(ESAT-6)Rv3621cPPE65PPE65Rv3876espIESX-1分泌相关蛋白EspIRv3622cPE32PE32Rv3877eccD1跨膜蛋白Rv3623lpqG脂蛋白LpqGRv3878espJESX-1分泌相关蛋白EspJRD10Rv1255cRv1255c转录调控蛋白Rv3879cespKESX-1分泌相关蛋白EspKRD2Rv1978Rv1978假定蛋白Rv1256ccyp130细胞色素P450Cyp130Rv1979cRv1979c透性酶Rv1257cRv1257c氧化还原酶Rv1980cmpt64抗原Mpt64RD11Rv3425PPE57PPE57Rv1981cnrdF1还原酶NrdF1Rv3426PPE58PPE58Rv1982cvapC36毒素VapC36Rv3427cRv3427c转座酶Rv1983PE_PGRS35PE-PGRS家族蛋白PE_PGRS35Rv3428cRv3428c转座酶Rv1984ccfp21CFP21Rv3429PPE59PPE59Rv1985cRv1985cLysR家族转录调节蛋白RD12Rv2072ccobL甲基转移酶cobLRv1986Rv1986转运蛋白Rv2073cRv2073c脱氢酶Rv1987Rv1987几丁质酶Rv2074Rv2074磷酸氧化酶Rv1988erm(37)23SrRNA甲基转移酶Erm(37)Rv2075cRv2075c假定蛋白RD3Rv1573Rv1573噬菌体蛋白RD13Rv2645Rv2645假定蛋白Rv1574Rv1574噬菌体蛋白Rv2646Rv2646整合酶Rv1575Rv1575噬菌体蛋白Rv2647Rv2647假定蛋白Rv1576cRv1576c噬菌体蛋白Rv2648Rv2648转座酶IS6110(片段)Rv1577cRv1577c噬菌体蛋白Rv2649Rv2649转座酶IS6110Rv1578cRv1578c噬菌体蛋白Rv2650cRv2650c噬菌体蛋白Rv1579cRv1579c噬菌体蛋白Rv2651cRv2651c噬菌体蛋白酶Rv1580cRv1580c噬菌体蛋白Rv2652cRv2652c噬菌体蛋白Rv1581cRv1581c噬菌体蛋白Rv2653cRv2653c噬菌体蛋白Rv1582cRv1582c噬菌体蛋白Rv2654cRv2654c噬菌体蛋白Rv1583cRv1583c噬菌体蛋白Rv2655cRv2655c噬菌体蛋白Rv1584cRv1584c噬菌体蛋白Rv2656cRv2656c噬菌体蛋白Rv1585cRv1585c噬菌体蛋白Rv2657cRv2657c噬菌体蛋白Rv1586cRv1586c噬菌体整合酶Rv2658cRv2658c噬菌体蛋白RD4Rv0221Rv0221甘油三酯酶Rv2659cRv2659c噬菌体整合酶Rv0222echA1烯酰基水解酶EchA1Rv2660cRv2660c假定蛋白Rv0223cRv0223c乙醛脱氢酶RD14Rv1766Rv1766假定蛋白表2(续)RD区基因编号基因名称编码蛋白RD区基因编号基因名称编码蛋白RD5Rv3117cysA3硫代硫酸盐硫转移酶Cy-sA3Rv1767Rv1767假定蛋白Rv3118sseC1假定蛋白Rv1768PE_PGRS31PE-PGRS家族蛋白PE_PGRS31Rv3119moaE1MoaE1Rv1769Rv1769假定蛋白Rv3120Rv3120假定蛋白Rv1770Rv1770假定蛋白Rv3121cyp141细胞色素P450Cyp141Rv1771Rv1771脱氢酶RD6Rv1506cRv1506c假定蛋白Rv1772Rv1772假定蛋白Rv1507cRv1507c假定蛋白Rv1773cRv1773c转录调节蛋白Rv1508cRv1508c膜蛋白RD15Rv1963cmce3R转录抑制因子Mce3RRv1509Rv1509假定蛋白Rv1964yrbE3A膜蛋白yrbE3ARv1510Rv1510膜蛋白Rv1965yrbE3B膜蛋白yrbE3BRv1511gmdAGDP-D-甘露糖脱水酶Gm-dARv1966mce3AMce3ARv1512epiA核苷酸异构酶EpiARv1967mce3BMce3BRv1513Rv1513假定蛋白Rv1968mce3CMce3CRv1514cRv1514c假定蛋白Rv1969mce3DMce3DRv1515cRv1515c假定蛋白Rv1970lprMmce3E家族脂蛋白(lprM)Rv1516cRv1516c糖基转移酶Rv1971mce3FMce3FRD7Rv2346cesxOEsxO(ESAT-6)Rv1972Rv1972MCE相关膜蛋白Rv2347cesxPEsxP(ESAT-6)Rv1973Rv1973MCE相关膜蛋白Rv2348cRv2348c假定蛋白Rv1974Rv1974膜蛋白Rv2349cplcC磷酸酯酶plcCRv1975Rv1975假定蛋白Rv2350cplcB膜磷酸酯酶plcBRv1976cRv1976c假定蛋白Rv2351cplcA膜磷酸酯酶plcARv1977Rv1977假定蛋白Rv2352cPPE38PPE38RD16Rv3400Rv3400水解酶Rv2353cPPE39PPE39Rv3401Rv3401假定蛋白RD8Rv0309Rv0309假定蛋白Rv3402cRv3402c假定蛋白Rv0310cRv0310c假定蛋白Rv3403cRv3403c假定蛋白Rv0311Rv0311假定蛋白Rv3404cRv3404c假定蛋白Rv0312Rv0312假定蛋白Rv3405cRv3405c转录调节蛋白
2 RD区研究进展
2.1RD1区 RD1区全长9.5 kb,包含9个阅读框,即Rv3871~Rv3879c,在结核分枝杆菌H37Rv和牛分枝杆菌基因组中存在,在全部BCG菌株中缺失。RD1区所编码的蛋白是结核分枝杆菌的主要毒力因子之一,被认为在结核分枝杆菌的致病过程中起着关键的作用[11]。Rv3871编码的eccCb1蛋白是ESX-1分泌系统的重要组成部分,可与Rv3870编码的蛋白结合共同形成分子转运通道;又能与ESAT-6/CFP-10二聚体结合参与其分泌转位;也有研究揭示,Rv3871编码的蛋白可能在ESAT-6/CFP-10蛋白的折叠、分泌过程中起到关键性作用。卡介苗基因组中的这段序列的缺失可能与其保护力减弱有直接关系[12]。Rv3872编码的PE35蛋白和Rv3873编码的PPE68蛋白可能在结核病的发病过程中起重要作用、有助于结核分枝杆菌感染状态的建立和维持,此外PE35和PPE68蛋白在结核病的感染发病过程中起着重要的免疫调节作用[13]。Rv3874和Rv3875分别编码CFP-10和ESAT-6两个低分子质量的蛋白[14]。这两个基因的表达受同一个启动子调控,其产物CFP-10和ESAT-6形成的紧密的1∶1的蛋白质复合物发挥生物学功能;CFP-10的C-末端形成的氨基酸臂,对蛋白质的分泌起重要作用;分泌型结核分枝杆菌复合蛋白CFP-10和ESAT-6可能在病原体-宿主细胞信号传导中发挥关键作用,在结核病发病机制中起重要作用[11]。Ming Zhang[15]等使用遗传学方法证实Rv3876编码的EspI蛋白是结核分枝杆菌ESX-1分泌系统的组成部分之一,在细胞ATP水平消耗的条件下,EspI在负向调节ESX-1介导的分泌过程中起着重要作用。Rv3877编码的跨膜蛋白eccD1是组成蛋白质分泌通道的主要成分[16]。Rv3878编码ESX-1分泌相关蛋白EspJ,且EspJ与苏氨酸蛋白激酶(Serine Threonine Protein Kinase,STPK)介导的磷酸化联合作用是促进分枝杆菌生长的主要机制之一[17]。Rv3879编码的分泌蛋白EspK能够和Rv3871编码的蛋白eccCb1相互作用,促进蛋白Rv3881c/Mh3881c(EspB)的分泌[18]。
2.2RD2区 RD2区全长5.6 kb,包含11个阅读框,即Rv1978~Rv1988c,在牛分枝杆菌基因组和部分BCG菌株中存在,在BCG-Danish、BCG-Prague、BCG-Glaxo、BCG-Connaught、BCG-Phipps、BCG-Tice和BCG-Pasteur菌株中缺失。RD2区在结核分枝杆菌毒力方面起到重要作用,某些基因编码的蛋白与BCG的安全性和宿主的免疫应答有关,如Rv1979c可能是一种氨基酸转运蛋白,并且该基因的缺失可能抑制巨噬细胞的生长。Rv1980c编码的MPT64和Rv1984c编码的CFP21,可诱导机体产生强烈的免疫应答[19]。RD2区在结核分枝杆菌中的缺失导致巨噬细胞和小鼠中的细菌生长减少,并且巨噬细胞的感染,导致TNF-α水平增加和细胞凋亡,提示RD2区中编码的MPT64蛋白在宿主细胞内具有抗细胞凋亡作用[20]。Rv1982c可以编码毒素-抗毒素家族蛋白(Toxin-Antitoxin,TA)VapC36,VapC36可以通过RNA酶活性抑制翻译[21]。有研究选取Rv1981c编码的NrdF1、Rv1983编码的PE__PGRS35,Rv1985c和Rv1986等4种蛋白进行原核融合表达与纯化,分别以 NrdF1、PE_PGRS35、Rv1985c和Rv1986等4种融合蛋白纯化产物作为抗原,用间接酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)对血清中的特异抗体进行检测 ,结果显示4种蛋白的阳性检出率分别为7.35%、22.06%、16.18%和16.18%,具有用作牛结核病血清学诊断试剂的潜能[22]。Rv1987蛋白是RD2区基因编码的一种具有免疫效力的分泌蛋白,有研究表明, Rv1987蛋白可以调节宿主免疫反应向Th2型细胞应答转化,这可能有助于细菌逃逸宿主免疫识别[23]。Rv1988编码的蛋白作为重要的分枝杆菌毒力因子,可以作为治疗分枝杆菌感染的潜在靶标[24]。Rv1978编码的蛋白为假定蛋白。(如表2所示)。
2.3RD3区 RD3区全长9.3 kb,包含14个阅读框,即Rv1573~Rv1586c,在牛分枝杆菌基因组中存在,在全部BCG菌株中缺失。研究表明,噬菌体衣壳蛋白Rv1576c、Rv1578c和噬菌体整合酶Rv1586c可能与结核分枝杆菌适应环境及发病机制有关[25]。Rv1580c可能是鉴定血清样品中牛分枝杆菌感染的理想选择[26]。Rv1573-Rv1585c编码的蛋白为噬菌体蛋白。(如表2所示)。
2.4RD4区 RD4区,全长1.9 kb,包含3个阅读框,即Rv0221、Rv0222和Rv0223c,在结核分枝杆菌H37Rv和非洲分枝杆菌基因组中存在,在BCG和牛分枝杆菌基因组中缺失。Rosenkrands[27]等对结核分枝杆菌差异区RD2-7、RD9-13 和RD15的47个基因进行基因克隆表达,并纯化重组蛋白,采用血清学检测,发现Rv0222编码的蛋白EchA1具有很高的血清学诊断价值,并且在人类免疫缺陷(Human Immunodeficiency Virus,HIV)感染患者中呈现较高的灵敏度,其识别HIV阳性结核患者的灵敏度为43%,识别HIV阴性肺结核患者的灵敏度为30%。张慧涨[28]等在Rv0222/ESAT-6融合蛋白的结核病血清学诊断价值的研究中发现,以Rv0222/ESAT-6融合蛋白为抗原的ELISA方法诊断结核病的敏感性为86%,特异性为100%,证明了Rv0222/ESAT-6融合蛋白作为抗原的ELISA方法对结核病(包括合并HIV感染者)的血清学诊断具有较高的应用价值。王庆等在结核分枝杆菌重组蛋白Rv0222的表达及血清学鉴定实验中也证明了Rv0222的诊断潜能[29]。Rv0221和Rv0223c编码的蛋白分别为甘油三脂酶和乙醛脱氢酶(如表2所示)。
2.5RD5区 RD5区全长2.8 kb,包含5个阅读框,即Rv3117、Rv3118、Rv3119、Rv3120和Rv3121,在结核分枝杆菌H37Rv和非洲分枝杆菌基因组中存在,在BCG和牛分枝杆菌基因组中缺失。RD5区的完整性可能与生物毒力作用增加有关[30]。通过对60名HIV感染合并结核病患者、32名健康对照者的血清,用酶联免疫法进行检测发现,Rv3117和Rv3120之间显示其敏感性差异具有统计学意义;和采用ESAT-6作为抗原(敏感性21.7%,特异性90.6%)相比,Rv3117(敏感性25%,特异性96.9%)和Rv3120(敏感性31.7%,特异性96.9%)的敏感性和特异性均有所提高;这表明Rv3117和Rv3120在结核病血清学诊断方面具有较高的敏感性,可用于诊断结核分枝杆菌感染[31]。Rv3121编码细胞色素蛋白Cyp141,可能参与调节宿主的免疫反应,可以作为新型疫苗的候选成分、在结核病的诊断方面具有潜在的价值[32]。Rv3118编码的蛋白为假定蛋白,Rv3119编码的蛋白为MoaE1(如表2所示)。
2.6RD6区 RD6区全长12.8 kb,包含11个阅读框,即Rvl506c-Rvl516c,其中包含编码3个糖代谢途径中的相关蛋白,如GDP-D-甘露糖脱水酶GmdA (Rv1511)、核苷酸异构酶EpiA(Rv1512)和糖基转移酶Rv1516c(Rv1516c);以及2个膜蛋白,如Rv1508c和Rv1510。在结核分枝杆菌H37Rv和非洲分枝杆菌基因组中存在,在牛分枝杆菌和BCG基因组中缺失。通过对重组蛋白Rv1515c在分枝杆菌和宿主相互作用中的功能研究发现,Rv1515c能够通过影响脂肪酸的合成而引起一系列菌落表型变化,包括滑动能力、单菌落形态和生物膜的形成,从而增强耻垢分枝杆菌在体外的存活能力,并能使鼠源巨噬细胞RAW264.7和人源巨噬细胞THP-1中细胞因子IL-6和IL-10 mRNA表达水平显著下调,这表明Rv1515c蛋白是与结核分枝杆菌致病性相关的一种调控蛋白,可作为一种新型的抗结核药物靶点[33]。也有研究发现,Rv1516c蛋白在结核分枝杆菌的全细胞裂解物中表达,鉴定的血清反应性肽可能在结核病的特异性血清诊断中有重要作用[34]。Rv1506c、Rv1507c、Rv1509、Rv1513和Rv1514c编码的蛋白为假定蛋白(如表2所示)。
2.7RD7区 RD7区全长9.0 kb,包含8个阅读框,即Rv2346c-Rv2353c,在结核分枝杆菌H37Rv和非洲分枝杆菌基因组中存在,在牛分枝杆菌和BCG基因组中缺失。曹严明[35]等对Rv2352c蛋白进行基因克隆表达、纯化后,免疫新西兰兔,发现能够刺激产生高滴度的抗体反应;之后对Rv2352c重组蛋白进行免疫印迹分析,结果显示该重组蛋白能与结核病人的血清发生良好免疫反应;证明Rv2352c蛋白具有很好的免疫原性和抗原性。张红梅[36]检测了3个PPE重组蛋白Rv3425、Rv3429和Rv2353c和两个对照抗原CFP-10和ESAT-6,在识别结核病人和健康对照者血清中IgG抗体的反应,发现以Rv2353c为抗原,检测出肺结核病人血清中特异IgG敏感性可达16.0%,而检测肺外结核病人血清中特异IgG敏感性为12.5%;与接种过BCG疫苗的健康对照者相比较,Rv2353c抗原在检测结核病人中的特异性为96.4%,虽然特异性比较高,可是在检测结核病人的敏感性方面较低,用于诊断的实际价值不大。Rv2346c基因编码的蛋白能够诱导结核杆菌在巨噬细胞内的氧化应激来提高结核菌的生存能力[37]。Rv2347c基因编码的蛋白可能与结核分枝杆菌毒力有关[38]。Rv2348c编码的蛋白为假定蛋白,Rv2349c、2350c和Rv2351c编码的蛋白分别为磷酸酯酶C(PlcC)、膜磷酸酯酶B(PlcB)和膜磷酸酯酶A(PlcA)(如表2所示)。
2.8RD8区 RD8区全长3.4 kb,包含4个阅读框,即Rv0309-Rv0312,在非洲分枝杆菌和BCG基因组中存在,在牛分枝杆菌基因组中缺失。蒋天舒等[39]构建了高效表达的Rv0309重组质粒,获得高纯度的Rv0309重组蛋白,研究表明Rv0309具有诱导宿主产生保护性免疫应答作用,为进一步利用该抗原制备结核新疫苗进行结核病的防治研究提供了一定的基础。Rv0310c、Rv0311和Rv0312编码的蛋白为假定蛋白(如表2所示)。
2.9RD9区 RD9区全长18.3 kb,包含7个阅读框,即Rv3617-Rv3623,在结核分枝杆菌H37Rv基因组中存在,在非洲分枝杆菌、牛分枝杆菌和BCG基因组中缺失。有研究用重组Rv3618蛋白作为抗原,采用ELISA检测7l例肺结核患者血清中特异性Rv3618蛋白和38 kD蛋白的IgG抗体,发现Rv3618与38 kD蛋白联合可用于肺结核病患者的血清学检测,且呈现较高的敏感性, Rv3618蛋白可作为结核病血清学诊断的抗原之一[40]。也有研究揭示IS6110和Rv3618基因可以作为检测结核分枝杆菌的分子靶标;使用PCR-ICT(免疫色谱测试)测定法,同时检测1 500个临床痰标本中的MTBC和MTB。将结果与传统培养和生化鉴定结果进行比较,并与患者的临床结果进行比较,整体敏感性为93.0%,特异性为99.8%,其中检测MTBC的灵敏度为95.5%、特异性为97.9%,检测MTB的灵敏度为93.0%、特异性为99.8%,证明Rv3618在结核病的诊断上具有较好的潜在应用价值[41]。Rv3620c也是结核分枝杆菌的重要免疫显性抗原。以Ag85B-ESAT6-Rv3620c融合基因重组卡介苗构建了一种新型重组卡介苗(recombinant BCG,rBCG),动物实验结果显示与BCG相比,这种rBCG可以显著增加Th1型细胞免疫应答和特异性体液应答,这将对新型卡介苗的研发有重要指导性意义[42]。曹廷明[43]等成功构建原核表达重组质粒pET30a(+)-Rv3623,证实Rv3623蛋白具有较好的免疫原性并制备了其多克隆抗体,为进一步研究其作为诊断结核病的潜在分子标志物的可行性奠定了基础。Rv3617编码的蛋白为环氧化物水解酶EphA,Rv3619c编码的蛋白为EsxV(ESAT-6),Rv3621c的预测功能为PPE65,Rv3622c编码蛋白PE32(如表2所示)。
2.10RD10区 RD10区全长3.0 kb,包含3个阅读框,即Rv1255c-Rv1257c,在结核分枝杆菌H37Rv和非洲分枝杆菌基因组中存在,在牛分枝杆菌和BCG基因组中缺失。RD10区促进对结核分枝杆菌的保护作用,而与毒力作用无关,因此,可用于新疫苗研发[44]。Rv1255c的编码蛋白为转录调控因子,Rv1256c编码的蛋白为细胞色素 P450 Cyp130,Rv1257编码的蛋白为氧化还原酶(如表2所示)。
2.11RD11区 RD11区全长28.8 kb,包含5个阅读框,即Rv3425-Rv3429,在结核分枝杆菌H37Rv基因组中存在,在BCG基因组中缺失。吴兴福[45]等用H37Rv免疫的兔血清进行间接酶联免疫吸附试验测定融合蛋白CFPl0-ESAT6-Rv3425的免疫原性,结果显示该蛋白具有较强的免疫原性,可作为结核病免疫诊断的一个候选抗原。研究表明Rv3425蛋白在结核病诊断方面具有很高的应用价值[46]。Rv3426的预测功能为编码蛋白PPE58,Rv3427c和Rv3428c编码的蛋白为转座酶,Rv3429编码蛋白PPE59(如表2所示)。
2.12RD12区 全长2.0 kb,包含4个阅读框,即Rv2072c、Rv2073c、Rv2074和Rv2075c,在结核分枝杆菌H37Rv基因组中存在,在BCG基因组中缺失。叶娟[47]成功诱导表达纯化了RD12区抗原Rv2074,血清学检测结果显示蛋白Rv2074具有较高的敏感性和特异性,但未进行细胞免疫学活性的验证。Tan[48]在研究Rv2073c和Rv2074两种蛋白时发现,与健康对照组相比,蛋白Rv2073c只在结核组诱导分泌高水平的IFN-γ,且呈正相关关系,这表明Rv2073c可能是结核分枝杆菌特异性诊断试剂和疫苗的备选成分之一。Rv2072c和Rv2075c编码的蛋白分别为甲基转移酶cobL和假定蛋白(如表2所示)。
2.13RD13区 RD13区全长11.0 kb,包含16个阅读框,即Rv2645-Rv2660c,在结核分枝杆菌H37Rv和牛分枝杆菌基因组中存在,在BCG基因组中缺失。研究发现,结核病人外周血中Rv2645特异性刺激产生IFN-γ水平比健康人更高;Rv2645能够诱导接种热灭活的结核杆菌H37Rv的小鼠发生结核分枝杆菌特异性皮肤试验反应,有可能作为一种新型细胞介导的结核免疫诊断剂[49]。有研究对 ESAT-6、CFP10、Rv2031c、Rv2654c和Rv1038c免疫原机制进行对比时发现,CFP10占最主导地位,Rv2654c几乎不表达[50]。杨丹等发现,Rv2657c蛋白既有B细胞表位也有T细胞表位,可能成为结核病诊断抗原分子和候选疫苗抗原[51]。有研究表明,纯化的重组Rv2659c蛋白,在潜伏性结核感染患者中可引起T细胞应答的选择性免疫原性;因此,它具有潜在的诊断价值,可能是对潜伏性结核感染使用的疫苗候选之一[52]。Rv2646编码的蛋白为整合酶,Rv2648编码的蛋白为转座酶IS6110(片段),Rv2649编码的蛋白为转座酶IS6110,Rv2650c、Rv2652c、Rv2653c、Rv2655c、Rv2656c和Rv2658c编码的蛋白为噬菌体蛋白,Rv2651c编码的蛋白为噬菌体蛋白酶,Rv2647和Rv2660c编码的蛋白都为假定蛋白(如表2所示)。
2.14RD14区 RD14区全长9.1 kb,包含8个阅读框,即Rv1766-Rv1773c,在大部分BCG基因组中存在 ,在牛分枝杆菌基因组和BCG-Pasteur菌株中缺失。研究表明Rv1769和Rv1772都可作为T细胞抗原,诱发较强的T细胞免疫反应,可以作为潜在的细胞免疫检测抗原或亚单位疫苗成分[53]。Rv1771编码一种脱氢酶,具有合成维生素C的能力[54]。Rv1766、Rv1767和Rv1770编码的蛋白为假定蛋白,Rv1768编码的蛋白为PE-PGRS家族蛋白PE_PGRS31,Rv1773c编码的蛋白为转录调控蛋白(如表2所示)。
2.15RD15区 RD15区全长12.7 kb,包含15个阅读框,即Rv1963c-Rv1977,在结核分枝杆菌H37Rv基因组中存在,在牛分枝杆菌和BCG基因组中缺失。Rv1966-Rv1971分别编码蛋白质Mce3A、Mce3B、Mce3C、Mce3D、Mce3E和Mce3F,研究表明Mce3A-F蛋白在结核分枝杆菌体外生长过程中及其mRNA中表达,可能与结核分枝杆菌的发病机制有关[55]。Rv1973编码的蛋白是结核分枝杆菌的外膜蛋白[56]。Jiang Y等发现Rv1977编码的蛋白可能是一种特异性抗原,它可能参与宿主免疫逃避[57]。Rv1963c编码的蛋白为转录抑制因子Mce3R,Rv1964、Rv1965、Rv1972和Rv1974编码的蛋白为膜蛋白,Rv1975和Rv1976c编码的蛋白为假定蛋白(如表2所示)。
2.16RD16区 RDl6区全长7.6 kb,包含6个阅读框,即Rv3400、Rv3401、Rv3402c、Rv3403c、Rv3404c和Rv3405c,在大部分BCG基因组中存在,在牛分枝杆菌基因组、BCG-Moreau菌株和BCG-Russia菌株的基因组中缺失。Rv3400编码一种水解酶,参与分枝菌酸合成[58]。朱琳等发现抗原Rv3400能够诱导高水平IL-6和TNF-a的分泌,增加巨噬细胞表面分子CD80、CD86、CD40、MHCⅡ的表达,提高巨噬细胞吞噬能力;亚单位疫苗Rv3400-IFA在C57BL/6小鼠体内可产生较好的细胞免疫和体液免疫效应,Rv3400有望成为新型结核病疫苗及诊断标志物的候选成分[59]。研究表明,NF-κB、ERKl/2和p38信号通路的激活是Rv3402c蛋白诱导产生TNF-α所必需的,而且NF-κB、ERKl/2信号通路是Rv3402c诱导的IL分泌所需的,Rv3402c也可以通过干扰宿主的信号途径来扰乱宿主的免疫应答,最终导致巨噬细胞的快速裂解以及细菌在胞内的存活率提高[60-61]。Rv3401、Rv3403c和Rv3404c编码的蛋白为假定蛋白,Rv3405c编码的蛋白为转录调控蛋白(如表2所示)。
3 展 望
结核分枝杆菌基因组变异具有多样性,而宿主对结核分枝杆菌的免疫,首先是细胞免疫,其次是体液免疫,用单一抗原或单一方法只能检出一部分的感染者,效果不令人满意,而且,由于BCG的接种和非结核分枝杆菌感染的交叉免疫反应,导致免疫学检测诊断的特异性不理想,使得结核病免疫学诊断的临床应用价值大大减低。目前,BCG的预防效果差,特别是对成人结核病。因此,高度特异和灵敏的免疫学诊断技术和更有效的结核病新疫苗的研发成为亟待解决的科学难题,这主要依赖于特异抗原及其相关技术的突破。结核分枝杆菌16个RD区对于研究结核分枝杆菌的进化历程、毒力机制以及免疫学诊断具有重要的研究价值。结核分枝杆菌基因组RD区抗原,由于绝大多数在BCG和非结核分枝杆菌基因组中缺失,以其为基础的血清学诊断和疫苗研制具有独特的优越性;然而,可能是不同的个体对不同抗原的免疫应答不同,同一个体不同的感染(疾病)阶段对同一抗原的免疫应答不同、以及种族不同、结核病的发病环境和抗原来源不同、临界值算法不同等等[62],结核病免疫诊断的敏感性和特异性有很大的可变性,尤其是单一抗原效果极不理想。因此,RD区蛋白抗原联合应用能够显著提高检测的敏感性和特异性,对结核病的诊断和预防具有十分重要的应用价值。
参考文献:
[1] Barberis I, Bragazzi NL, Galluzzo L,et al. The history of tuberculosis: from the first historical records to the isolation of Koch's bacillus[J]. J Prev Med Hyg, 2017, 58(1): E9-E12.
[2] Pounder JI, Anderson CM, Voelkerding KV,et al.Mycobacteriumtuberculosiscomplex differentiation by genomic deletion patterns with multiplex polymerase chain reaction and melting analysis[J]. Diagn Microbiol Infect Dis, 2010, 67(1): 101-105. DOI: 10.1016/j.diagmicrobio.2009.12.014
[3] Cole ST, Brosch R, Parkhill J,et al. Deciphering the biology ofMycobacteriumtuberculosisfrom thecomplete genome sequence[J]. Nature, 1998, 393(6685): 537-44. DOI:10.1038/31159
[4] 丁志鑫,车南颖,张旭霞,等. 结核分枝杆菌差异区基因功能研究及其应用进展[J]. 临床肺科杂志, 2012, 17(3): 505-508. DOI:10.3969/j.issn.1009-6663.2012.03.060
[5] Brosch R, Gordon SV, Billault A,et al. Use of aMycobacteriumtuberculosisH37Rv bacterial artificial chromosome (BAC) library for genome mapping, sequencing and comparative genomics[J]. Infect Immun, 1998, 66(5): 2221-2229.
[6] Philipp WJ, Nair S, Guglielmi G,et al. Physical mapping ofMycobacteriumbovisBCG pasteur reveals differences from the genome map ofMycobacteriumtuberculosisH37Rv and from M. bovis[J]. Microbiology, 1996, 142 ( Pt 11)(11): 3135. DOI:10.1099/13500872-142-11-3135
[7] Behr MA, Wilson MA, Gill WP,et al.Comparative genomics of BCG vaccines by whole-genome DNA microarray[J]. Science, 1999, 284(5419): 1520-3. DOI: 10.1126/science.284.5419.1520
[8] 池水晶,宝福凯,柳爱华.结核分枝杆菌比较基因组学研究进展[J].科技通报, 2013, (9): 40-45. DOI:10.13774/j.cnki.kjtb.2013.09.029
[9] Fan X, Gao Q, Fu R. DNA vaccine encoding ESAT-6 enhances the protective efficacy of BCG againstMycobacteriumtuberculosisinfection in mice[J]. Scand J Immunol, 2007, 66(5): 523-8. DOI:10.1111/j.1365-3083.2007.02006.x
[10] Kalra M,Grover A,Mehta N,et al. Supplementation with RD antigens enhances the protective efficacy of BCG in tuberculous mice[J]. Clin Immunol, 2007, 125(2): 173-83. DOI:10.1016/j.clim.2007.07.007
[11] Renshaw PS, Panagiotidou P, Whelan A,et al. Conclusive evidence that the major T-cell antigens of theMycobacteriumtuberculosiscomplex ESAT-6 and CFP-10 form a tight, 1:1 complex and characterization of the structural properties of ESAT-6, CFP-10, and the ESAT-6*CFP-10 complex. Implications for pathogenesis and virulence[J]. J Biol Chem, 2002, 277(24): 21598-603. DOI:10.1074/jbc.M201625200
[12] 鲍一歌,秦紫芳,鲍朗.结核杆菌基因组RD1区毒力蛋白分泌相关基因Rv3871的克隆、表达及生物信息学分析[J]. 南方医科大学学报, 2009, 29(12): 2371-2374. DOI:10.3321/j.issn:1673-4254.2009.12.004
[13] Tiwari B,Soory A,Raghunand TR. An immunomodulatory role for theMycobacteriumtuberculosisregion of difference 1 locus proteins PE35 (Rv3872) and PPE68 (Rv3873)[J]. FEBS J, 2014, 281(6): 1556-70. DOI:10.1111/febs.12723
[14] Berthet FX, Rasmussen PB, Rosenkrands I,et al. AMycobacteriumtuberculosisoperon encoding ESAT-6 and a novel low-molecular-mass culture filtrate protein (CFP-10)[J]. Microbiology, 1998,144 (Pt 11): 3195-3203. DOI:10.1099/00221287-144-11-3195
[15] Zhang M, Chen JM, Sala C,et al. EspI regulates the ESX-1 secretion system in response to ATP levels inMycobacteriumtuberculosis[J]. Mol Microbiol, 2014, 93(5): 1057-65. DOI: 10.1111/mmi.12718
[16] Champion PA, Stanley SA, Champion MM,et al. C-terminal signal sequence promotes virulence factor secretion inMycobacteriumtuberculosis[J]. Science, 2006, 313(5793): 1632-6. DOI:10.1126/science.1131167
[17] Singh PK, Saxena R, Tiwari S,et al. RD-1 encoded EspJ protein gets phosphorylated prior to affect the growth and intracellular survival of mycobacteria[J]. Sci Rep, 2015, 5: 12717. DOI: 10.1038/srep12717
[18] 李浩,徐俊杰,陈薇. 结核分枝杆菌RD-1区编码蛋白的结构和功能[J]. 生物化学与生物物理进展, 2009, 36(10): 1260-1266. DOI: 10.3724/SP.J.1206.2009.00187
[19] Raghavan S,Manzanillo P,Chan K,et al. Secreted transcription factor controlsMycobacteriumtuberculosisvirulence[J]. Nature, 2008, 454(7205): 717-21. DOI: 10.1038/nature07219
[20] Kozak RA, Alexander DC, Liao R,et al. Region of difference 2 contributes to virulence of Mycobacterium tuberculosis[J]. Infect Immun, 2011, 79(1): 59-66. DOI: 10.1128/IAI.00824-10
[21] Ramage HR, Connolly IE, Cox JS. Comprehensive functional analysis ofMycobacteriumtuberculosistoxin-antitoxin systems: implications for pathogenesis, stress responses, and evolution[J]. PLoS Genet, 2009, 5(12): e1000767. DOI: 10.1371/journal.pgen.1000767
[22] 孙林,刘艳,闵晨雨,等. 结核分枝杆菌NrdF1、PE_PGRS35、Rv1985c和Rv1986的原核表达及检测牛结核病抗体之应用[J].中国人兽共患病学报, 2014, 30(8): 782-786. DOI: 10.3969/j.issn.1002-2694.2014.08.002
[23] Sha S, Shi X,Deng G,et al.MycobacteriumtuberculosisRv1987 induces Th2 immune responses and enhances Mycobacterium smegmatis survival in mice[J]. Microbiol Res, 2017, 197: 74-80. DOI: 10.1016/j.micres.2017.01.004
[24] Yaseen I,Kaur P, Nandicoori VK,et al. Mycobacteria modulate host epigenetic machinery by Rv1988 methylation of a non-tail arginine of histone H3[J]. Nat Commun, 2015, 6: 8922. DOI: 10.1038/ncomms9922
[25] Fan X,Abd Alla AA,Xie J. Distribution and function of prophage phiRv1 and phiRv2 amongMycobacteriumtuberculosiscomplex[J]. J Biomol Struct Dyn, 2016, 34(2): 233-238. DOI: 10.1080/07391102.2015.102260
[26] Kwok HF,Scott CJ,Snoddy P,et al. Expression and purification of diagnostically sensitive mycobacterial (Mycobacteriumbovis) antigens and profiling of their humoral immune response in a rabbit model[J]. Res Vet Sci, 2010, 89(1): 41-7. DOI: 10.1016/j.rvsc.2009.12.015
[27] Rosenkrands I,Aagaard C,Weldingh K,et al. Identification of Rv0222 from RD4 as a novel serodiagnostic target for tuberculosis[J]. Tuberculosis, 2008, 88(4): 335-343. DOI: 10.1016/j.tube.2007.12.001
[28] 张慧涨,范齐文,杨华,等. Rv0222/ESAT-6融合蛋白对结核病的诊断价值[J]. 中国临床医学, 2014, (6): 636-639.
[29] 王庆,杨华,金瑞良,等.结核分枝杆菌重组蛋白Rv0222的表达及血清学鉴定[J].中国防痨杂志, 2012, 34(1): 36-39.
[30] Rao KR,Kauser F,Srinivas S,et al. Analysis of genomic downsizing on the basis of region-of-difference polymorphism profiling ofMycobacteriumtuberculosispatient isolates reveals geographic partitioning[J]. J Clin Microbiol, 2005, 43(12): 5978-82. DOI:10.1128/JCM.43.12.5978-5982.2005
[31] Zhang MM,Zhao JW,Sun ZQ,et al. Identification of RD5-EncodedMycobacteriumtuberculosisProteins As B-Cell Antigens Used for Serodiagnosis of Tuberculosis[J]. Clin Dev Immunol, 2012, 2012(4): 738043. DOI: 10.1155/2012/738043
[32] Rabiee-Faradonbeh M, Darban Sarokhalil D,Feizabadi MM,et al. Cloning of the Recombinant Cytochrome P450 Cyp141 Protein ofMycobacteriumtuberculosisas a Diagnostic Target and Vaccine Candidate[J]. Iran Red Crescent Med J, 2014, 16(11):e18001. DOI: 10.5812/ircmj.18001
[33] 刘民强. 结核分枝杆菌差异区RD6基因Rvl515c促进胞内存活及其分子机理研究[D]. 西南大学, 2015.
[34] Alkhodari NY,Alattiyah R,Mustafa AS. Identification, diagnostic potential, and natural expression of immunodominant seroreactive peptides encoded by fiveMycobacteriumtuberculosis-specific genomic regions[J]. Clin Vaccine Immunol, 2011, 18(3): 477-482. DOI: 10.1128/CVI.00405-10
[35] 曹廷明,贾红彦,古淑香,等. 结核分枝杆菌Rv2352c基因的克隆表达及其抗原活性鉴定[J].中国防痨杂志,2010,32(10):25-30.
[36] 张红梅. 结核分支杆菌特异的PE/PPE蛋白应用于结核病血清学诊断的初步研究[D]. 复旦大学, 2006. DOI: 10.7666/d.y1022386
[37] Mohanty S,Molin MD,Ganguli G,et al.MycobacteriumtuberculosisEsxO (Rv2346c) promotes bacillary survival by inducing oxidative stress mediated genomic instability in macrophages[J]. Tuberculosis, 2016, 96: 44-57. DOI: 10.1016/j.tube.2015.11.006
[38] He XY,Zhuang YH,Zhang XG,et al. Comparative proteome analysis of culture supernatant proteins ofMycobacteriumtuberculosisH37Rv and H37Ra[J]. Microbes Infect, 2003, 5(10): 851-856. DOI:10.1016/S1286-4579(03)00179-5
[39] 蒋天舒,娄加陶,周晔,等.结核分枝杆菌Rv0309抗原的重组表达、纯化和鉴定[J]. 临床军医杂志, 2007, 35(2): 165-167. DOI:10.3969/j.issn.1671-3826.2007.02.002
[40] 何秀云,李净,郝娟,等. 结核分枝杆菌Rv3618蛋白在大肠埃希菌中的表达、纯化及其血清学诊断[J].现代检验医学杂志,2010, 25(6): 27-29. DOI:10.3969/j.issn.1671-7414.2010.06.009
[41] Soo PC,Horng YT,Hsueh PR,et al. Direct and simultaneous identification ofMycobacteriumtuberculosiscomplex(MTBC) andMycobacteriumtuberculosis(MTB) by rapid multiplex nested PCR-ICT assay[J]. J Microbiol Methods, 2006, 66(3): 440-448. DOI:10.1016/j.mimet.2006.01.010
[42] Yang E,Lu Y,Xu Y,et al. Recombinant BCG coexpressing Ag85B, ESAT-6 and Rv3620c elicits specific Th1 immune responses in C57BL/6 mice[J]. Microb Pathog, 2014, 69-70(1): 53-59. DOI: 10.1016/j.micpath.2014.03.011
[43] 曹廷明,古淑香,马玙,等. 结核分枝杆菌Rv3623基因的抗原性及其多克隆抗体的制备[C]. 中华医学会. 中华医学会结核病学分会2012学术大会. 北京:中华医学会,2012:225.
[44] Ouellet H, Johnston JB, Ortiz De Montellano PR. TheMycobacteriumtuberculosiscytochrome P450 system[J]. Arch Biochem Biophys, 2010, 493(1): 82-95. DOI: 10.1016/j.abb.2009.07.011
[45] 吴兴福,孙战强,徐明.结核分枝杆菌CFP10-ESAT6-Rv3425基因片段融合蛋白的表达与纯化[J]. 临床肺科杂志, 2011, 16(10): 1533-1535. DOI: 10.3969/j.issn.1009-6663.2011.10.025
[46] 孙卫国,李邦印,刘艳华,等. 结核分枝杆菌Rv3425蛋白的原核表达纯化及其血清学诊断价值[J]. 生物技术通讯, 2013, (5): 659-661. DOI: 10.3969/j.issn.1009-0002.2013.05.014
[47] 叶娟. 结核分枝杆菌RD12区和RD5区特异性抗原的生物信息学分析及免疫原性初步评估[D]. 河南中医学院, 2014.
[48] Tan K,Zhang J,Teng X,et al. High level of IFN-γ released from whole blood of human tuberculosis infections following stimulation with Rv2073c ofMycobacteriumtuberculosis[J]. J Microbiol Methods, 2015, 114: 57-61. DOI: 10.1016/j.mimet.2015.05.007
[49] Luo W,Qu ZL,Xie Y,et al. Identification of a novel immunodominant antigen Rv2645 from RD13 with potential as a cell-mediated immunity-based TB diagnostic agent[J]. J Infect, 2015, 71(5): 534-43. DOI: 10.1016/j.jinf.2015.07.011
[50] Arlehamn CS,Sidney J,Henderson R,et al. Dissecting mechanisms of immunodominance to the common TB antigens ESAT-6, CFP10, Rv2031c (hspX), Rv2654c (TB7.7) and Rv1038c (EsxJ)[J]. J Immunol, 2012, 188(10): 5020-5031. DOI: 10.4049/jimmunol.1103556
[51] 杨丹,白雪娟,阳幼荣,等. 结核潜伏感染蛋白Rv2657cT细胞和B细胞表位的预测与分析[J]. 实用医学杂志, 2017, 33(1): 55-58. DOI: 10.3969/j.issn.1006-5725.2017.01.015
[52] Bai XJ,Liang Y,Yang YR,et al. Immune responses to latent tuberculosis antigen Rv2659c in Chinese populations[J]. J Microbiol Immunol Infect, 2015, 48(4): 381-389. DOI: 10.1016/j.jmii.2014.02.006
[53] Lu M, Xia ZY, Bao L. Enhancement of antimycobacterial Th1-cell responses by aMycobacteriumbovisBCG prime-protein boost vaccination strategy[J]. Cell Immunol, 2013, 285(1/2): 111-117. DOI: 10.1016/j.cellimm.2013.10.001
[54] Wolucka BA, Communi D.Mycobacteriumtuberculosispossesses a functional enzyme for the synthesis of vitamin C, L-gulono-1,4-lactone dehydrogenase[J]. FEBS J, 2006, 273(19):4435-4445. DOI: 10.1111/j.1742-4658.2006.05443.x
[55] Ahmad S,El-Shazly S,Mustafa AS,et al. The six mammalian cell entry proteins (Mce3A-F) encoded by the mce3 operon are expressed during in vitro growth ofMycobacteriumtuberculosis[J]. Scand J Immunol, 2010, 62(1): 16-24. DOI:10.1111/j.1365-3083.2005.01639.x
[56] Song H,Sandie R,Wang Y,et al. Identification of outer membrane proteins ofMycobacteriumtuberculosis[J]. Tuberculosis, 2008, 88(6): 526-44. DOI:10.1016/j.tube.2008.02.004
[57] Jiang Y,Liu H,Wang X,et al. Conserved hypothetical protein Rv1977 inMycobacteriumtuberculosisstrains contains sequence polymorphisms and might be involved in ongoing immune evasion[J]. Int J Clin Exp Pathol, 2015, 8(6): 6891.
[58] Takayama K, Wang C, Besra GS. Pathway to synthesis and processing of mycolic acids inMycobacteriumtuberculosis[J]. Clin Microbiol Rev,2005,18(1):81. DOI:10.1128/CMR.18.1.81-101.2005
[59] 朱琳,徐颖,孔聪,等.结核分枝杆菌新型抗原Rv3400的免疫原性研究[J].中国防痨杂志, 2016, 38(3): 201-208. DOI:10.3969/j.issn.1000-6621.2016.03.010
[60] Li W,Zhao Q,Deng W,et al.MycobacteriumtuberculosisRv3402c enhances mycobacterial survival within macrophages and modulates the host pro-inflammatory cytokines production via NF-kappa B/ERK/p38 signaling[J]. Plos One, 2014, 9(11): e94418. DOI: 10.1371/journal.pone.0094418
[61] 李武. 结核分枝杆菌分泌性效应分子的鉴定、功能与信号传递研究[D]. 重庆:西南大学, 2015.
[62] 闫晓晓,王洪海,张舒林. RD区编码蛋白在结核病免疫诊断中的研究进展[J].现代生物医学进展, 2010, 10(20): 3935-3940.
