弓形虫ROP16Ⅱ效应分子对宿主A549细胞基因表达谱的影响
2018-05-18,,2,,,,,,2
, ,2, ,,,,,2
弓形虫是一种专性细胞内寄生原虫,全球平均感染率约为20%~30%,在我国的感染率约为5%~15%[1]。弓形虫对脑组织具有很高的亲嗜性。产前阶段的弓形虫感染是导致先天性弓形虫病的常见原因。后天获得性弓形虫病多发生于肿瘤、HIV等患者,常引起脑炎、癫痫及精神分裂症等神经系统异常,除此之外亦可引起肺炎和心肌炎等[2-4]。脑外弓形虫病中,肺弓形虫病的发生率占第2或第3位,但目前关于肺弓形虫病的报道较少[5]。
棒状体蛋白(ROPs)作为弓形虫的重要毒力因子,在弓形虫入侵、增殖及毒力等方面起着关键作用。目前已经发现的ROPs有30多种,大多具有激酶、磷酸酶以及蛋白酶活性,主要定位于纳虫泡膜,纳虫泡及宿主细胞内[6]。而ROP16非常罕见的特异性定位于人体细胞核内[7-8]。ROP16是宿主细胞转录的调节因子,其蛋白质结构中存在丝氨酸苏氨酸激酶区域,可参与宿主细胞内信号转录活化因子(STAT)相关的磷酸化,从而干扰宿主细胞信号转导通路[6]。不同弓形虫株间的ROP16基因序列呈多态性,导致差异性的毒力表型[9-10]。II型弓形虫(如Me49)多呈隐性感染,主要与人弓形虫病的发生密切相关,其占艾滋病患者感染的65%[11]。因此,本研究以人肺腺癌细胞A549细胞株为研究模型,建立了弓形虫ROP16Ⅱ稳定转染的细胞株,通过表达谱芯片技术检测与分析,筛选差异表达基因,而后通过Toppgene生物信息学策略筛选II型弓形虫病候选基因,以期发现新的致病基因,对于更加全面地揭示II型弓形虫病的发病机制具有重要意义。
1 材料与方法
1.1材料与试剂 弓形虫Me49株、E.coliDH5α及pEGFP-N1质粒为本实验室保存;A549人肺腺癌细胞购自上海细胞库;胎牛血清(Gibco公司,美国);Trizol(Invitrogen公司,美国);DMEM(Hyclone公司,美国);Real time PCR 试剂盒(Takala,日本);EcoRⅠ限制性内切酶(NEB公司,美国);cDNA第一链合成试剂盒、TransLipid Transfection Reagent转染试剂购自全式金公司;全基因组表达谱芯片采用Agilent人类4×44K基因表达微阵列v2芯片。
1.2 方法
1.2.1细胞培养 A549和HFF细胞均按常规细胞培养方法培养,即复苏后的细胞传代培养于含10% FBS的DMEM培养基中,37 ℃ 5% CO2培养,2~4 d传代一次。
1.2.2弓形虫Me49株RNA的提取与cDNA的合成 Me49虫株复苏后接种于HFF细胞,37 ℃ 5% CO2培养7 d后,收集细胞培养液,800 g离心后取上清,12 000 g离心收集沉淀即为Me49虫株。采用Trizol试剂反复吹打沉淀虫体裂解,进行RNA提取,反转录生成cDNA。
1.2.3ROP16Ⅱ重组表达载体的构建与鉴定 Me49虫株ROP16基因引物两端同时包含EcoRⅠ,KpnⅠ酶切位点,上游序列:5′-CCGGAATTCTGATGAAAGTGACCACGAAAGGG-3′,下游序列:5′-CGGGTACCACATCCGATGTGAAGAAA-GTTC-3′。将PTEN PCR产物与pEGFP-N1载体质粒分别用EcoRⅠ和KpnⅠ限制性内切酶双酶切,回收DNA凝胶,将回收的PCR酶切产物与pEGFP-N1质粒混合后进行连接;而后转化到E.coliDH5α感受态细胞中,37 ℃ Kan抗性培养12 h;挑取单菌落,摇菌,提取质粒DNA,酶切鉴定并测序。取测序正确的菌液,摇菌扩大培养,提取质粒DNA,用于后期实验。
1.2.4表达谱芯片以及数据分析 应用Agilent人类4 × 44K基因表达微阵列v2芯片,样品标记和芯片杂交根据Agilent One-Color Microarray-Based Gene Expression Analysis实验方案执行。使用Agilent Feature Extraction软件处理原始图像,提取原始数据。接着利用GeneSpring GX v12.1软件进行差异基因筛选,标准为FC值≥2.0。而后采用MAS 3.0系统和KEGG数据库对DEGs进行GO功能分类注释。本实验由上海康成生物有限公司完成。
1.2.5Toppgene 筛选弓形虫疾病候选基因Toppgene(http://toppgene.cchmc.org/)是一个有效而方便的基于基因功能相似性的候选基因筛选方法[12]。首先利用Genecards(http://www.genecards.org/)人类基因的综合数据库搜索所有已知和预测的“Toxoplasma”疾病基因,同时也采用OMIM(http://omim.org/)在线人类孟德尔遗传搜索“Toxoplasma”已知的疾病基因。对两数据库的搜索到的疾病基因进行交集分析,将交集基因作为“训练基因集”,而以GeneSpring GX v12.1数据集的差异表达基因作为“检测基因集”,然后按Toppgene操作方法筛选出候选基因。
1.2.6荧光定量RT-qPCR 收集转染后的A549细胞,分别提取pEGFP-N1-Me49 ROP16、pEGFP-N1及空A549细胞的总RNA进行反转录及RT-qPCR反应。以β-actin作为内参,对IL12RB1,IL4R,IL2RG及STAT1的特异性扩增引物进行RT-qPCR(PCR扩增参数:95 ℃ 3 min;95 ℃ 20 s,55 ℃ 20 s,72 ℃ 20 s,40个循环;65 ℃ 5 s,95 ℃),检测得到的数据根据2-△△Ct方法分析各组A549细胞中IL12RB1,IL4R,IL2RG及STAT1的mRNA表达水平。
表1 RT-qPCR引物序列
Tab.1 The primers sequences used for RT-qPCR
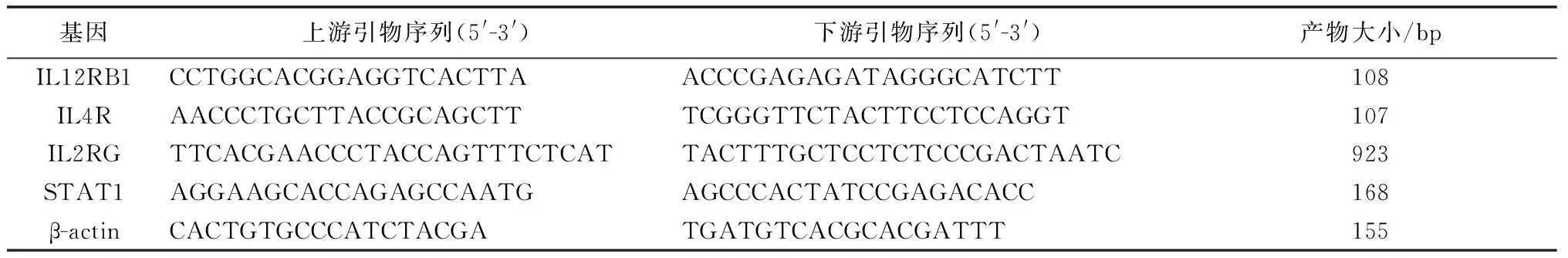
基因上游引物序列(5'-3')下游引物序列(5'-3')产物大小/bpIL12RB1CCTGGCACGGAGGTCACTTAACCCGAGAGATAGGGCATCTT108IL4RAACCCTGCTTACCGCAGCTTTCGGGTTCTACTTCCTCCAGGT107IL2RGTTCACGAACCCTACCAGTTTCTCATTACTTTGCTCCTCTCCCGACTAATC923STAT1AGGAAGCACCAGAGCCAATGAGCCCACTATCCGAGACACC168β-actinCACTGTGCCCATCTACGATGATGTCACGCACGATTT155
1.2.7统计学分析 采用SPSS 22.0软件处理数据。采用单因素方差分析,P<0.05表示有统计学意义。
2 结 果
2.1RNA质量评估 提取的样品总RNA 经Nanodrop核酸测定仪检测,其OD260/OD280比值均在1.8~2.0 之间;电泳后可以清晰地看到28 S和18 S两条清晰条带,且亮度比约为2∶1,5 S条带不清晰,提示试验制备的 RNA 质量良好,其纯度、浓度和完整性均符合后续研究要求。
2.2差异表达基因的筛选 采用信号值比值法进行差异基因筛选。图中x轴表示原始质粒样品的荧光信号强度值,y轴则表示pEGFP-N1-Me49 ROP16转染组样品的荧光信号强度值。图中的所有数据点都表示芯片上的对应的一个基因点的杂交信号,红色为表达上调,绿色为表达下调。与原始质粒pEGFP-N1-NC转染组相比较,pEGFP-N1-Me49 ROP16转染组呈现出差异性表达的 基因共有9 994个(t=10.507,P<0.05),其中上调的基因有4 293个,下调的基因有5 701个(图1)。在上调表达的差异基因分布中,差异倍数大于10的基因有45个(1.05%);其中CMPK2表达量最大(24.03),其次是IFITM1(23.22),IFIT2(18.69)。而在下调表达的差异基因分布中,差异倍数小于-10的有427个(7.50%),小于-30的有36个(0.63%)。具体见表2。
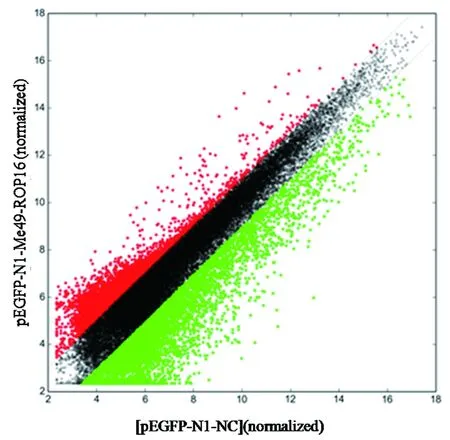
图1 散点图Fig.1 Log-log scatter plot
2.3GO富集分类 利用基因富集分析与 GO 分类标准从细胞组成(Cellular Component,CC),分子功能(Molecular Function,MF)以及生物学过程(Biological Process,BP)3 个方面[13]对差异表达基因进行功能注释分类,以分析差异基因主要影响的生物学通路和功能。结果显示,GO 富集结果主要表现在BP和CC 两大类。其中,对BP进行分析发现,pEGFP-N1-Me49 ROP16细胞转染影响了多种生物学过程。对上调和下调差异表达基因进行分类分析发现,上调的差异基因主要参与防御反应、免疫应答、生物调节、信号转导及刺激反应等方面。下调的差异基因则主要参与生物学过程、G-蛋白耦合受体信号通路、系统发育、神经发育、生命发育、突触传导及感官知觉等方面,部分也与刺激反应有关(图4)。
表2 FC值(上调/下调)表达量最大的部分基因
Tab.2 Representative list of(up-regulated/down-regulated)genes
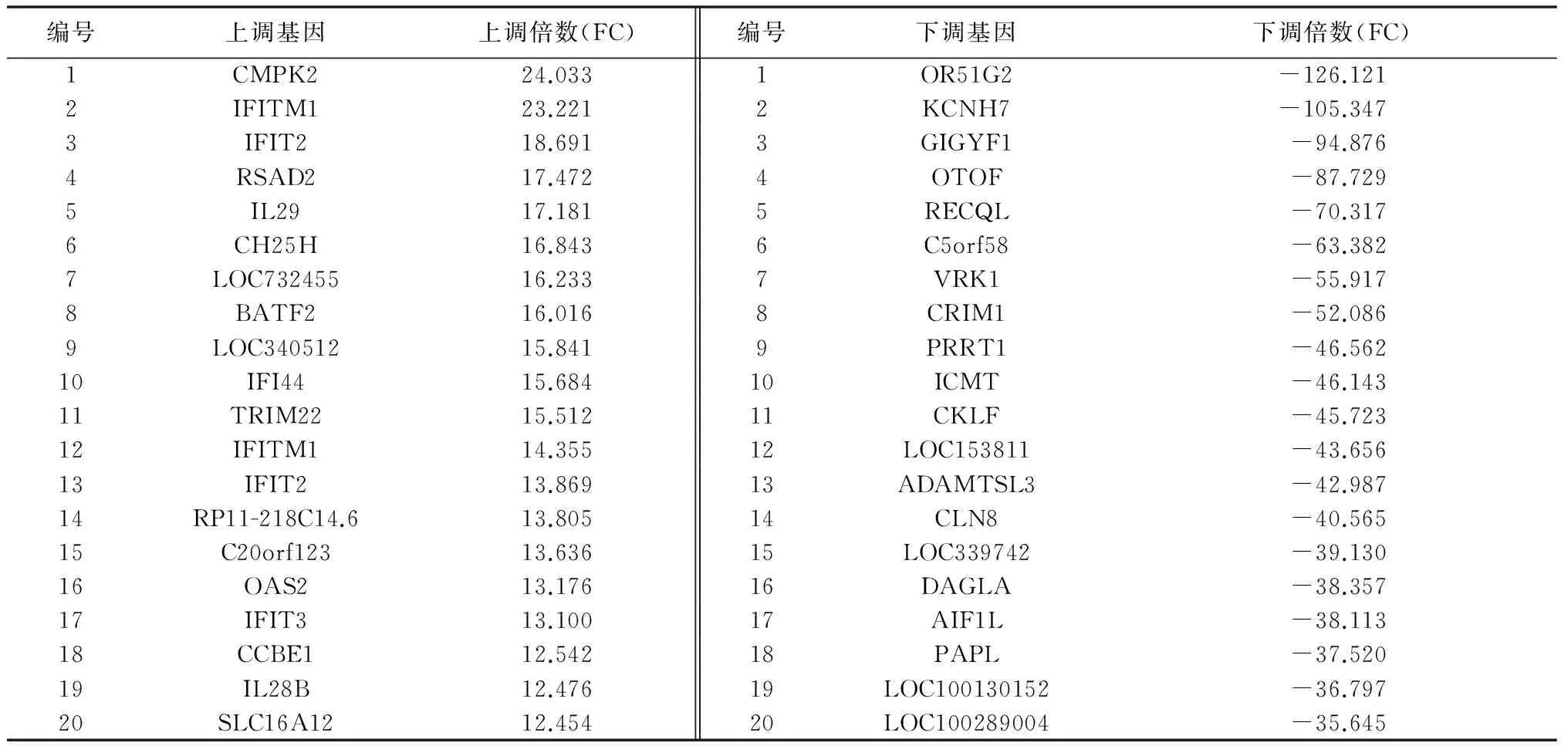
编号上调基因上调倍数(FC)编号下调基因下调倍数(FC)1CMPK224.0331OR51G2-126.1212IFITM123.2212KCNH7-105.3473IFIT218.6913GIGYF1-94.8764RSAD217.4724OTOF-87.7295IL2917.1815RECQL-70.3176CH25H16.8436C5orf58-63.3827LOC73245516.2337VRK1-55.9178BATF216.0168CRIM1-52.0869LOC34051215.8419PRRT1-46.56210IFI4415.68410ICMT-46.14311TRIM2215.51211CKLF-45.72312IFITM114.35512LOC153811-43.65613IFIT213.86913ADAMTSL3-42.98714RP11-218C14.613.80514CLN8-40.56515C20orf12313.63615LOC339742-39.13016OAS213.17616DAGLA-38.35717IFIT313.10017AIF1L-38.11318CCBE112.54218PAPL-37.52019IL28B12.47619LOC100130152-36.79720SLC16A1212.45420LOC100289004-35.645
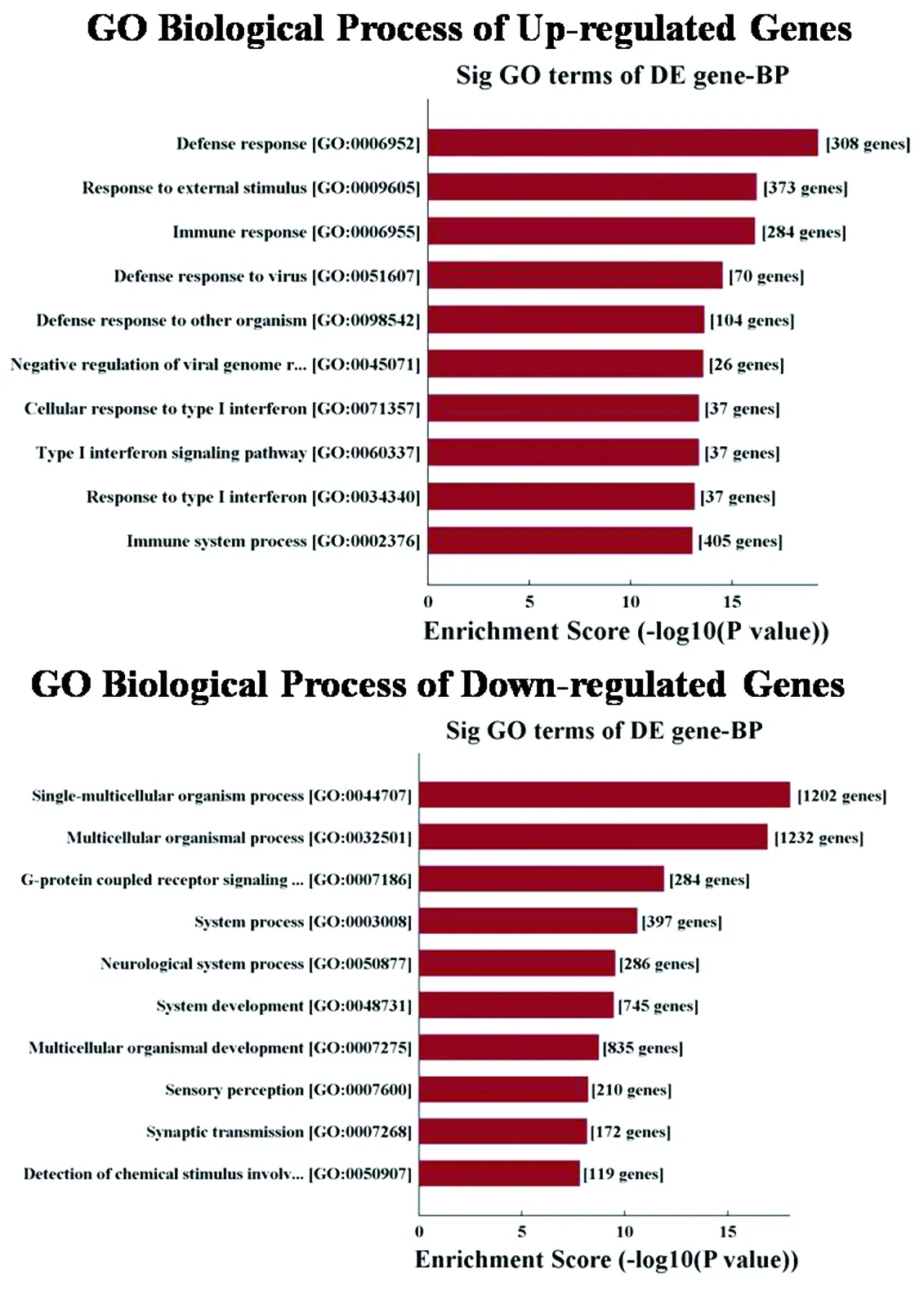
图2 差异表达基因的GO富集分析BPFig.2 Enriched GO terms of differentially expressed genes in terms of biological process
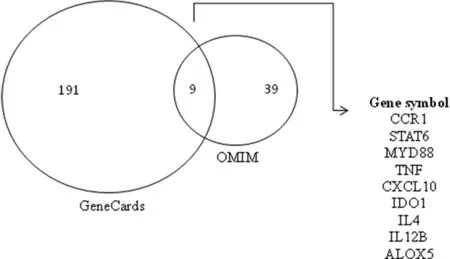
图3 GeneCards和 OMIM数据库获得的弓形虫疾病训练基因Fig.3 Training gene set for ToppGene derived from GeneCards and OMIM databases
2.4筛选II型弓形虫病候选基因 以“Toxoplasma”作为搜索词,在Genecards中搜素已知的弓形虫疾病基因,共获得191条gene card 记录。通过OMIM查询“Toxoplasma”疾病基因,共获得39条弓形虫相关疾病基因。对两种方法获得的疾病基因进行交集分析,最终获得9个已知的弓形虫病相关基因,如图3所示。随后,将这9个基因作为“训练基因集”,而以差异表达基因作为“检测基因集”,采用Toppgene和ToppNet方法对候选基因集进行优化排序,以期筛选II型弓形虫病候选基因。表3显示通过Toppgene和ToppNet方法筛选出的前30个II型弓形虫病候选基因。通过对两种方法获得的候选基因进行交集分析,发现Toppgene和ToppNet方法同时筛选出了IL12RB1,IL4R,IL2RG及STAT1这4个基因。
表3 前30个Toppgene筛选的II型弓形虫病候选基因
Tab.3 Top 30 candidate genes of ToppGene for type II T. gondii
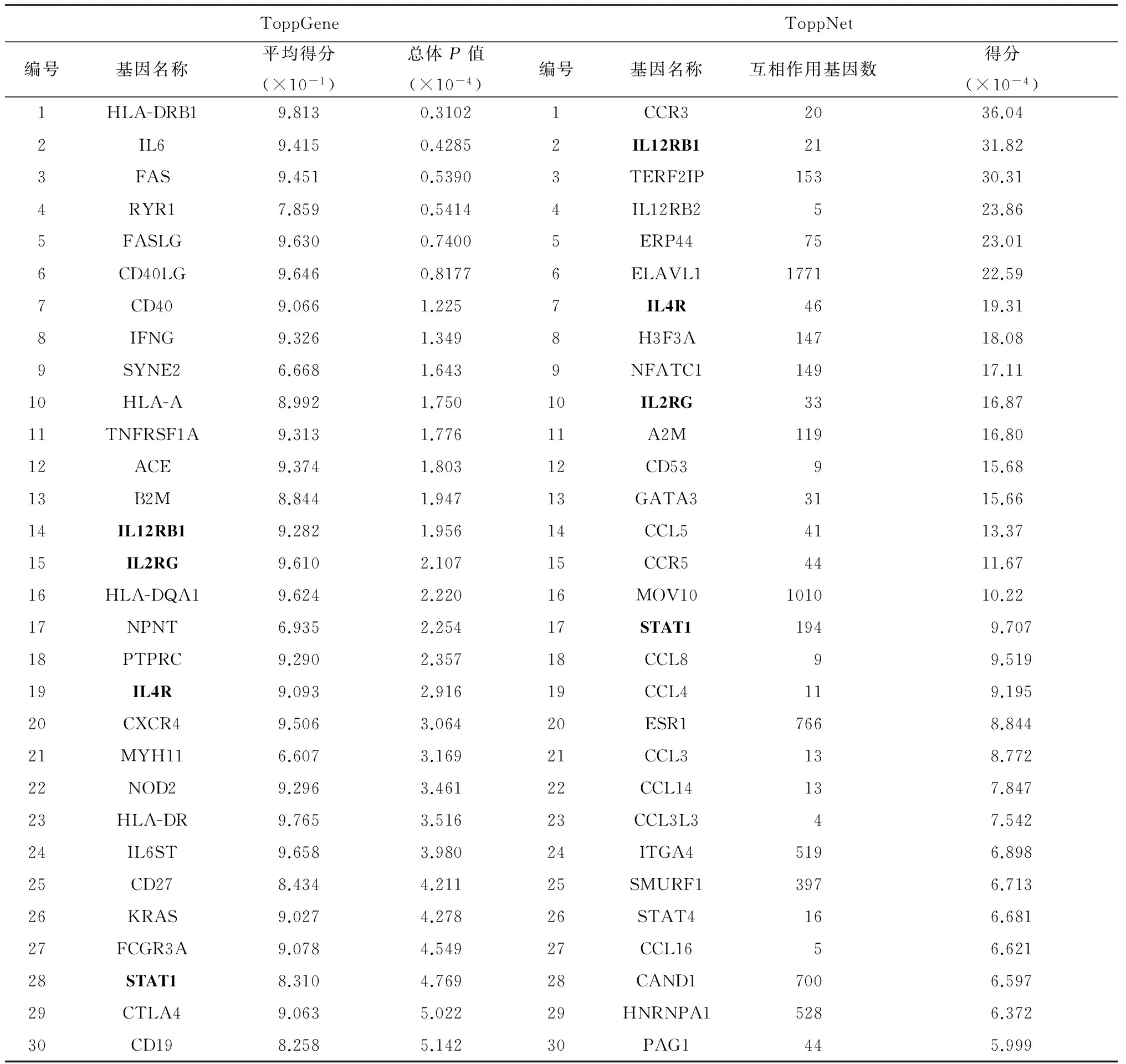
ToppGeneToppNet编号基因名称平均得分(×10-1)总体P值(×10-4)编号基因名称互相作用基因数得分(×10-4)1HLA-DRB19.8130.31021CCR32036.042IL69.4150.42852IL12RB12131.823FAS9.4510.53903TERF2IP15330.314RYR17.8590.54144IL12RB2523.865FASLG9.6300.74005ERP447523.016CD40LG9.6460.81776ELAVL1177122.597CD409.0661.2257IL4R4619.318IFNG9.3261.3498H3F3A14718.089SYNE26.6681.6439NFATC114917.1110HLA-A8.9921.75010IL2RG3316.8711TNFRSF1A9.3131.77611A2M11916.8012ACE9.3741.80312CD53915.6813B2M8.8441.94713GATA33115.6614IL12RB19.2821.95614CCL54113.3715IL2RG9.6102.10715CCR54411.6716HLA-DQA19.6242.22016MOV10101010.2217NPNT6.9352.25417STAT11949.70718PTPRC9.2902.35718CCL899.51919IL4R9.0932.91619CCL4119.19520CXCR49.5063.06420ESR17668.84421MYH116.6073.16921CCL3138.77222NOD29.2963.46122CCL14137.84723HLA-DR9.7653.51623CCL3L347.54224IL6ST9.6583.98024ITGA45196.89825CD278.4344.21125SMURF13976.71326KRAS9.0274.27826STAT4166.68127FCGR3A9.0784.54927CCL1656.62128STAT18.3104.76928CAND17006.59729CTLA49.0635.02229HNRNPA15286.37230CD198.2585.14230PAG1445.999
2.5RT-qPCR验证 为了进一步验证Toppgene所筛选的基因,本研究采用RT-qPCR对IL12RB1,IL4R,IL2RG及STAT1这4个基因进行验证,结果发现,尽管RT-qPCR所验证的基因的变化倍数与表达谱检测结果不完全相同,但变化方向一致,即pEGFP-N1-Me49 ROP16转染组中IL12RB1与IL2RG表达下调,而IL4R与STAT1表达上调(图4)。
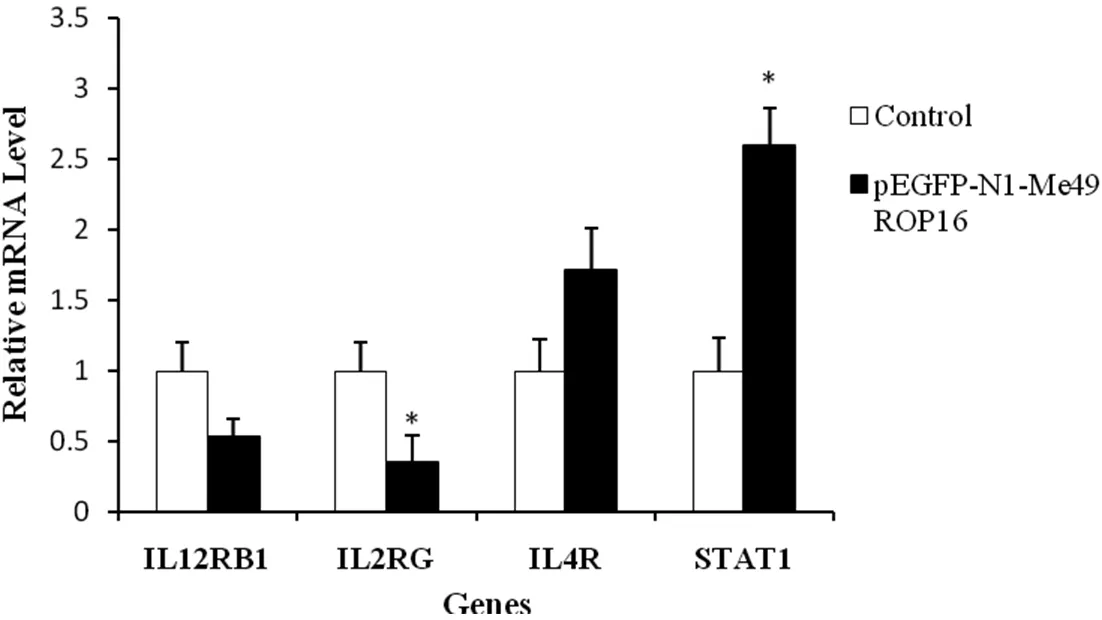
图4 RT-qPCR对表达谱芯片结果的验证Fig.4 Validation of the microarray results by RT-qPCR
3 讨 论
基因芯片技术作为一种高通量、高效能的筛选工具,在大规模获取生物信息的同时, 产生了海量的数据,不能提供足够特异的疾病基因信息[14]。因此,结合多种生物信息学工具进一步有效、深入地挖掘是十分有必要的。Toppgene 作为一种基于基因功能相似性的方法近年来被广泛应用于疾病基因的发现,其能够从GO 注释、通路、疾病、转录因子、蛋白相互作用等方面对基因进行全面评价,具有高通量、重复性好及快速的优势[12,15]。在此背景下,本研究运用了基因芯片技术结合 Toppgene 生物信息学策略进行表达谱数据分析。
通过在人肺腺癌A549细胞株中转染重组质粒过表达 ROP16Ⅱ后发现,ROP16Ⅱ在A549细胞中过表达后共产生了9 994个差异表达基因,其中上调的基因有4 293个,下调的基因有5 701个。在上调表达差异的基因分布中,CMPK2表达量最大,其次是 IFITM1和IFIT2。研究发现,IFITM1是控制细胞生长的重要因子。其与机体免疫反应有关,由IFN刺激诱导分泌产生,在STAT1和p53两个信号介质间提供交互作用。此外,IFITM1蛋白参与同型黏附和抗增生信号的转导,与免疫监视、抗病毒及抗肿瘤等相关[16-17]。IFIT2作为IFITs家族一员,在正常生理情况下基本不表达。但当病毒感染、微生物等诱导情况下,IFIT2会快速大量表达。IFIT2在激活IFN信号、促细胞凋亡中发挥关键作用[18]。
生物学功能富集分析可以发现ROP16Ⅱ涉及到的特定生物学过程。本研究表明,A549细胞中过表达重组质粒ROP16Ⅱ后影响了多种生物学过程,这些生物学过程涉及了细胞内重要的生命活动。其中,上调的差异基因主要富集在免疫方面,如免疫反应、防御反应等方面。而下调的差异基因则主要富集在生物学过程、G-蛋白耦合受体信号通路及神经发育等方面。
另外,在本研究中我们联合应用 Genecards和 OMIM两种文献挖掘工具,建立了一个包含9个已知的弓形虫病相关基因的“训练基因集”(CCR1,STAT6,MYD88,TNF,CXCL10,IDO1,IL4,IL12B及 ALOX5),并应用此“训练基因集”结合 Toppgene工具最终筛选到 4个致病候选基因。在这4个候选基因中,IL12RB1和 IL2RG 基因表达下调。IL12RB1 基因编码的 IL12受体β1与低亲和性的 IL12结合,参与 IL12转导;与 IL12RB2相关联,可导致高亲和性 IL12结合位点的形成和 IL12依赖性信号的重构。另外,IL12RB1与 IL23R结合,可形成 IL23受体复合物[19]。IL23在多种感染中都发挥着重要的作用,是 Th1细胞介导的免疫炎性反应的主要调节因子。IL2RG是细胞因子 IL2,IL4,IL7及 IL21等传递信号所共同需要的受体成分[20]。而上调的 IL4R 基因编码了 IL4受体的α链。一方面,IL4受体可以结合 IL4和 IL13来调节 IgE的生成。另一方面,IL4受体也可以结合 IL4,促进 Th2细胞的分化[21]。此外,ROP16Ⅱ也可以诱导宿主细胞高表达STAT1。STAT1是先天性免疫所必需的,具有抗感染及抑制细胞增殖的作用,可参与细胞分化、促进细胞凋亡及免疫调节等生理过程。STAT1在对细菌、寄生虫及病毒的免疫调控中起着关键作用,其异常表达会导致机体对病原微生物的易感性。STAT1与Th1应答有关,参与大部分 MHC 对抗原肽的呈递过程。STAT1 通过调控 IL27 的表达,可诱导 B 细胞早期成熟。STAT1 可直接诱导T-bet蛋白的表达,激活免疫球蛋白[22]。此外,Lieberman 等研究表明,在弓形虫病中,STAT1的主要作用不是保护T细胞的反应,而是在 MHC上调表达、产生足够的 NO、IFN 诱导的 GTPase 家族的部分蛋白上调表达、T-bet上调表达等抗虫效应机制中起重要作用[23]。
综上所述,ROP16Ⅱ影响宿主细胞基因表达谱,IL12RB1,IL4R,IL2RG及STAT1这4个免疫调控相关基因的发现,对于深入理解ROP16在虫体与宿主细胞间的相互作用,以及致病的分子机制具有重要意义。
参考文献:
[1] Jensen KD, Hu K, Whitmarsh RJ, et al.Toxoplasmagondiirhoptry 16 kinase promotes host resistance to oral infection and intestinal inflammation only in the context of the dense granule protein GRA15[J]. Infect Immun, 2013, 81(6):2156-67. DOI: 10.1128/IAI.01185-12.
[2] Drini M, Wagner A, Sarate P, et al.Toxoplasmagondiitachyzoite-extract acts as a potent immunomodulator against allergic sensitization and airway inflammation[J]. Sci Rep,2017,7(1):15211. DOI: 10.1038/s41598-017-15663-4.
[3] John B, Ricart B, Tait Wojno ED, et al. Analysis of behavior and trafficking of dendritic cells within the brain during toxoplasmic encephalitis[J]. PLoS Pathog, 2011,7(9):e1002246. DOI: 10.1371/journal.ppat.1002246.
[4] Montoya JG,Remington JS. Management ofToxoplasmagondiiinfection during pregnancy[J]. Clin Infect Dis, 2008,47(4):554-566. DOI: 10.1086/590149
[5] 赵志军,董辉,汪涛,等.大鼠巨噬细胞感染弓形虫的基因表达谱分析[J].中国人兽共患病学报, 2016, 32(4): 371-375. DOI:10.3969/j.issn.1002-2694.2016.04.011
[6] 刘功振,王彬,王洪法.弓形虫棒状体蛋白ROP16的研究进展[J].中国血吸虫病防治杂志, 2015, 27(2): 217-220.DOI: 10.16250/j.32.1374.2014253
[7] Butcher BA, Fox BA, Rommereim LM.Toxoplasmagondiirhoptry kinase ROP16 activates STAT3 and STAT6 resulting in cytokine inhibition and arginase-1-dependent growth control[J]. PLoS Pathog,2011,7(9):e1002236. DOI: 10.1371/journal.ppat.1002236
[8] Ong YC, Reese ML, Boothroyd JC.Toxoplasmarhoptry protein 16 (ROP16) subverts host function by direct tyrosine phosphorylation of STAT6[J]. J Biol Chem,2010, 285(37): 28731-40. DOI: 10.1074/jbc.M110.112359
[9] Jensen KD, Wang Y, Wojno ED, et al.Toxoplasmapolymorphic effectors determine macrophage polarization and intestinal inflammation[J].Cell Host Microbe,2011, 9(6):472-483. DOI:10.1016/j.chom.2011.04.015
[10] Behnke MS, Khan A, Wootton JC, et al. Virulence differences inToxoplasmamediated by amplification of a family of polymorphic pseudo kinases[J]. Proc Natl Acad Sci U S A, 2011, 108(23):9631-9636.DOI: 10.1073/pnas.1015338108
[11] 郭玉娟.Ⅱ型弓形虫感染对小鼠日本血吸虫肝纤维化抑制作用的实验研究[D]. 合肥:安徽医科大学, 2016.
[12] 王桂平,叶云,郑文岭. Toppgene筛选肺腺癌候选疾病基因[J].中国肺癌杂志,2010,13(4).282-286.DOI: 10.3779/j.issn.1009-3419.2010.04.02
[13] 陈淑吟,陆勤勤,张美如. 条斑紫菜优良品系的基因芯片表达谱分析[J]. 天津农业科学,2015,21(4):6-14. DOI:10.3969/j.issn.1006-6500.2015.04.002
[14] Smedley D, Köhler S, Czeschik JC, et al. Walking the interactome for candidate prioritization in exome sequencing studies of Mendelian diseases[J]. Bioinformatics, 2014, 30(22):3215-22. DOI: 10.1093/bioinformatics/btu508
[15] Fan WW, Chang S, Shan XM, et al. Transcriptional profile of SH-SY5Y human neuroblastoma cells transfected byToxoplasmarhoptry protein16[J]. Mol Med Rep, 2016,14(5):4099-4108. DOI: 10.3892/mmr.2016.5758
[16] 刘宇虎. IFITM1基因在结直肠癌中的作用研究进展[J]. 医学研究杂志,2009,9(38):2-3.
[17] Fu Y, Zhou Z, Wang H,et al. IFITM1 suppresses expression of human endogenous retroviruses in human embryonic stem cells[J]. FEBS Open Bio,2017,7(8):1102-1110.DOI: 10.1002/2211-5463.12246
[18] Davis BM, Fensterl V, Lawrence TM, et al. Ifit2 is a restriction factor in rabies virus pathogenicity [J]. J Virol,2017,91(17). pii: e00889-17. DOI: 10.1128/JVI.00889-17
[19] Deng Q, Chen S, Fu C, et al. Long noncoding RNA expression profiles in sub-lethal heat-treated hepatoma carcinoma cells[J]. World J Surg Oncol,2017,15(1):136.DOI: 10.1186/s12957-017-1194-4
[20] Ayars M, O’Sullivan E, Macgregor-Das A, et al. IL2RG, identified as overexpressed by RNA-seq profiling of pancreatic intraepithelial neoplasia, mediates pancreatic cancer growth[J]. Oncotarget, 2017,8(48):83370-83383. DOI: 10.18632/oncotarget
[21] Vadevoo SMP, Kim JE, Gunassekaran GR, et al. IL4 receptor-targeted proapoptotic peptide blocks tumor growth and metastasis by enhancing antitumor immunity[J]. Mol Cancer Ther, 2017, 6. DOI: 10.1158/1535-7163.MCT-17-0339
[22] Lieberman LA, Banica M, Reiner SL, et al. STAT1 plays a critical role in the regulation of antimicrobial effector mechanisms, but not in the development of Th1-type responses during toxoplasmosis[J]. J Immunol,2004,172(1):457-463.
