浙江省啮齿动物、牛和羊感染的无形体种属
2018-05-18,,,,,,,,,
,,,,,,,, ,
立克次体目(Rickettsiales)无形体科(Anaplasmataceae)无形体属(Anaplasmas)立克次体能够引起人类和动物急慢性传染病,病原通过吸血节肢动物叮咬人和动物传播,野生哺乳动物是无形体的主要宿主。无形体属中边缘无形体(A.marginale)、中心无形体(A.centrale)、嗜吞噬细胞无形体(A.phagocytophilum)、牛无形体(A.bovis)和绵羊无形体(A.ovis)能感染哺乳动物,引起无形体病[1-2]。1932年,嗜吞噬细胞无形体被确立为动物致病原,1990年美国首次发现人类病例[3],之后人发病率在美国锐增,欧洲国家也发现了嗜吞噬细胞无形体感染。1997年以来,已经多次证实中国东北部和西北部的蜱、啮齿动物和家畜中存在嗜吞噬细胞无形体,包括黑龙江、吉林、新疆以及内蒙古[4-7]。2006年安徽省广德县发生一起医院感染,一些接触嗜吞噬细胞无形体感染患者的医护人员和患者家属发病[8],其它部分省份也有疑似病例发生[9-10]。在中国北部、南部和西南部已经发现反刍动物中边缘无形体、中心无形体、血小板无形体(A.platys)、牛无形体和绵羊无形体流行[5,11-13]。2014年,在黑龙江省不明原因发热病人血中检测到与A.centrale相似但不同的新立克次体核酸,并分离到病原体,命名为山羊无形体(A.capra)[14]。2008-2011年,本研究在浙江省部分山区,采集啮齿动物肝脾和家畜全血,采用巢式PCR扩增无形体属16S rRNA基因并测序,鉴定啮齿动物和家畜中存在的无形体种属,分析其16S rRNA基因变异。
1 材料与方法
1.1调查地点 调查点设在安吉(N30.68、E11968)、天台(N29.15、E121.03)、金华(N29.12、E119.64)、磐安(N28.84、E120.32)4个县、市的山区和丘陵地带,每个县、市选择3个调查点。调查时间为2008-2011年。
1.2样本采集 浙江省蜱活动的高峰季节是3-4月,另一个较小活动高峰季节是8-12月。3月和4月采集牛和山羊全血,共53只牛和58只山羊,磐安县未采集牛羊标本。8-12月捕获452只啮齿动物,捕获工具除磐安县用鼠笼外,其余县市用鼠夹。现场进行鼠种鉴定,啮齿动物包括社属、黑线姬鼠、青毛鼠、黄毛鼠、黄胸鼠、褐家鼠、针毛鼠、小林姬鼠、大林姬鼠、白腹鼠、黑线仓鼠和松鼠。从啮齿动物中无菌解剖取肝和脾(0.5~1)cm×1.5 cm小块。标本在液氮保存,运送至浙江省疾病预防控制中心待用。
1.3DNA提取 约100 mg脾和肝切成小块,研磨成匀浆,或200 μL血液用于提取DNA,采用Universal Genomic DNA extraction Kit(Takara生物技术有限公司,大连),根据说明书进行。
1.416S rRNA基因PCR扩增和测序 筛选试验:参照《人粒细胞无形体病预防控制技术指南》实验室检测方案进行靶向无形体16S rRNA基因389 bp较恒定区序列的巢式PCR,引物见表1(上海生工生物技术有限公司合成),筛选无形体属各种群阳性样本。
鉴定试验:筛选试验中阳性的样本通过另一巢式PCR进一步扩增接近完整16S rRNA基因的核苷酸序列,第1轮引物Out1和EC9,第2轮引物EC12A和Out2扩增约643 bp的片段,OBPf603/MCf603和Ar1451扩增789 bp的片段。取20 μLDNA作为第1轮PCR的模板,10 μL第1轮扩增反应产物作为第2轮反应的模板,均为50 μL反应体系。扩增程序:第1轮,94 ℃ 5 min急变性, 94 ℃ 3 s,55 ℃ 40 s,72 ℃ 90 s,40个循环,最后72 ℃ 10 min延伸。第二轮扩增程序除延伸时间改为40 s外,基本同第一轮。目标条带用3730DNA Analzer测序仪测序(上海生工生物技术有限公司)。样本TT-025中用引物EC12A和Out2得到的PCR产物,通过pUCm-T载体(生工生物技术有限公司,上海)克隆测序。643 bp和789 bp的序列通过Mega 5.0软件比对拼接成1 400 bp左右的片段。
表1 16S rRNA引物和序列
Tab.1 16S rRNA primers

引物名序列(5'-3')产物/bp参考文献Out1ttgagagtttgatcctggct-cagaacg652[15]Out2cacctctacactaggaattc-cgctHGA1gtcgaacggattattctttat-agcttg389[9]HGA2tataggtaccgtcattatct-tccctacEC12Atgatcctggct-cagaacgaacg1458[2]EC9taccttgttacgacttMCOf603ctgcttttaatactgcag-gacta789本研究PPBf603ctgcttttaatactgccagact789本研究Ar1451cccaaccttaaatggctgcc本研究

1.5序列比对和系统发生分析 目标条带测序获得的核苷酸序列进行Blast比对(http:www.ncbi.nlm.nih.gov/ BLAST),并通过Mega 5.0软件与GenBank中登录的其它无形体序列进行多序列比对和系统发生分析[16],进化历史推断采用Neighbor-Joining方法,Bootstrap试验采用1 000次重复,进化距离采用p-distance方法计算。
1.6核苷酸序列GenBank登录号 本文引用的无形体16S rRNA参考序列的GenBank登录号及菌株名称在图1和图2注明。本文测序获得新的无形体序列GenBank登录号:HM439430、HM439432、HM439433、EU595732、JN862824、JN862825、KM817188。
2 结 果
2.1各无形体种感染率 筛选试验检测安吉、天台、金华牛和山羊血液样本,阳性率分别为27.3%(9/33)、97.7%(42/44)、20.6%(7/34),结果见表2。无形体16S rRNA目标片段(389 bp)的阳性率分别为58.5% (31/53) 和43.1% (25/58)。452只啮齿动物的肝脾样本中,22个样本被扩增到389 bpDNA片段,四县、市所调查鼠无形体的感染状况见表3。感染鼠种包括社属、黑线姬鼠、青毛鼠、黄毛鼠、黄胸鼠、褐家鼠、白腹鼠、黑线仓鼠和松鼠,而针毛鼠、小林姬鼠和大林姬鼠没有检测到阳性。每次实验的阴性对照未检测到目标片段。当地饲养牛羊较少(已经将调查点所有牛羊纳入调查),天台的13只羊来自同一农户,安吉山羊中也有10只来自同一农户。另外,随机捕获到各种啮齿动物量不均衡,因此没有采用统计学方法进行感染率比较。
表2 家畜无形体感染率
Tab.2 Incidence of Anaplasma infection in domestic animals
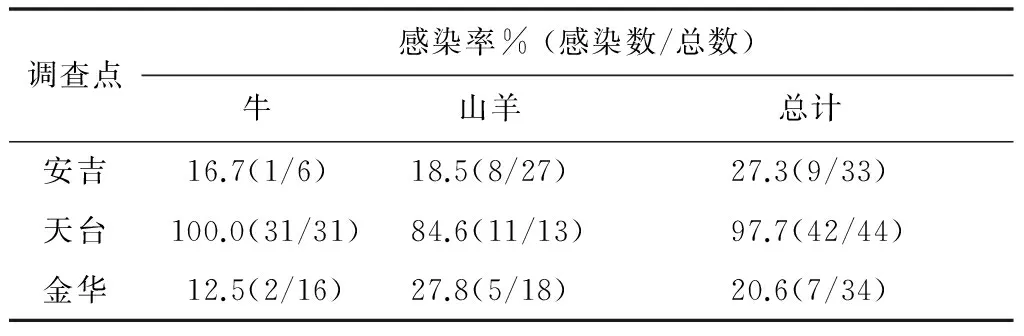
调查点感染率%(感染数/总数)牛山羊总计安吉16.7(1/6)18.5(8/27)27.3(9/33)天台100.0(31/31)84.6(11/13)97.7(42/44)金华12.5(2/16)27.8(5/18)20.6(7/34)
表3 啮齿动物无形体感染率
Tab.3 Incidence of Anaplasma infection in rodent animals

调查点感染数/总数R.cA.aB.bR.lR.tR.nN.fA.sA.pN.cCricetulussquirrelTotal(%)安吉4/271/341/34〛1/17/96(8.3)天台1/81/140/20/2〛2/26(7.7)金华5/470/11/170/10/5〛1/297/100(7.0)磐安0/270/31/141/321/191/310/380/30/82/52〛0/36/230(2.6)
R. c,社鼠;A. a,黑线姬鼠;B. b,青毛鼠;R. l, 黄毛鼠;R. t,黄胸鼠;R. n, 褐家鼠;N.f,针毛鼠;A. s,小林姬鼠;A. p,大林姬鼠;N. c,白腹巨鼠。
2.2无形体基因鉴定与系统发生分析 78份筛选试验阳性的389 bp片段测序,获得16S rRNA基因约350 bp的核苷酸序列,多序列比对和系统发生分析表明分别与6个无形体种相似(表4,图1)。筛选试验中阳性的样本进一步扩增接近完整16S rRNA基因的核苷酸序列,通过测序和剪切,23份标本获得1 397-1 424 bp的16S rRNA序列,1份样本只测到641 bp序列。多序列比对显示7个序列型(表5),代表序列分别命名为ZJ01/2008, ZJ06/2009, ZJ01/2009, ZJ02/2009, ZJ04/2009,ZJ05/2009和ZJ07/2009。初步分析表明,各县市无形体种感染状况差异较大(表5),天台地区动物尤其是牛的无形体种多样性尤为显著。
6个样本检测到389 bp序列与A.phagocytophilum相似,鉴定试验仅1样本(黄毛鼠)再次扩增到643 bp和789 bp片段,拼接获得1 420 bp序列ZJ01/2008(HM439430)。1 420 bp序列比对分析与褐家鼠分离的河南菌株HN(KC470064)仅1 bp差异[17],与另外3个浙江嗜吞噬细胞无形体序列(DQ458805、DQ458807、DQ458808)有99. 8%的相似性[18],后3个序列分别在褐家鼠、社鼠、白腹鼠中检测到,而与原型株Webster有99.2%的相似性。引物EC12A和Out2扩增样本TT-025的PCR产物,因为16S rRNA基因序列上游区域双峰反复测序没有成功。最后,通过pUCm-T载体克隆测序,挑选了23个菌斑测序,结果显示在31 bp上游区域显示明显差异,其中8个菌斑序列一致,即ZJ06/2009(JN86825),与序列ZJ01/2008和菌株
表4 无形体属各个种在动物中的感染状况
Tab.4 Infection status of Anaplasma species in animals
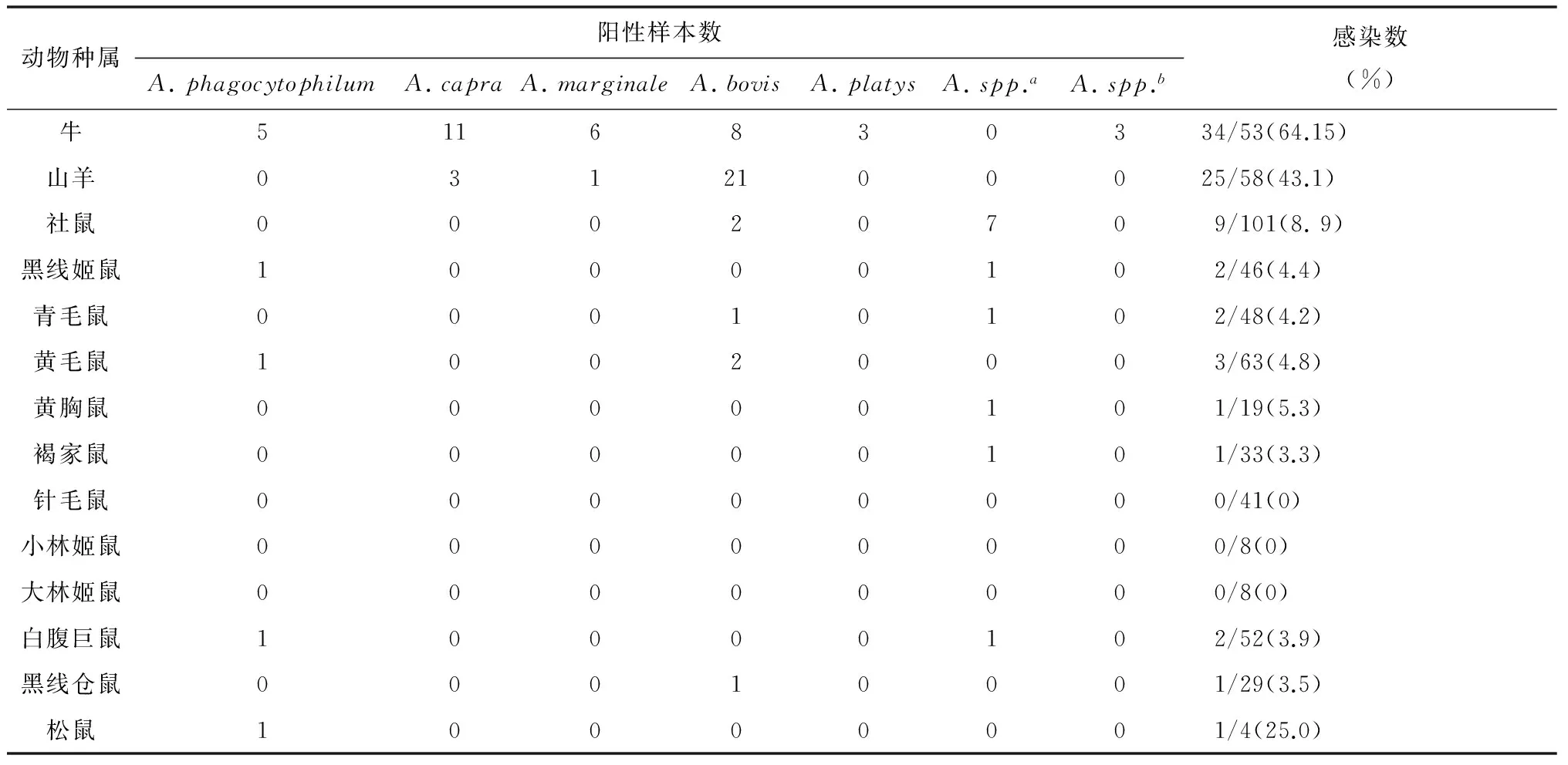
动物种属阳性样本数A.phagocytophilumA.capraA.marginaleA.bovisA.platysA.spp.aA.spp.b感染数(%)牛5116830334/53(64.15)山羊0312100025/58(43.1)社鼠00020709/101(8.9)黑线姬鼠10000102/46(4.4)青毛鼠00010102/48(4.2)黄毛鼠10020003/63(4.8)黄胸鼠00000101/19(5.3)褐家鼠00000101/33(3.3)针毛鼠00000000/41(0)小林姬鼠00000000/8(0)大林姬鼠00000000/8(0)白腹巨鼠10000102/52(3.9)黑线仓鼠00010001/29(3.5)松鼠10000001/4(25.0)
a在鼠中发现的未分类无形体;b在牛中发现的未分类无形体。
表5 无形体属各个种的地区分布
Tab.5 Regional distribution of Anaplasma species
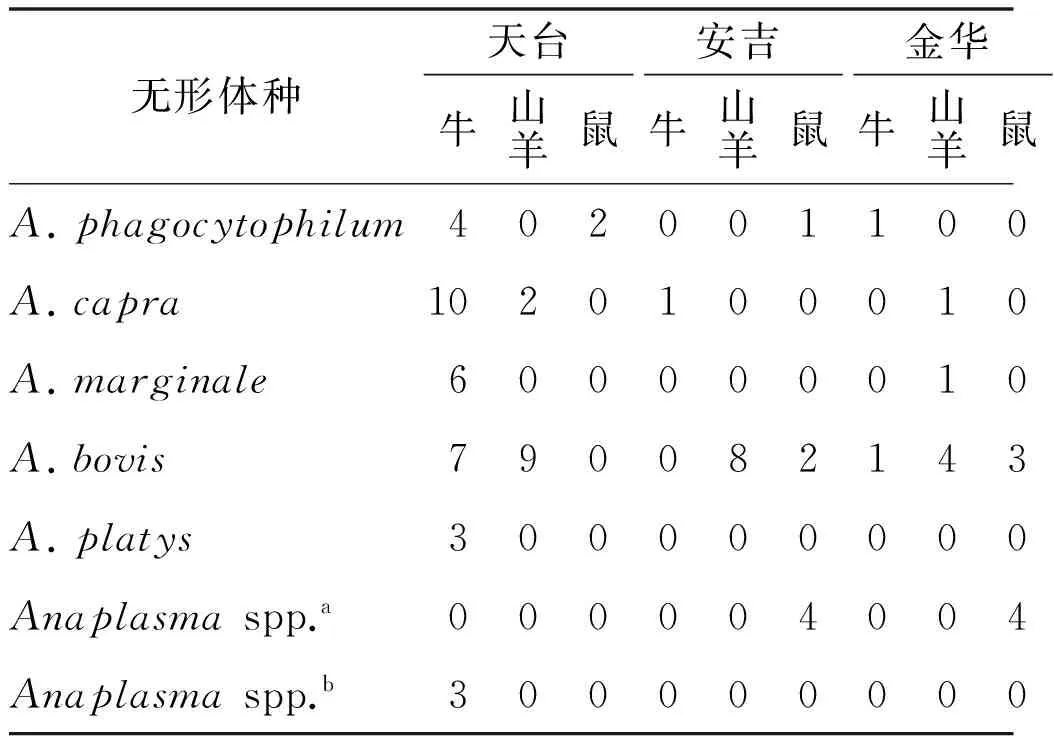
无形体种天台安吉金华磐文牛山羊鼠牛山羊鼠牛山羊鼠鼠A.phagocytophilum4020011001A.capra10201000100A.marginale6000000100A.bovis7900821431A.platys3000000000Anaplasmaspp.a0000040044Anaplasmaspp.b3000000000
Webster相似性均为99.1%,另7个菌斑序列与A. marginale完全一致,表明TT-o25存在混合感染。另有3个牛血样本389 bp序列(TT-020、TT-023和TT-031)与浙江山羊检测到序列ZJ81(KP062963)100%一致。见表6。
389 bp序列与A.bovis相似的33个样本,包括山羊、牛、社鼠、黄毛鼠和黑线仓鼠,其中4个样本鉴定试验中完成大约1 400 bp的序列测序。多序列比对,4个序列有1个或2个互相不同的SNP,ZJ04/2009代表共同一致的序列(1412 bp)提交到GenBank(HM595732)。序列ZJ04/2009、Wulong(FJ169956)、wlg-2(FJ389577)和zxg-1(FJ389573)有99.72%~99.86%的相似性,后3个序列在中国西南部山羊中检测到[11],序列ZJ04/2009与A.bovis原型株U03735有99.43%的相似性。
表6 16S rRNA基因的核苷酸序列比对分析
Tab.6 Alignment analysis for nucleotide sequences of 16s rRNA gene
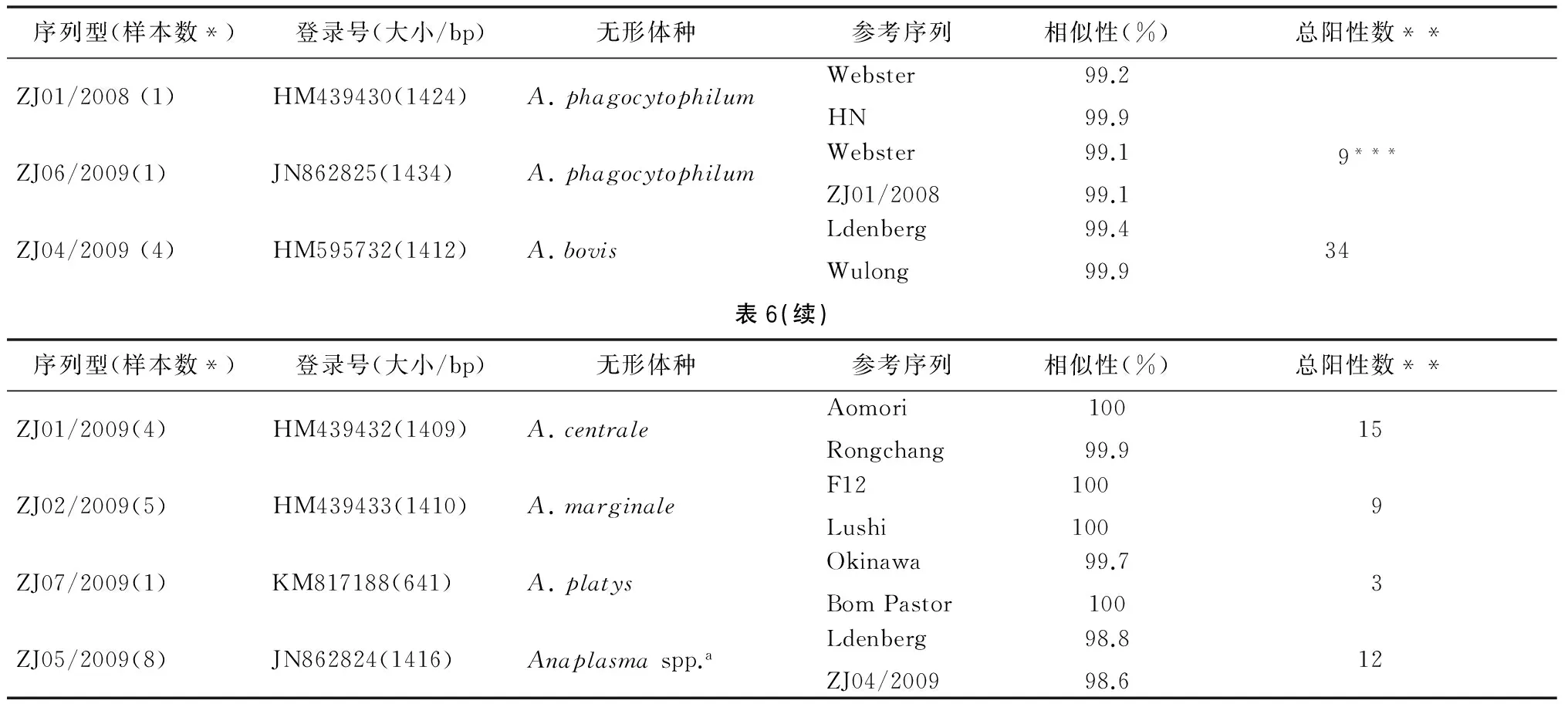
序列型(样本数*)登录号(大小/bp)无形体种参考序列相似性(%)总阳性数**ZJ01/2008(1)HM439430(1424)A.phagocytophilumWebsterHN99.299.99***ZJ06/2009(1)JN862825(1434)A.phagocytophilumWebsterZJ01/200899.199.1ZJ04/2009(4)HM595732(1412)A.bovisLdenbergWulong99.499.934表6(续)序列型(样本数*)登录号(大小/bp)无形体种参考序列相似性(%)总阳性数**ZJ01/2009(4)HM439432(1409)A.centraleAomoriRongchang10099.915ZJ02/2009(5)HM439433(1410)A.marginaleF12Lushi1001009ZJ07/2009(1)KM817188(641)A.platysOkinawaBomPastor99.71003ZJ05/2009(8)JN862824(1416)Anaplasmaspp.aLdenbergZJ04/200998.898.612
*完成大约1 400 bp测序的样本数;**389 bp序列相似的总样本数;***A.phagocytophilum相关序列,389 bp序列未能分类,ZJ01/2008(1)和ZJ06/2009(1)总阳数为9。
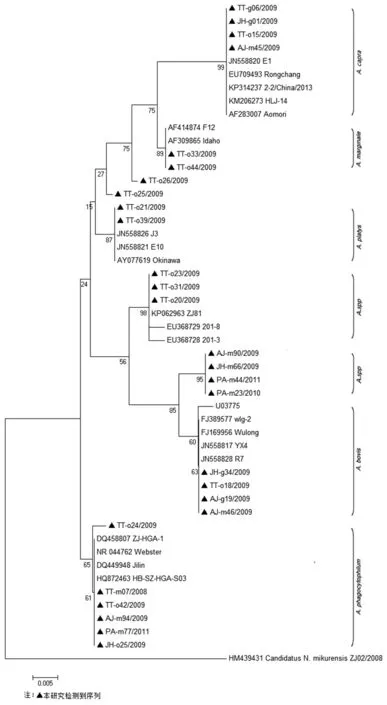
图1 16S rRNA基因350 bp核苷酸序列系统发生分析Fig.1 Phylogenetic tree of the 16S RNA gene based on 350 bp nucleotide sequences
389 bp序列与A.capra相似的14个样本(来自山羊、牛),鉴定试验中4样本获得1 409 bp序列(ZJ01/2009,HM439432),与日本菌株Aomori有100%的相似性,与中国西南部检测到的3个序列Rongchang(EU709493)、szg-1(FJ389574)和szg-3(FJ389576)之间有99.86%~99.93%的相似性。9个样本(牛和山羊)检测到389 bp序列与A.marginale相似,其中5个样本获得1 410 bp序列(ZJ02/2009,HM439433),与澳大利亚菌株F12以及在中国中部牛中检测到的序列(HM538192)有100%的相似性。另外,在天台县的牛中检测到389 bp序列与A.platys相似的3个样本,仅1样本扩增到643 bp片段 (ZJ07/2009,KM817188)。
值得注意的是,序列ZJ05/2009广泛存在于野生鼠中,包括社鼠、青毛鼠、黑线仓鼠、黄胸鼠、褐家鼠和白腹巨鼠。除了天台县,进行调查的其它县市野鼠都有检测到。650 bp片段在5个样本中测序成功,790 bp片段在3个样本中测序成功,这些序列100%一致。序列ZJ05/2009(1416 bp)与菌株U03775有98.80%的相似与序列ZJ04/2009有98.52%的相似,与GenBank中的其它无形体序列明显不同。
系统发生分析表明(图2),浙江省啮齿动物、牛和山羊中检测到的16S rRNA基因序列分布在6个主要的无形体种群中,包括嗜吞噬细胞无形体、牛无形体、边缘无形体、山羊无形体、血小板无形体和一种新发现的变异株ZJ05/2009。
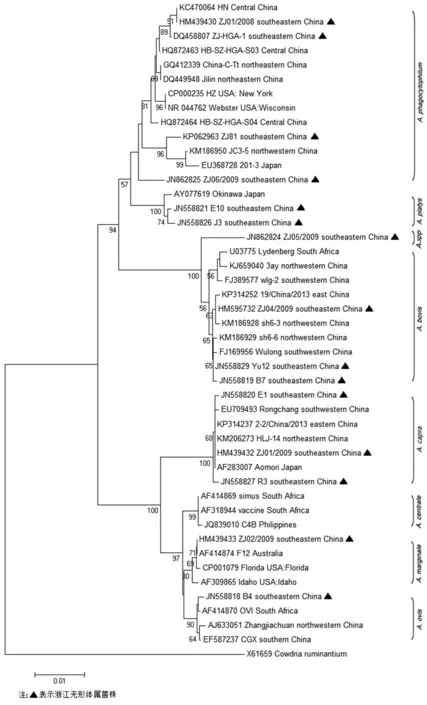
图2 16S rRNA基因1 356 bp核苷酸序列系统发生分析Fig.2 Phylogenetic tree of the 16S RNA gene based on 1 356 bp nucleotide sequences
3 讨 论
野生哺乳动物是无形体属立克次体感染的主要宿主,关于嗜吞噬细胞无形体宿主谱的研究较多,其野生动物宿主包括野猪、欧洲刺猬、棕熊、鹿、兔、马、牛、羊、狗和啮齿动物[19]。调查表明中国北部、中部和西南部的牛和羊中存在嗜吞噬细胞无形体和其它无形体属立克次体感染[5,11-13],浙江省检测到嗜吞噬细胞无形体的感染的动物除了家畜,还有包括松鼠的啮齿动物[18,20]。本研究通过对16S rRNA基因的测序鉴定无形体种属,浙江牛和羊存在A.phagocytophilum、A.bovis、A.marginale和A.platys,另一个研究表明浙江丽水山区山羊存在A.ovis感染[12],因此浙江家畜中存在除A.centrale以外的所有已被认识的无形体种。而啮齿动物除了存在A.phagocytophilum感染外,社鼠、黄毛鼠和青毛鼠中还存在A.bovis感染。据我们所知,这是啮齿动物A.bovis感染的首次报道。
1966年日本于感染牛中首次分离无形体Aomori株,分类学地位曾归属于A.centrale种[21]。2010年,我们在浙江省牛和山羊血中检测到与Aomori株100%一致的16S rRNA基因序列(ZJ01/2009,HM439432),本研究3只山羊和11只牛血检测到相同序列,在中国西南部的牛中也曾检测到3个相似序列(99.86%~99.93%)Rongchang(EU709493)、szg-1(FJ389574)和szg-3(FJ389576)[11]。直到2014年,黑龙江省不明原因发热病人血中分离到病原体,最终被定位为无形体属的一个新种A.capra[14]。
16S rRNA基因常被用以细菌鉴定或种属分类,认为16S rRNA基因序列的相似性至少达到95%才能确定一个属,至少达到99%才能确定一个种[22]。一个流行株ZJ05/2009广泛存在于野鼠中,但家畜中没有发现。ZJ05/2009株与A.bovis的16S rRNA基因序列的相似性低于98.8%,推测可能为啮齿动物中一种与A.bovis相关的无形体新种。2006年以来,我们曾在浙江黄毛鼠和社鼠中检测到与菌株ZJ05/2009相同的序列(EF535107和FJ182047)[23],其16S rRNA基因序列没有变异,推测它可能是浙江省啮齿动物中长期存在一个流行株,是否会导致人类和动物疾病还不清楚,需要进一步关注。
浙江省家畜和啮齿动物流行的5个已认识无形体种中,A.phagocytophilum的16S rRNA基因变异相当大。至今为止,至少检测到4种不同的嗜吞噬细胞无形体16S rRNA基因代表序列(ZJ-HGA-1、ZJ01/2008、ZJ06/2009和ZJ81),明显不同于中国东北部以及世界其它地区的嗜吞噬细胞无形体菌株。基于16S rRNA、gltA、msp4和groESL基因序列分析,有学者认为菌株ZJ-HGA-1可能是一种新的嗜吞噬细胞无形体变异株[18]。因为立克次体核酸比较容易降解,多基因、大信息量的新种鉴定研究需要分离到病原体才可能实现,必须加大力度投入分离病原体的工作。值得关注的是,在浙江省甚至整个中国发现人粒细胞无形体病病例很少,浙江省迄今只有1例人粒细胞无形体病确诊[24],原因可能是该疾病还未被临床医生充分认识而漏诊,我们有必要进一步关注无形体属立克次体人感染的早期诊断。另外是否因为变异导致毒力下降,使之临床症状不明显抑或不致病。在浙江省动物的无形体属中存在潜在的变异和新种,我们还不清楚基因多样性是否会导致发病率、致病性或临床特征上的一些变化。
(致谢: 现场样本采集得到浙江省安吉县疾病预防控制中心、金华金东区疾病预防控制中心、天台县疾病预防控制中心、磐安县疾病预防控制中心同行大力支持与协助,一并致谢。)
参考文献:
[1] Dumler JS, Barbet AF, Bekker CP, et al. Reorganization of genera in the familiesRickettsiaceaeandAnaplasmataceaein the orderRickettsiales: unification of some species ofEhrlichiawithAnaplasma,CowdriawithEhrlichiaandEhrlichiawithNeorickettsia, descriptions of six new species combinations and designation ofEhrlichiaequiand "HGE agent" as subjective synonyms ofEhrlichiaphagocytophila[J].Int J Syst Evol Microbiol,2001,51(6):2145-2165. DOI: 10.1099/00207713-51-6-2145
[2] Kawahara M, Rikihisa Y, Lin Q, et al. Novel genetic variants ofAnaplasmaphagocytophilum,Anaplasmabovis,Anaplasmacentraleand a novelEhrlichiasp. in wild deer and ticks on two major islands in Japan[J]. Appl Environ Microbiol, 2006, 72(2):1102-1109. DOI: 10.1128/AEM.72.2.1102-1109.2006
[3] Chen SM, Dumler JS, Bakken JS, et al. Identification of a granulocytotropicEhrlichiaspecies as the etiologic agent of human disease[J]. J Clin Microbiol, 1994, 32(3):589-595.
[4] Cao WC, Zhao QM, Zhang PH, et al.GranulocyticEhrlichiaeinIxodespersulcatusticks from an area in China where Lyme disease is endemic[J]. J Clin Microbiol, 2000,38(11): 4208-4210.
[5] Wen BH, Cao WC, Pan H.Ehrlichiaeand ehrlichial diseases in China[J]. Ann N Y Acad Sci, 2003, 990(1): 45-53.
[6] Cao WC, Zhan L, He J, et al. NaturalAnaplasmaphagocytophiluminfection of ticks and rodents from a forest area of Jilin province, China[J]. Am J Trop Med Hyg, 2006, 75(4):664-668.
[7] Zhan L, Cao WC, Jiang JF, et al.Anaplasmaphagocytophilumfrom rodents and sheep, China[J]. Emerg Infect Dis, 2010, 16(5):764-768. DOI: 10.3201/eid1605.021293
[8] Zhang L,Liu Y,Ni D,et a1.Nosocomial transmission of human granulocytic anaplasmosis in China[J].JAMA,2008,300(19):2263-2270.
[9] 张丽娟,崔峰,王玲,等.山东省沂源县无形体病实验室调查分析[J].传染病信息,2009,22(1):22-25.
[10] Zhang LJ, Shan AL, Bobby M, et al. Rickettsial seroepidemiology among farm workers, Tianjin, People’s Republic of China[J]. Emerg Infect Dis, 2008,14(6):938-940. DOI: 10.3201/eid1406.071502
[11] Zhou ZY, Nie K, Tang C, et al. Phylogenetic analysis of the genusAnaplasmain Southwestern China based on 16S rRNA sequence [J]. Res Vet Sci, 2010, 89(2):262-265. DOI: 10.1016/j.rvsc.2010.02.009
[12] Liu ZJ, Ma ML, Wang ZW, et al. Molecular survey and genetic identification ofAnaplasmaspecies in goats from Central and Southern China[J]. Appl Environ Microb, 2012, 78(2):464-470. DOI: 10.1128/AEM.06848-11
[13] Li Y, Chen Z, Liu Z, et al. Molecular survey ofAnaplasmaand of red deer and sika deer in Gansu, China in 2013[J/OL]. Transbound Emerg Dis, 2016, 63(6):e228. DOI: 10.1111/tbed.12335
[14] Li H, Zheng YC, Ma L, et al. Human infection with a novel tick-borneAnaplasmaspecies in China: a surveillance study [J]. Lancet Infect Dis,2015,15(6):663-670. DOI: 10.1016/S1473-3099(15)70051-4
[15] Wen B,Jian R,Zhang Y,et al.Simultaneous detection ofAnaplasmamarginaleand a newEhrlichiaspecies closely related toEhrlichiachaffeensis by sequence analyses of 16S ribosomal DNA inBoophilusmicroplusticks from Tibet[J]. J Clin Mierobiol,2002,40(9):3286-3290.
[16] Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739. DOI: 10.1093/molbev/msr1
[17] Zhao XG, Li H, Sun Y, et al. Dual infection withAnaplasmaphagocytophilumandBabesiamicrotiinRattusnorvegicus,China [J]. Ticks Tick-Borne Dis, 2013, 4(5):399-402. DOI: 10.1016/j.ttbdis.2013.04.002
[18] Zhan L, Cao WC, de Vlas SJ, et al. A newly discoveredAnaplasmaphagocytophilumvariant in rodents from southeastern China [J]. Vector-Borne Zoonotic Dis, 2008, 8(3):369-380. DOI: 10.1089/vbz.2007.0211
[19] Stuen S, Granquist EG, Silaghi C.Anaplasmaphagocytophilum-a widespread multi-host pathogen with highly adaptive strategies [J]. Front Cell Infect Microbiol, 2013, 3: 31. DOI: 10.3389/fcimb.2013.00031
[20] 陆群英,顾时平,柴程良,等. 浙江西天目山部分动物感染无形体种属调查[J].中华微生物学和免疫学杂志,2014,34(8):589-593.
[21] Inokuma H, Terada Y, Kamio T, et al. Analysis of the 16S rRNA gene sequence ofAnaplasmacentrale and its phylogenetic relatedness to other ehrlichiae[J]. Clin Diagn Lab Immunol, 2001,8 (2): 241-244. DOI: 10.1128/CDLI.8.2.241-244.2001
[22] Clarridge JE 3rd.Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases[J].Clin Microbiol Rev,2004,17(4):840-862. DOI: 10.1128/CMR.17.4.840-862.2004
[23] 姜理平,郑寿贵,陆群英,等.浙江省在鼠中检测到埃立克体及无形体DNA片段并测序分析[J].中国卫生检验杂志,2007,l7(11):1972-1974.
[24] 凌锋,陆群英,翁卫东,等.浙江首例人粒细胞无形体病患者病原学分析[J].国际流行病学传染病学杂志,2011,38(6):380-383.
