日本血吸虫MBLAC1基因的克隆及生物信息学分析
2018-05-18,,,,,,
,, ,,,,
目前,我国血吸虫病主要分布在长江以南的湖南、江西、安徽等7个省份[1]。截止到2015年底,我们仍有血吸虫病病人77 194个,6 861万人受到威胁[2]。虽然吡喹酮的化学治疗作用是一种控制血吸虫病的有效手段,但是在塞内加尔和埃及已出现了吡喹酮耐药性的报道[3-4]。世界卫生组织(WHO)推荐的6种疫苗候选分子在实际应用中并没有为抗血吸虫感染提供理想的保护效果[5]。若能筛选到有效的抗血吸虫病的疫苗候选分子或者是发现新的药物靶标,将有助于根除血吸虫病,惠及生活在疫区的数千万人。作为血吸虫与宿主血液直接接触的界面,普遍认为体被与血吸虫营养摄取、免疫逃避、免疫调节、排泄、渗透压调节和信号转导等密切相关[6-7]。因此,通过对血吸虫体被蛋白的研究有可能发现新的疫苗和药物靶点。
在前期日本血吸虫(Schistosomajaponicum)体被免疫蛋白质组学的研究中[8],金属β内酰胺酶结构域蛋白1(Metallo-beta-lactamases domain-containing protein 1,MBLAC1)被鉴定到。金属β内酰胺酶(Metallo-beta-lactamases,MBL)又称金属酶,它的活性部位是金属离子,并且必须要依赖该金属离子才能够发挥出一定的催化作用[9]。金属β内酰胺酶能水解几乎所有的β-内酰胺类抗生素(除了单环类),从而不被临床所用的β-内酰胺类抗生素抑制,因此它是细菌耐药性的重要机制。MBLAC1就是MBL这个超级家族的一分子,在抗生素的选择压力下MBL可能会变异成其它更高效的酶,或者也有可能水解其它底物。
本研究通过克隆获得SjMBLAC1基因片段,并对其基因序列编码的蛋白进行生物信息学分析,从而为该蛋白的生物学功能研究提供基础,并对筛选抗日本血吸虫病的疫苗候选抗原分子具有一定的参考价值。
1 材料与方法
1.1 材料
1.1.1寄生虫和实验动物 日本血吸虫中国大陆株尾蚴由中国农业科学院上海兽医研究所钉螺室提供。新西兰大白兔(雄性,2.5~3.0 kg)购自上海罗泾飞达实验动物养殖场。
1.1.2主要试剂 Trizol购自Invitrogen公司;PrimeScriptTM1st Strand cDNA Synthesis Kit、Ex Taq DNA聚合酶、pMD19-T载体购自TaKaRa生物工程(大连)有限公司;DNA Marker DL2000、大肠杆菌DH5α感受态细胞购自上海天根生物技术有限公司;Agrose、DEPC水购自上海生物工程技术服务有限公司;QIAquick○RGel Extraction Kit购自Qiagen公司;其余试剂为国产分析纯。
1.2 方法
1.2.1日本血吸虫42 d成虫cDNA的合成 将尾蚴经人工腹部贴片感染新西兰白兔(1 000条/只),于感染后42 d进行剖杀,通过肝门静脉灌注收集虫体。用灭菌的PBS(pH7.4)充分洗涤所收集到的虫体,并将其置于液氮冻存备用。取出液氮保存的日本血吸虫42 d成虫,利用Trizol法提取虫体的总RNA,根据PrimeScriptTM1st Strand cDNA Synthesis Kit说明书进行反转录,获得虫体cDNA。
1.2.2SjMBLAC1基因的克隆 根据SjMBLAC1基因的cDNA序列(GenBank ID:FN319125.1)设计引物,并于该序列的5′端和3′端引入两个酶切位点:上游引物P1: 5′-CAGGAATTCATGGGCGCGGACGAT-3′(下划线处为EcoRI酶切位点),下游引物P2: 5′-GACCTCGAGCTAGGCGAGTTCAAC-3′(下划线处为XholI酶切位点)。以日本血吸虫42 d成虫cDNA为模板,PCR扩增含ORF的cDNA序列片段,反应条件为:95 ℃ 5 min,然后95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,共30个循环,最后72 ℃ 10 min。将PCR扩增产物进行1%琼脂糖凝胶电泳。经初步鉴定后,将目的DNA片段进行切胶回收,并参照QIAquick○RGel Extraction Kit说明书对其进行纯化。
1.2.3PCR产物连接转化及测序 将纯化后的目的基因片段克隆至pMD19-T载体,构建质粒pMD19-T-SjMBLAC1,转化至大肠杆菌DH5α感受态细胞,并将转化菌涂布到含氨苄青霉素的LB固体培养基平板上培养12 h,挑取单菌落接种于5 mL的LB液体培养基中振荡培养8 h,经PCR鉴定为阳性的菌液送至Invitrogen公司测序。
1.2.4SjMBLAC1基因的序列分析 利用PSA(NUCLEOTIDE,http://www.ebi.ac.uk/Tools/psa/emboss_needle/nucleotide.html)将测序结果与目标核苷酸序列(GenBank ID:FN319125.1)的ORF进行相似性分析,利用Translate(http://web.expasy.org/translate/)将测序结果推导出编码氨基酸序列。
1.2.5SjMBLAC1基因编码蛋白的生物信息学分析SjMBLAC1基因编码蛋白的生物信息学分析方法总结如表1所示。
表1 相关生物信息学分析软件及网址
Tab.1 Related bioinformatics analysis softwares and websites
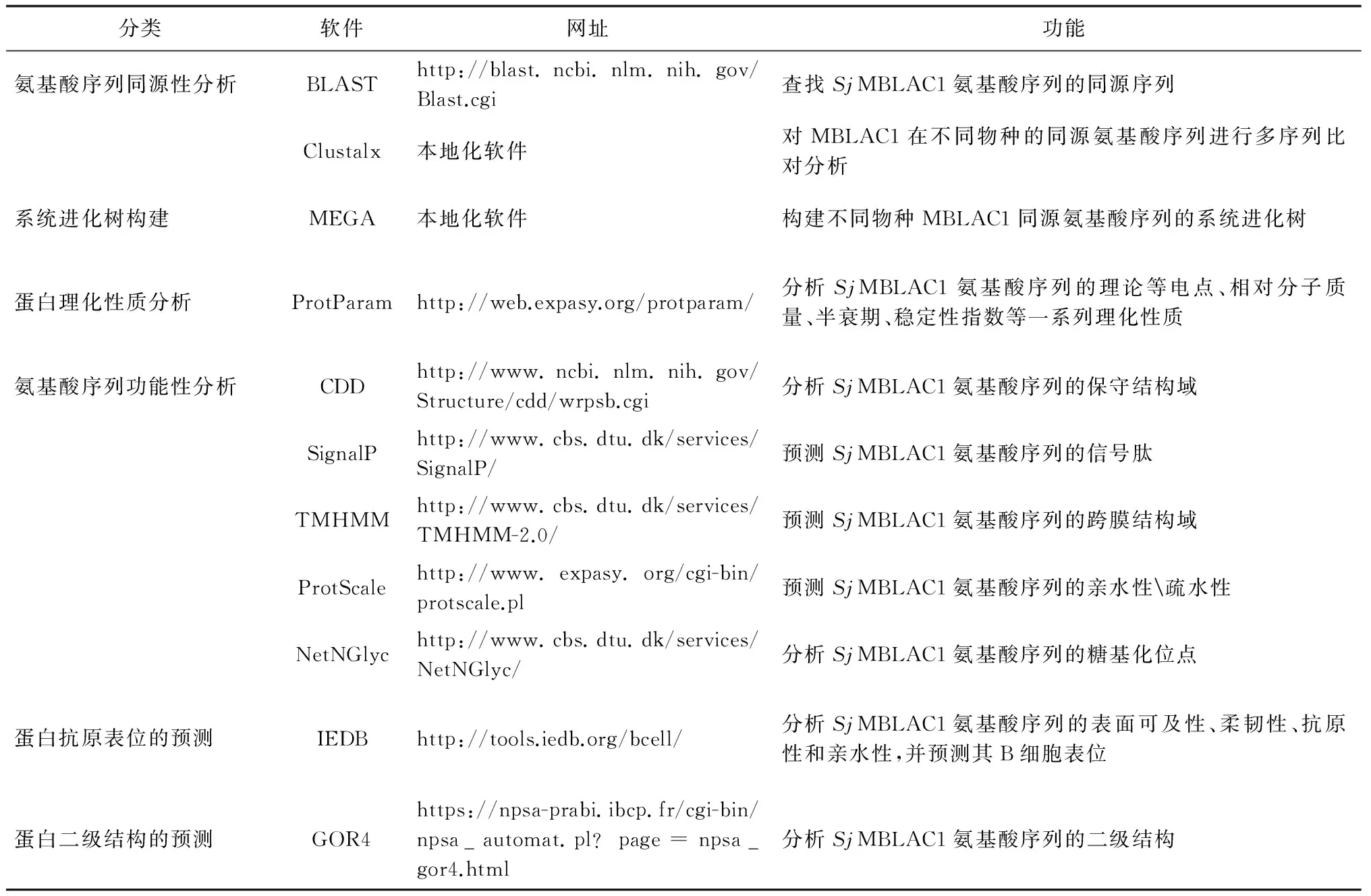
分类软件网址功能氨基酸序列同源性分析BLASThttp://blast.ncbi.nlm.nih.gov/Blast.cgi查找SjMBLAC1氨基酸序列的同源序列Clustalx本地化软件对MBLAC1在不同物种的同源氨基酸序列进行多序列比对分析系统进化树构建MEGA本地化软件构建不同物种MBLAC1同源氨基酸序列的系统进化树蛋白理化性质分析ProtParamhttp://web.expasy.org/protparam/分析SjMBLAC1氨基酸序列的理论等电点、相对分子质量、半衰期、稳定性指数等一系列理化性质氨基酸序列功能性分析CDDhttp://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi分析SjMBLAC1氨基酸序列的保守结构域SignalPhttp://www.cbs.dtu.dk/services/SignalP/预测SjMBLAC1氨基酸序列的信号肽TMHMMhttp://www.cbs.dtu.dk/services/TMHMM-2.0/预测SjMBLAC1氨基酸序列的跨膜结构域ProtScalehttp://www.expasy.org/cgi-bin/protscale.pl预测SjMBLAC1氨基酸序列的亲水性疏水性NetNGlychttp://www.cbs.dtu.dk/services/NetNGlyc/分析SjMBLAC1氨基酸序列的糖基化位点蛋白抗原表位的预测IEDBhttp://tools.iedb.org/bcell/分析SjMBLAC1氨基酸序列的表面可及性、柔韧性、抗原性和亲水性,并预测其B细胞表位蛋白二级结构的预测GOR4https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html分析SjMBLAC1氨基酸序列的二级结构
2 结 果
2.1SjMBLAC1基因的克隆 根据SjMBLAC1基因的cDNA序列(GenBank ID:FN319125.1)设计引物,以日本血吸虫42 d成虫cDNA为模板,进行PCR扩增,1%琼脂糖凝胶电泳显示有一个约711 bp的特异性条带(图1),与SjMBLAC1基因的ORF预期大小一致。
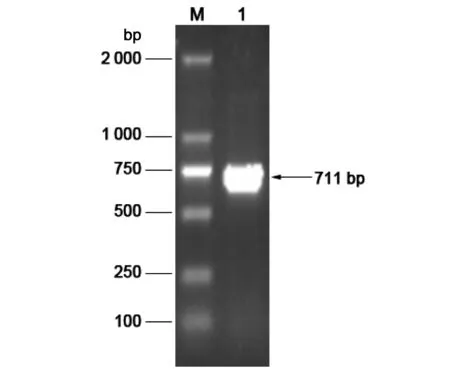
Lane M:DNA Marker DL2000;Lane 1:SjMBLAC1基因PCR扩增产物;图1 SjMBLAC1基因PCR产物电泳图Fig.1 PCR amplification of SjMBLAC1 gene
2.2SjMBLAC1基因的序列分析 测序结果表明,SjMBLAC1基因的ORF片段大小为711 bp,其中,碱基A为193个,占全长的27.14%;碱基G为182个,占全长的25.60%;碱基T为216个,占全长的30.38%;碱基C为120个,占全长的16.88%。测序结果与目标核苷酸序列(GenBank ID:FN319125.1)的相似性为100%,无核苷酸的突变。该基因编码236个氨基酸,结果如图2所示。

图2 SjMBLAC1基因的ORF序列及推导出的氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of SjMBLAC1
2.3SjMBLAC1基因编码蛋白的生物信息学分析
2.3.1氨基酸序列同源性分析及系统进化树构建 利用BLAST在线程序对SjMBLAC1氨基酸序列进行同源性分析,结果表明:与SjMBLAC1氨基酸序列具有一定相似性的MBLAC1氨基酸序列分别来自于埃及血吸虫(Schistosomahaematobium)、
华支睾吸虫(Clonorchissinensis)、人(Homosapiens)、牛(Bostaurus)、大鼠(Rattusnorvegicus)以及小鼠(Musmusculus),其相似性依次是79%、58%、27%、27%、27%、27%,GenBank登录号分别为:XP_012798644.1、GAA53538.1、NP_981942.1、NP_001068680.1、NP_001020167.1、NP_808546.1。
利用Clustalx软件对以上7个物种的MBLAC1蛋白进行氨基酸序列的多重对比分析,结果如图3所示,图中黑色位点为各物种的氨基酸残基完全相同,也就是说这些氨基酸位点都是高度保守位点。MBLAC1氨基酸序列在这7个物种间共有66个保守位点。

不同物种MBLAC1氨基酸序列比对:日本血吸虫MBLAC1(CAX74853.1),埃及血吸虫MBLAC1 (XP_012798644.1),华支睾吸虫MBLAC1 (GAA53538.1),人MBLAC1 (NP_981942.1),牛MBLAC1(NP_001068680.1),大鼠MBLAC1(NP_001020167.1),小鼠MBLAC1 (NP_808546.1)。黑色表示高度保守区域,灰色表示相似区域,连续线性区域表示保守结构域。图3 不同物种MBLAC1氨基酸序列的同源性分析Fig.3 Sequence alignment analysis of MBLAC1 from different organisms
利用MEGA软件对以上7个物种的MBLAC1蛋白进行系统的进化树分析,结果如图4所示,SjMBLAC1与华支睾吸虫和埃及血吸虫两者的MBLAC1在进化关系上较近,与人、牛、大鼠和小鼠的MBLAC1在进化关系上都较远。
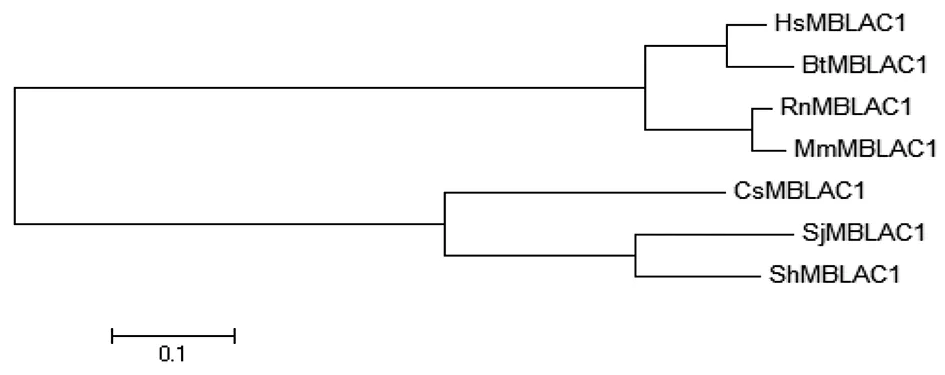
利用MEGA软件中的邻接法完成了对不同物种MBLAC1氨基酸序列的进化分析。这些物种MBLAC1的序列号分别为日本血吸虫MBLAC1(CAX74853.1),埃及血吸虫MBLAC1 (XP_012798644.1),华支睾吸虫MBLAC1 (GAA53538.1),人MBLAC1 (NP_981942.1),牛MBLAC1(NP_001068680.1),大鼠MBLAC1(NP_001020167.1),小鼠MBLAC1 (NP_808546.1)。图4 不同物种MBLAC1氨基酸序列的进化分析Fig.4 Sequence evolution analysis of MBLAC1 from different organisms
2.3.2蛋白理化性质分析 利用ProtParam在线程序对SjMBLAC1氨基酸序列的理化性质进行生物信息学分析,结果表明,该蛋白由236个氨基酸残基组成,化学分子式为C1141H1757N311O360S14,理论等电点为4.84,理论分子量约为26 kD。该蛋白序列的N末端为甲硫氨酸(Met),其在哺乳动物网状红细胞体外表达的半衰期为30 h,在酵母体内表达的半衰期大于20 h,在大肠杆菌中表达的半衰期大于10 h。SjMBLAC1脂肪系数为72.63;总平均亲水指数(GRAVY)为-0.315,表明该蛋白为可溶性蛋白;不稳定系数为25.25,属于稳定蛋白。
该蛋白含有20种氨基酸(图5),带负电荷残基(Asp+Glu)总数为35,带正电荷残基(Arg+Lys)总数为23。各氨基酸的含量中,甘氨酸(Gly)、缬氨酸(Val)的含量最多,都占总氨基酸数的8.9%,色氨酸(Trp)和谷氨酰胺(Gln)的含量最少,都只占总氨基酸数的1.3%。
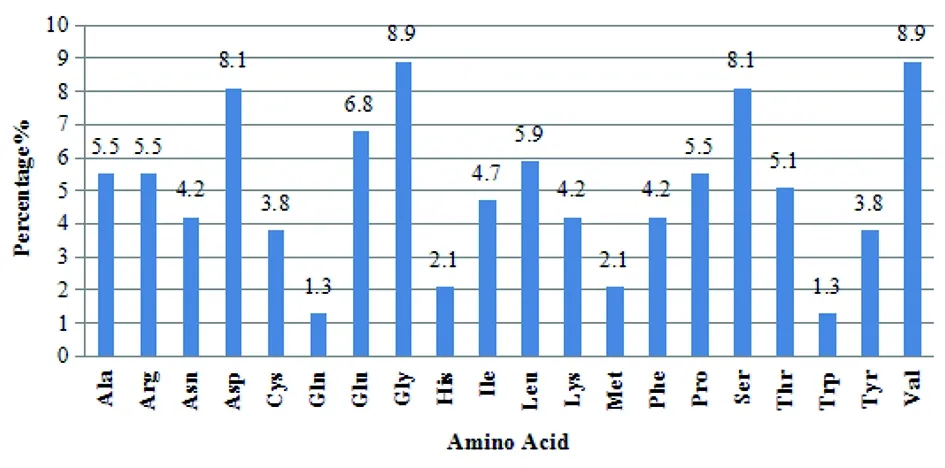
图5 SjMBLAC1蛋白中的20种氨基酸各自所占的百分比Fig.5 Percentage distribution of the 20 amino acids of SjMBLAC1
2.3.3氨基酸序列功能性分析 利用CDD在线程序分析SjMBLAC1氨基酸序列的保守结构域,结果表明,第7~222位氨基酸位点为该蛋白的保守结构域(图3),属于金属β-内酰胺酶(MBL)超级家族。经过SignalP、TMHMM、NetNGlyc、ProtScale等在线程序分析表明,SjMBLAC1氨基酸序列无信号肽;无跨膜结构域,所有氨基酸残基皆暴露于细胞表面;该氨基酸序列中含有一个N-糖基化位点,该位点位于第186位氨基酸;蛋白序列中亲水性氨基酸的得分远高于疏水性氨基酸,表明该蛋白为可溶性蛋白,这与蛋白理化性质分析的结果一致。
2.3.4蛋白二级结构的预测 利用GOR4在线程序分析SjMBLAC1氨基酸序列的二级结构,结果如图6所示,不同二级结构中氨基酸所占的比例为:21个氨基酸残基属于α-螺旋(Alpha helix,缩写为h),占8.90%;0个氨基酸残基属于β-转角(Beta turn,缩写为t),占0%;66个氨基酸残基属于β-折叠(Extended Strand,缩写为e),占27.97%;149个氨基酸残基属于无规则卷曲区域(Random coil,缩写为c),占63.14%。其中无规则卷曲区域主要分布于N端第1~7、12~18、21、25~28、34~38、42~51、57~69、74~80、83、88~91、101~104、109~123、128~136、142~158、161~172、181~194、211、216~232和236位氨基酸,以上这些肽段形成抗原表位的可能性较大。

h:α-螺旋;e:β-折叠;c:无规则卷曲区域图6 GOR4预测SjMBLAC1蛋白的二级结构Fig.6 Secondary structures of SjMBLAC1 protein predicted by GOR4
2.3.5蛋白抗原表位的预测 利用在线程序IEDB分析SjMBLAC1蛋白的B细胞抗原表位。①Emini法预测SjMBLAC1氨基酸序列中表面可及性较高的区域为:62-67、98-104、130-135、144-149、168-173、186-195、197-202、221-228,如图7A。②采用Karplus-Schulz法分析SjMBLAC1蛋白序列的可塑性,结果显示共有10个可塑性较强区域,分别为:13-19、33-38、42-69、100-105、112-117、128-136、142-156、162-174、186-194、218-226,如图7B。③运用Kolaskar-Tongaonkar法分析抗原性,结果表明SjMBLAC1氨基酸序列的平均抗原指数为1.031,抗原指数较高的区域为:5-14、19-33、37-43、70-75、78-84、123-129、135-143、154-160、172-183、212-226,如图7C。④Parker法预测SjMBLAC1蛋白的亲水性,其亲水性区域分布较多,主要分布于14-27、57-68、72-80、98-103、110-116、129-135、144-155、169-174、182-196氨基酸,如图7D。
综合考虑表面可及性、可塑性、抗原性、亲水性等多种预测方案,结合二级结构的分析结果,若表面可及性指数≥1,可塑性指数≥1,抗原性指数≥1.031,亲水性指数≥1.895,氨基酸序列位于无规则卷曲区域内,且区段氨基酸个数≥7,则这一段区域具有成为SjMBLAC1蛋白优势B细胞抗原表位的潜力[10]。按照以上思路,本研究共筛选到9个优势B细胞抗原表位,相应抗原表位的氨基酸序列见表2。
表2 SjMBLAC1蛋白B细胞抗原表位的氨基酸序列
Tab.2 Amino acid sequence of B cell antigenic epitope of SjMBLAC1 protein
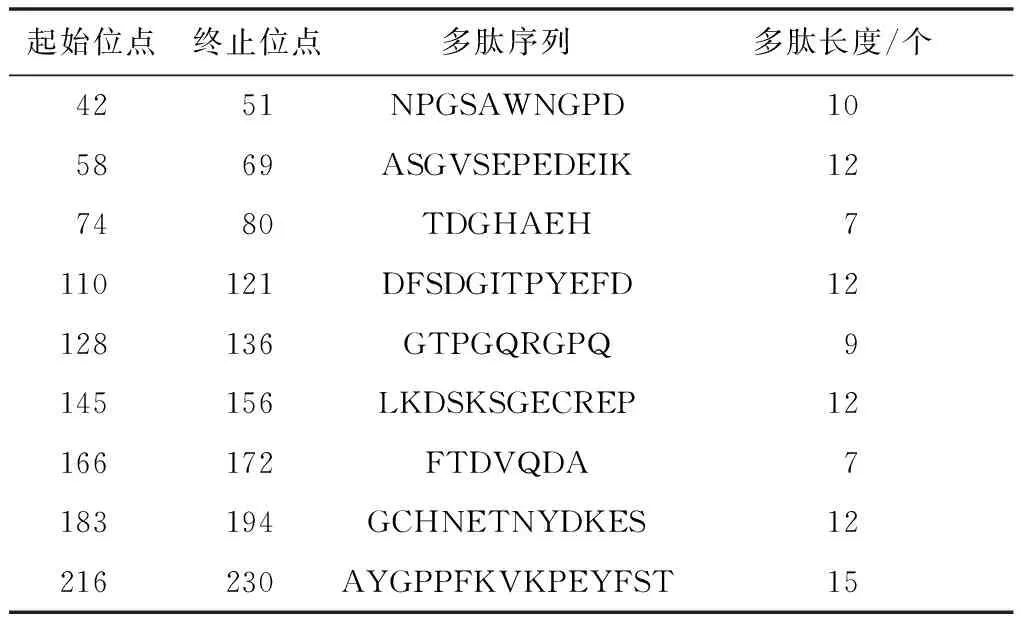
起始位点终止位点多肽序列多肽长度/个4251NPGSAWNGPD105869ASGVSEPEDEIK127480TDGHAEH7110121DFSDGITPYEFD12128136GTPGQRGPQ9145156LKDSKSGECREP12166172FTDVQDA7183194GCHNETNYDKES12216230AYGPPFKVKPEYFST15
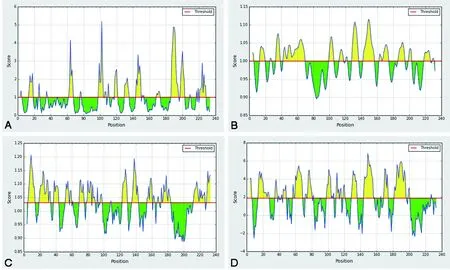
A:Emini表面可及性预测;B:Karplus & Schulz可塑性预测;C:Kolaskar & Tongaonkar抗原性预测;D:Parker亲水性预测;图7 IEDB预测SjMBLAC1蛋白的B细胞抗原表位Fig.7 B cell antigenic epitope of SjMBLAC1 protein predicted by IEDB
3 讨 论
血吸虫能够在终末宿主体内存活几十年而不被其免疫系统所清除,虫体不仅能够逃避宿主免疫攻击和摄取宿主营养物质,甚至能够利用宿主的内分泌及免疫信号分子,在这些过程中,体被(尤其是其蛋白)起到了极其关键的作用[11-12]。例如,体被蛋白丝氨酸蛋白酶抑制剂(Serpin)能够通过干扰宿主的免疫应答反应而对维持虫体的生存起着重要作用[13]。血吸虫自身无法合成脂肪酸,定位于体被上的CD36-like class B清道夫受体能够帮助虫体利用宿主的脂类物质,从而维持虫体在终末宿主体内的生长发育[14]。因此,通过对体被蛋白的研究有可能发现新的抗血吸虫病疫苗候选抗原分子及药物靶标,从而为该病的防治提供新思路。
在前期日本血吸虫体被免疫蛋白质组学研究的基础上,本研究以金属β内酰胺酶结构域蛋白1(MBLAC1,ID:FN319125.1)为对象进行了初步研究。在本实验中,成功提取了日本血吸虫成虫总RNA,经反转录获得成虫cDNA,并以其为模板首次克隆获得SjMBLAC1的PCR扩增产物。测序结果分析表明,SjMBLAC1扩增片段大小为711 bp(含终止密码子),基因序列与预期目的片段大小相符且无核苷酸突变。该基因编码236个氨基酸,预测蛋白质分子量约为26 kDa,理论等电点为4.84。利用生物信息学技术对SjMBLAC1蛋白序列的结构域、糖基化位点和B细胞抗原表位等方面进行了分析,从而有助于了解SjMBLAC1蛋白的生物学特性。
结构域是蛋白质中具有特异空间结构和独立功能的区域,能够决定蛋白质发挥关键的生物学效用。在同一蛋白家族中,所有蛋白质中都具有不变或相同的结构域,为该家族蛋白质功能的承担者,不能被改变,称其为保守结构域。SjMBLAC1氨基酸序列的保守结构域属于MBL超级家族。在该家族中,除了包括能够水解β-内酰胺类抗生素的金属β-内酰胺酶以外,还有多个成员,例如,乙二醛酶II能够水解2-D-丙醇酰谷胱甘肽而生成谷胱甘肽,后者具有抗氧化作用,从而维持免疫系统的正常功能[15]。磷酸二酯酶可以通过水解核苷酸(尤其是ATP和腺苷)来影响血小板聚集,细胞凋亡,细胞增殖、分化、运动等多种生理过程[16]。因此,我们推测SjMBLAC1可能参与维持抗氧化系统来抵抗活性氧对虫体造成的损伤性,或者是通过调节ATP的分解而参与到虫体的能量代谢过程,从而完成血吸虫的正常生长发育。
糖基化是一种普遍存在的蛋白质翻译后修饰,能够影响蛋白质折叠的正确性及构想的稳定性,从而参与到信号转导、免疫应答、受体激活等多种重要的生命活动中。由于与细胞外环境能够发生直接接触,膜蛋白与分泌蛋白常常被作为疫苗、诊断及治疗靶标而研究[17]。研究表明,这两类蛋白易发生N-连接糖基化。经本研究分析发现,SjMBLAC1的第186位氨基酸发生了N-糖基化,而且被我们前期围绕日本血吸虫体被展开的免疫蛋白质组学研究鉴定到,我们推测其很可能是定位于血吸虫体被上的糖蛋白,进一步说明可以将其作为抗血吸虫病疫苗候选抗原分子进行探讨。
抗原分子表面能够被B细胞表面受体或抗体特异性识别并结合的化学基团,称为B细胞抗原表位,一般由5~15个氨基酸残基组成[18]。作为抗原的核心组分,B细胞抗原表位是引起机体体液免疫的物质基础,因此,一直以来,其都是研究人员探索疾病免疫预防的重点。若能准确地预测B细胞抗原表位,将不仅有助于基础免疫学的研究,而且能促进疫苗及抗体的开发,最终促进实现对疾病的防控[19]。目前,蛋白质B细胞抗原表位的单一参数预测方法主要包括表面可及性、可塑性、抗原性、亲水性、二级结构等多种方案,通过综合考虑以上分析结果,可以提高抗原表位预测的准确性。在本研究分析SjMBLAC1蛋白的B细胞抗原表位时,利用GOR4预测了该蛋白的二级结构,又结合Emini表面可及性方案、Karplus-Schulz可塑性方案、Kolaskar-Tongaonkar抗原性方案及Parker亲水性方案等多种方法综合分析,我们推测该蛋白具有9个较优的B细胞抗原表位,分别为42-51、58-69、74-80、110-121、128-136、145-156、166-172、183-194、216-230位氨基酸。
综上所述,本研究利用生物信息学技术对SjMBLAC1蛋白的生物学特性进行了较为全面的了解,并推测该蛋白具有9个较优的B细胞抗原表位,从而为开展该蛋白的生物学功能研究及筛选抗血吸虫病疫苗候选分子提供了基础。
参考文献:
[1] McManus DP, Gray DJ, Ross AG, et al. Schistosomiasis research in the dongting lake region and its impact on local and national treatment and control in China[J]. PLoS Negl Trop Dis, 2011, 5(8): e1053. DOI: 10.1371/journal.pntd.0001053
[2] 张利娟,徐志敏,钱颖骏,等. 2015年全国血吸虫病疫情通报[J].中国血吸虫病防治杂志, 2016, 28(6): 611-617.DOI: 10.16250/j.32.1374.2016246
[3] Ismail M, Metwally A, Farghaly A, et al. Characterization of isolates ofSchistosomamansonifrom Egyptian villagers that tolerate high doses of praziquantel[J]. Am J Trop Med Hyg, 1996, 55(2): 214-218. DOI: 10.4269/ajtmh.1996.55.214
[4] Stelma FF, Talla I, Sow S, et al. Efficacy and side effects of praziquantel in an epidemic focus ofSchistosomamansoni[J]. Am J Trop Med Hyg, 1995, 53(2): 167-170. DOI: 10.4269/ajtmh.1995.53.167
[5] Pearce EJ. Progress towards a vaccine for schistosomiasis[J]. Acta Trop, 2003, 86(2/3): 309-313. DOI: 10.1016/S0001-706X(03)00062-7
[6] Jones MK, Gobert GN, Zhang L, et al. The cytoskeleton and motor proteins of human schistosomes and their roles in surface maintenance and host-parasite interactions[J]. Bioessays, 2004, 26(7): 752-765. DOI: 10.1002/bies.20058
[7] van Balkom BW, van Gestel RA, Brouwers JF, et al. Mass spectrometric analysis of theSchistosomamansonitegumental sub-proteome[J]. J Proteome Res, 2005, 4(3): 958-966. DOI: 10.1021/pr050036w
[8] Zhang M, Fu Z, Li C, et al. Screening diagnostic candidates for schistosomiasis from tegument proteins of adultSchistosomajaponicumusing an immunoproteomic approach[J]. PLoS Negl Trop Dis, 2015, 9(2): e0003454. DOI: 10.1371/journal.pntd.0003454
[9] 陈照强,刘一方,朱宁,等.金属β-内酰胺酶的研究进展[J].国外医药抗生素分册, 2011, 32(3): 111-115.
[10] 吕晴,单思,王丽君,等.猪附红细胞体ORF5蛋白的空间结构与B细胞抗原表位预测[J].中国人兽共患病学报,2015,31(3): 251-254. DOI: 10.3969/j.issn.1002-2694.2015.03.014
[11] Fonseca CT, Braz Figueiredo Carvalho G, Carvalho Alves C, et al.Schistosomategument proteins in vaccine and diagnosis development: an update[J]. J Parasitol Res, 2012, 2012(3): 541268. DOI: 10.1155/2012/541268
[12] Han ZG, Brindley PJ, Wang SY, et al.Schistosomagenomics: new perspectives on schistosome biology and host-parasite interaction[J]. Annu Rev Genomics Hum Genet, 2009, 10(10): 211-240. DOI: 10.1146/annurev-genom-082908-150036
[13] Molehin AJ, Gobert GN, McManus DP. Serine protease inhibitors of parasitic helminths[J]. Parasitology, 2012, 139(6): 681-695. DOI: 10.1017/S0031182011002435
[14] Dinguirard N, Yoshino TP. Potential role of a CD36-like class B scavenger receptor in the binding of modified low-density lipoprotein (acLDL) to the tegumental surface ofSchistosomamansoni sporocysts[J]. Mol Biochem Parasitol, 2006, 146(2): 219-230. DOI: 10.1016/j.molbiopara.2005.12.010
[15] Wenzel NF, Carenbauer AL, Pfiester MP, et al. The binding of iron and zinc to glyoxalase II occurs exclusively as di-metal centers and is unique within the metallo-β-lactamase family[J]. J Biol Inorg Chem, 2004, 9(4): 429. DOI: 10.1007/s00775-004-0535-2
[16] Zhang M, Han Y, Zhu Z, et al. Cloning, expression, and characterization ofSchistosomajaponicumtegument protein phosphodiesterase-5[J]. Parasitol Res, 2012, 110(2): 775-786. DOI: 10.1007/s00436-011-2552-8
[17] 王家红,童玥,朱玥,等.蛋白质糖基化的研究进展[J].药物生物技术, 2011, 18(1): 77-80.
[18] 马凡舒,张蕾,王洋,等. B细胞抗原表位预测方法的研究进展[J].中国畜牧兽医, 2016, 43(1): 63-67.
[19] 梁瑾,王靖飞.B细胞表位预测方法研究进展[J].生命科学, 2009, 21(2): 320-323.
