IL-33敲除促进弓形虫感染小鼠腹腔巨噬细胞的M1偏移
2018-05-18,,,,,,
, ,, ,,,
弓形虫是一种专性的细胞内寄生原虫,可以感染几乎所有的温血动物,呈全球性分布。弓形虫感染可导致人和其它哺乳动物流产,是人先天致畸的重要病原体,也是引起免疫缺陷疾病如AIDS和长期使用免疫抑制剂病人死亡的重要原因[1-2]。
白介素-33(interleukin-33, IL-33)是2005年作为磺基转移酶同源体(homolog of sulfotransferase, ST2)的配体被发现的一个新的IL-1家族成员。ST2选择性地在Th2细胞上表达,Th1则不表达,IL-33与ST2结合,通过下游信号分子髓样分化因子88(MyD88),IL-1相关蛋白激酶(IRAK)和肿瘤坏死因子受体相关因子 6(TRAF6),使NF-κB 和MAPK活化,从而调节基因的转录,促进Th2细胞因子IL-4、IL-5和IL-13的产生及发挥后续的生物学功能[3],故IL-33可增强Th2免疫反应。同时,IL-33也是Th2细胞的趋化因子,促使Th2细胞在淋巴结和组织中募集,通过促进Th2免疫反应、趋化嗜酸粒细胞、改变Mφ 的极化趋势,在多种炎症性疾病中发挥作用,如感染性疾病、过敏性疾病、自身免疫性疾病等[3-6]。
巨噬细胞(macrophage, Mφ)是一种多分化来源的细胞,具有复杂的异质性与功能的多样性,在不同的微环境及不同的因子作用下可被激活成不同的表型,根据极化后细胞表面标志性分子及功能的不同,Mφ大体可分为经典激活的Mφ(Ml型)和替代激活的Mφ(M2型)。M1型细胞以CD68+、CD86+、MHCⅡ+为表型特征,表达诱导型一氧化氮合成酶(iNOS),IL-12及膜蛋白CD16/32;通过产生iNOS分解L-精氨酸产生NO及反应性氧中间物(ROI),促进炎症反应以及清除入侵微生物;高效递呈抗原、高水平合成促炎细胞因子,是激活Thl细胞反应的效应细胞,具有抗病原微生物和肿瘤细胞的作用[7-9]。而M2型细胞则通过表达I型精氨酸酶(Arginase1,Arg1)分解L-精氨酸产生L-鸟氨酸,L-鸟氨酸是脯氨酸前体,能促进胶原合成,促进损伤部位的修复;低表达IL-12,高表达IL-10、Arg1、甘露糖受体(CD206)、YM-1(几丁质酶家族成员)等;抗原递呈功能弱,通过抑制Thl免疫反应,诱导Th2细胞,抑制急性炎症反应、参与慢性炎症、肿瘤转移、超敏反应、创伤愈合等的发生和发展、促进损伤组织修复、重构和血管生长功能。iNOs和Arg1两者竞争性地结合L-精氨酸,并通过代谢产物发挥促炎或抗炎的相反作用[10-14]。
近期的研究表明,IL-33可促进Mφ 向M2方向极化,在Mφ 的极化中发挥重要作用。在IL-33诱导的气道炎症中,IL-33促进静止状态的肺泡巨噬细胞(AMs)向M2方向极化,表达CD206,IL-4Rα,产生高水平的CCL24和CCL17,去除AMs会减轻气道炎症反应。体外实验也显示,IL-13/IL-4Rα 信号通路在IL-33驱使AMs向M2a方向极化中起关键作用,IL-33放大了IL-13诱导的肺泡及骨髓来源的Mφ 向M2a方向极化,增加Arg-1,YM-1及CCL24和CCL17的表达。在先天性及抗原诱导性的气道反应性炎症中,IL-33/ST2在AMs向M2a极化中起重要作用[13]。Yang Z等的研究也证实IL-33诱导AMs主要是通过AAM自分泌IL-13激活IL-4Rα-STAT6途径,Mφ 作为IL-25/IL-33的效应细胞在Th2型免疫反应中起重要作用。去除小鼠Mφ 会减弱IL-25/IL-33诱导的2型免疫反应[15]。Besnard A-G等在研究小鼠实验性脑型疟疾(ECM)时也证实:IL-33通过促进Th2型的先天性淋巴细胞(ILC2)产生2型的细胞因子,如IL-4,IL-5,IL-13,从而驱使Mφ 向M2型极化,而M2型细胞再影响Tregs,最终抑制Th1免疫反应,减少IFN-γ,IL-12 和TNF-α 的分泌,抑制ECM的进一步发展[16]。最新研究也显示IL-33在柯萨奇病毒引起的心肌炎[5]和三硝基苯磺酸诱导的肠炎[6]中通过诱导Mφ 向M2方向极化从而减轻炎症发展。
综上所述,可见IL-33在Mφ 的极化中起重要作用,关于其在弓形虫感染Mφ 中的免疫作用还未见报道。因此本课题通过观察IL-33-/-小鼠PMφ 弓形虫感染后的极化趋势,进一步探讨IL-33在弓形虫感染免疫应答中的作用。
1 材料与方法
1.1虫株 ZS株刚地弓形虫(人源),基因型为ToxoDB#9 (Chinese 1),由本室传代保种。
1.2实验动物 SPF级雌性C57BL/6 WT和IL-33-/-小鼠各48只,鼠龄12~14周,体重22~25 g,昆明鼠30只。C57BL/6 WT小鼠购自上海斯莱克实验动物有限责任公司[许可证号码:SCXK(沪)2012-0002,合格证编号:20150 00509916,2015000518671],C57BL/6 IL-33-/-小鼠由福建中医药大学林炜教授提供,和昆明鼠小鼠一起饲养于福建医科大学实验动物中心(实验动物使用许可证号:SYXK(闽)2012-0001,适用范围:SPF 级鼠类),动物房SPF层流柜中,鼠笼、鼠料、垫料、饮水经过高压消毒灭菌,每周垫料更换两次,动物使用协议由动物审查委员会批准。
1.3试剂及仪器 吉姆萨染液(北京中杉金桥生物有限公司);引物(上海生工);PerCP-Cy5.5 anti-mouse CD80,PE anti-Mouse TLR4,PE-anti-Mouse MHCⅡ,FITC-anti-mouse CD14,FITC-anti-mouse TLR2,Rat IgG2b,κIsotype Ctrl PE/ Rat IgG2a,κIsotype Ctrl APC(美国eBiosciences);APC anti-mouse CD206,Rat IgG2b,κIsotype Ctrl PE,APC anti-mouse CD86(美国Biolegend);RPMI 1640 培养液(美国Hyclone);胎牛血清(美国Gibco);Mouse IL-10,IL-12,TNF-α ELISA kit (杭州联科生物);Griess Reagent System (美国Promega);RevertAidTMFirst Strand cDNA Synthesis Kit(美国 Fermentas);SYBR Green Master(美国Roche);温度梯度PCR仪(德国Eppendorf公司);台式高速冷冻离心机Neofuge 15R(香港Heal Force Development Ltd);酶标仪Multiscan FC、CO2培养箱Thermo Forma 3111型(美国Thermo Fisher);Mx3005p实时荧光定量PCR仪ND2000C(美国StrataGene);流式细胞仪(美国BD公司);超净台(苏州苏净安泰);超低温冰箱(英国NBS)。
1.4 方法
1.4.1小鼠基因型鉴定 采用Keisuke Oboki[17]设计的引物,由上海生物工程公司合成(表1),提取小鼠鼠尾 DNA,PCR鉴定小鼠基因型。
1.4.2小鼠pMφ弓形虫感染率测定 参照文献[18]收集12~14周左右的 C57BL/6 WT 及 IL-33-/-小鼠 pMφ,每组6只,调整细胞浓度至1×106个/mL,以0.5 mL/孔接种于放了爬片的24孔细胞培养板中,放入37 ℃,5% CO2培养箱培养2 h,去除未贴壁的细胞,加入新鲜的0.5 mL 培养液继续培养24 h;加入0.5 mL 培养液稀释的2.5×106个/mL弓形虫速殖子(液氮复苏后传3代以上),轻轻混匀后,继续培养30 min;弃培养上清液,加入 PBS 洗涤1次,冷风吹干,加入0.5 mL 的甲醇固定3 min,吸弃残余的甲醇溶液,加入姬姆萨染液0.5 mL 染色30 min,用蒸馏水洗涤2次,吹干爬片,用中性树脂固定于载玻片上,高倍镜下观察,计数200个细胞的感染率。
表1 C57B/L WT及IL-33-/-小鼠基因型鉴定引物
Tab.1 Primer sequences for genotyping
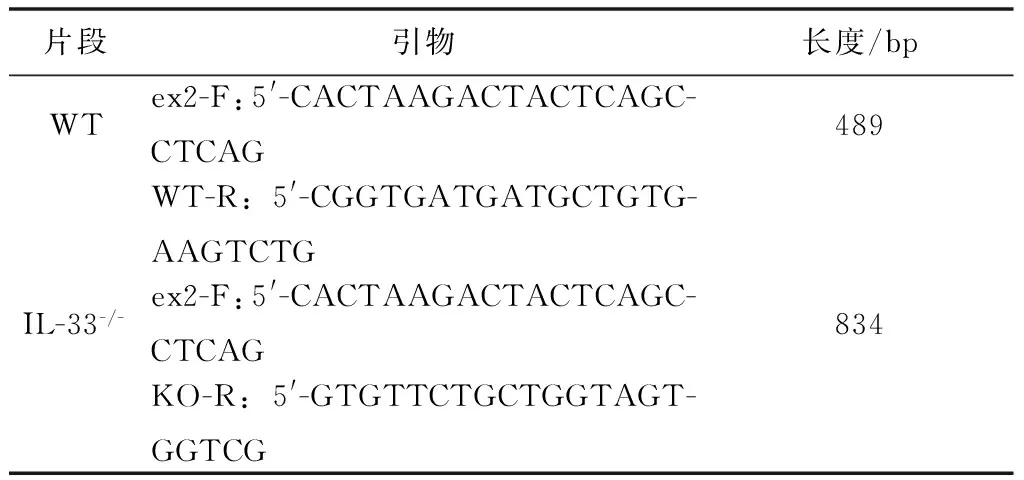
片段引物长度/bpWTex2-F:5'-CACTAAGACTACTCAGC-CTCAG489WT-R:5'-CGGTGATGATGCTGTG-AAGTCTGIL-33-/-ex2-F:5'-CACTAAGACTACTCAGC-CTCAG834KO-R:5'-GTGTTCTGCTGGTAGT-GGTCG

1.4.3实验分组及细胞培养和弓形虫感染方法 实验分4组,分别为 IL-33-/-小鼠 pMφ 弓形虫感染组和未感染组,WT 小鼠 pMφ 弓形虫感染组和未感染组。收集 WT 和IL-33-/-小鼠 pMφ,每组各6只,按5×105细胞/孔,复孔接种到24孔细胞培养板,置37 ℃,5% CO2培养箱培养2 h;洗去未贴壁细胞,加入0.5 mL新鲜的培养液继续培养24 h;取复孔中的一孔为感染孔,加入弓形虫速殖子1.2×105个/mL,0.5 mL/孔;另一孔为未感染孔加入0.5 mL 培养液,继续培养24 h;吸取培养上清液离心分装冻存于-70 ℃用于NO、TNF-α、IL-10、IL-12 的检测;收集细胞进行 Real-time PCR 和流式检测。
1.4.4Real-time PCR检测弓形虫感染前后pMφ iNOS、Arg-1、IL-1、IL-10、IL-12 mRNA的表达 取感染24 h后收集的各组细胞,经Trizol 裂解、提取RNA、OD260/280测定其浓度和纯度;按逆转录试剂盒逆转录为 cDNA,采用20 μL 反应体系;按FastStart Universal SYBR Green Master(ROX)说明书进行Real-time PCR 扩增,以β-actin作为内参检测 iNOS、Arg-1、IL-1、IL-4、IL-10、IL-12 mRNA相对表达量,引物见表2;PCR扩增条件为50 ℃ 2 min→95 ℃ 预变性10 min→(95 ℃变性15 s,60℃退火1 min→40个循环体系)→95 ℃ 15 s →60 ℃ 1 min→95 ℃ 15 s。反应结束后,用△Ct法进行计算:△Ct=Ct目的基因-Ct参照基因,△△Ct= (Ct目的基因-Ct参照基因)实验组-(Ct目的基因-Ct参照基因)对照组,2-△△Ct的意义即实验组目的基因相对于对照组目的基因表达量变化倍数,野生型小鼠未感染组为对照组。
表2 Real-time PCR 引物表
Tab.2 Primer sequences for real-time PCR
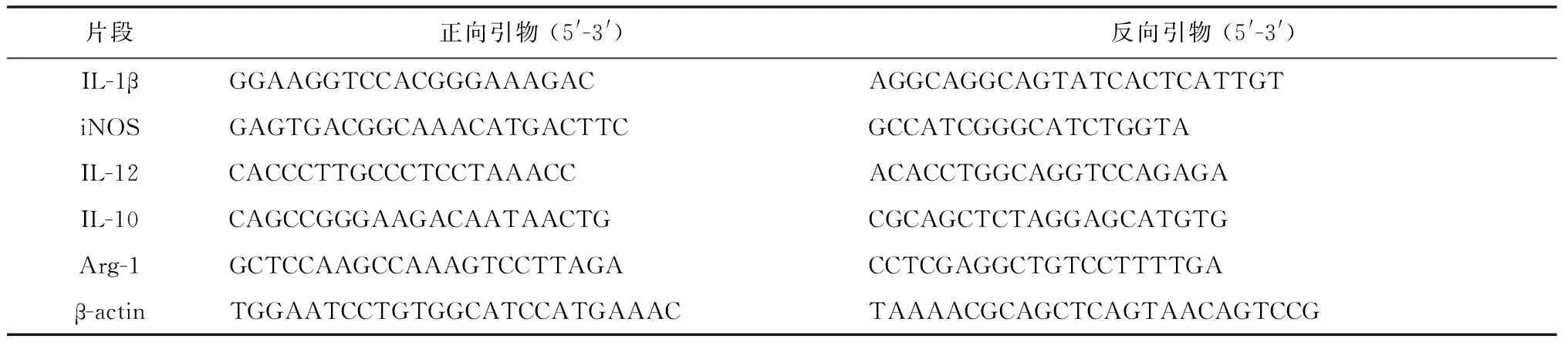
片段正向引物(5'-3')反向引物(5'-3')IL-1βGGAAGGTCCACGGGAAAGACAGGCAGGCAGTATCACTCATTGTiNOSGAGTGACGGCAAACATGACTTCGCCATCGGGCATCTGGTAIL-12CACCCTTGCCCTCCTAAACCACACCTGGCAGGTCCAGAGAIL-10CAGCCGGGAAGACAATAACTGCGCAGCTCTAGGAGCATGTGArg-1GCTCCAAGCCAAAGTCCTTAGACCTCGAGGCTGTCCTTTTGAβ-actinTGGAATCCTGTGGCATCCATGAAACTAAAACGCAGCTCAGTAACAGTCCG
注:iNOS:诱导型一氧化氮合成酶;Arg-1:1型精氨酸酶。
1.4.5酶联免疫吸附试验(ELISA)检测各组pMφ 弓形虫感染后TNF-α、IL-10、IL-12的分泌水平 采用双抗体夹心酶联免疫吸附检测技术,按ELISA试剂盒说明书进行操作。
1.4.6Griess方法检测弓形虫感染前后各组pMφ NO的分泌水平 按试剂盒说明书进行操作。
1.4.7流式细胞术检测弓形虫感染前后各组 pMφ 表面分子(CD80、CD86、CD206、TLR4、TLR2、MHCⅡ)的表达水平 胰酶消化收集各组细胞,洗涤后,加入含封闭抗体(CD16/32)的细胞洗液80 μL,混匀,冰浴10 min;加入各管相应的 Ab(CD80/CD206/TLR4;CD86/MHCⅡ/TLR2)20 μL,漩涡混匀,4 ℃,避光35 min;加入含1%多聚甲醛的 PBS 固定液0.5 mL,上流式细胞仪检测。
2 结 果
2.1小鼠基因型的鉴定 以PCR鉴定本实验用小鼠为C57BL/6 WT 和IL-33-/-小鼠。
2.2小鼠pMφ 纯度鉴定 FITC-CD14染色检测纯度为95%左右(图1)。
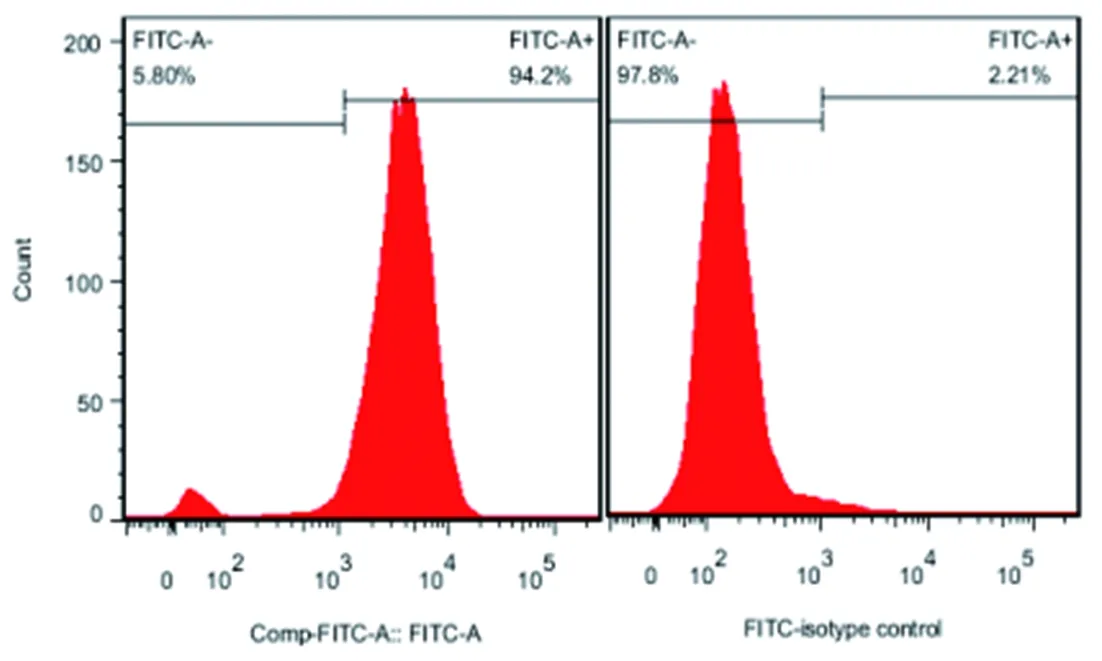
图1 小鼠pMφ鉴定(左)及同型对照(右)Fig.1 Identification of pMφ
2.3小鼠pMφ 感染率比较 C57BL/6 WT和IL-33-/-小鼠pMφ 感染弓形虫速殖子30 min后,IL-33-/-小鼠pMφ 感染率低于WT小鼠(数值分别为0.95±0.01及0.98±0.01,t=-2.49,P<0.05),提示IL-33-/-小鼠pMφ 抗弓形虫感染能力增强。
2.4IL-33-/-和弓形虫感染对小鼠pMφ M1型标志物表达的影响
2.4.1IL-33-/-对pMφ M1型标志物表达的影响 IL-33-/-感染组pMφ 上清液中NO的浓度(F=29.71,P<0.05)及细胞表面MHCⅡ(F=19.05,P<0.05)、TLR4(F=8.34,P<0.05)阳性百分率高于WT感染组,提示IL-33-/-促进弓形虫感染的小鼠pMφ 分泌NO,表达MHCⅡ和TLR4分子;而TLR2阳性百分率表达则相反(F=14.88,P<0.01),提示IL-33-/-抑制了pMφ TLR2的表达;IL-33-/-小鼠感染组pMφ iNOS(F=0.96,P<0.01)、IL-1(F=0.83,P<0.01)、IL-12 mRNA(F=1.32,P<0.01)的表达,TNF-α 的分泌(F=0.98,P>0.05)及表面分子CD80(F=0.23,P>0.05)、CD86的表达(F=0.02,P>0.05)与WT小鼠感染组比较均无统计学差异,见表3。
2.4.2弓形虫感染对小鼠pMφ M1型标志物表达的影响 IL-33-/-和WT小鼠感染组pMφ TNF-α(F=11.56,P>0.05)、NO分泌水平(F=16.68,P>0.05)及CD86(F=13.43,P>0.05)、TLR4(F=57.57,P>0.05)、MHCⅡ(F=34.34,P>0.05)表面分子的表达均高于各自未感染对照组,提示感染促进了IL-33-/-和WT小鼠pMφ 上述炎性介质及表面分子的表达;弓形虫感染对IL-33-/-和WT小鼠pMφ iNOS(F=0.69,P>0.05)、IL-1(F=0.02,P>0.05)、IL-12 mRNA(F=2.46,P>0.05)表达及表面分子CD80(F=1.87,P>0.05)、TLR2(F=3.33,P>0.05)表达的比较均无统计学差异,见表3。
表3 pMφ M1型标志物检测结果比较
Tab.3 Expression of pMφ M1 marks
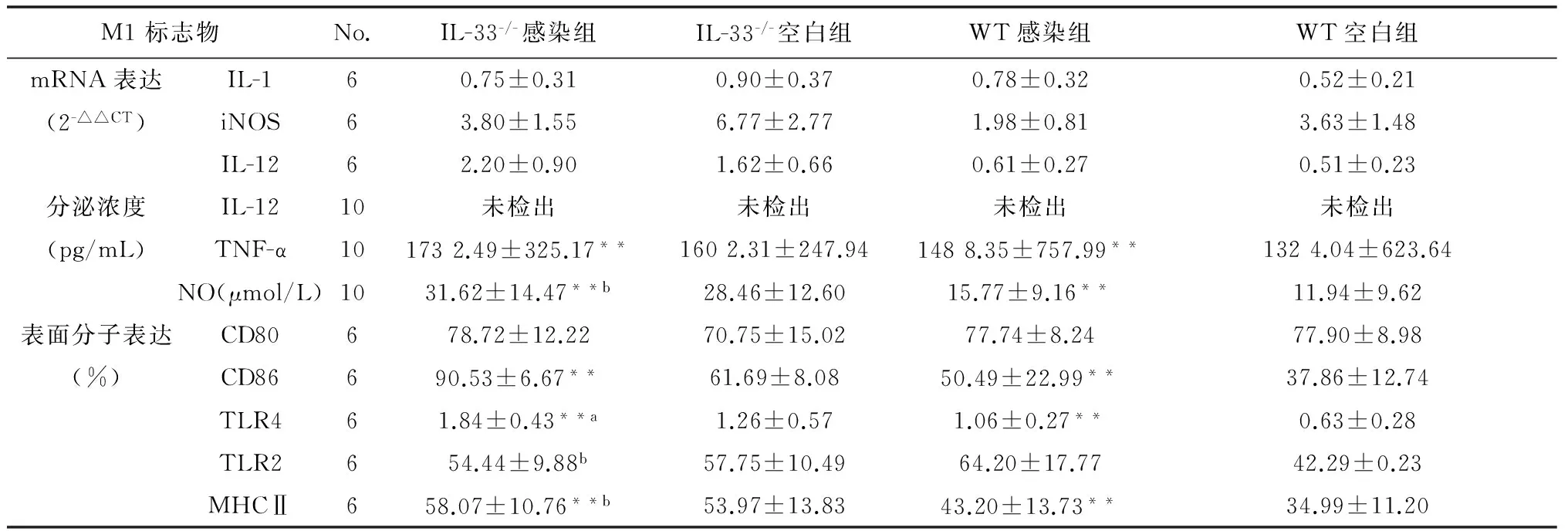
M1标志物No.IL-33-/-感染组IL-33-/-空白组WT感染组WT空白组mRNA表达IL-160.75±0.310.90±0.370.78±0.320.52±0.21(2-△△CT)iNOS63.80±1.556.77±2.771.98±0.813.63±1.48IL-1262.20±0.901.62±0.660.61±0.270.51±0.23分泌浓度IL-1210未检出未检出未检出未检出(pg/mL)TNF-α101732.49±325.17**1602.31±247.941488.35±757.99**1324.04±623.64NO(μmol/L)1031.62±14.47**b28.46±12.6015.77±9.16**11.94±9.62表面分子表达CD80678.72±12.2270.75±15.0277.74±8.2477.90±8.98(%)CD86690.53±6.67**61.69±8.0850.49±22.99**37.86±12.74TLR461.84±0.43**a1.26±0.571.06±0.27**0.63±0.28TLR2654.44±9.88b57.75±10.4964.20±17.7742.29±0.23MHCⅡ658.07±10.76**b53.97±13.8343.20±13.73**34.99±11.20
注:与各自未感染对照组比较,*P<0.05,**P<0.01;与WT感染组比较,aP<0.05,bP<0.01。
2.4.3IL-33-/-和弓形虫感染双因素对小鼠pMφ M1型标志物表达的影响 IL-33-/-和感染双因素对小鼠pMφ MHCⅡ分的表达有交互促进作用(F=5.25,P<0.05,图2),而对TLR2的表达则是明显的交互抑制作用(F=14.88,P<0.01,图3),提示IL-33-/-促进弓形虫感染的小鼠pMφ 表达MHCⅡ分子,而抑制TLR2的表达。 IL-33-/-和感染双因素对IL-33-/-小鼠与WT小鼠间iNOS、IL-1、IL-12mRNA、TNF-α、NO、CD80、CD86、TLR4的表达无交互影响。
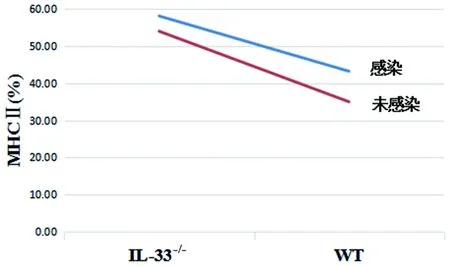
图2 IL-33敲除与感染对小鼠 pMφ MHCⅡ表达的交互作用Fig.2 Interaction of IL-33 knockout and infection on the expression of MHCⅡon pMφ
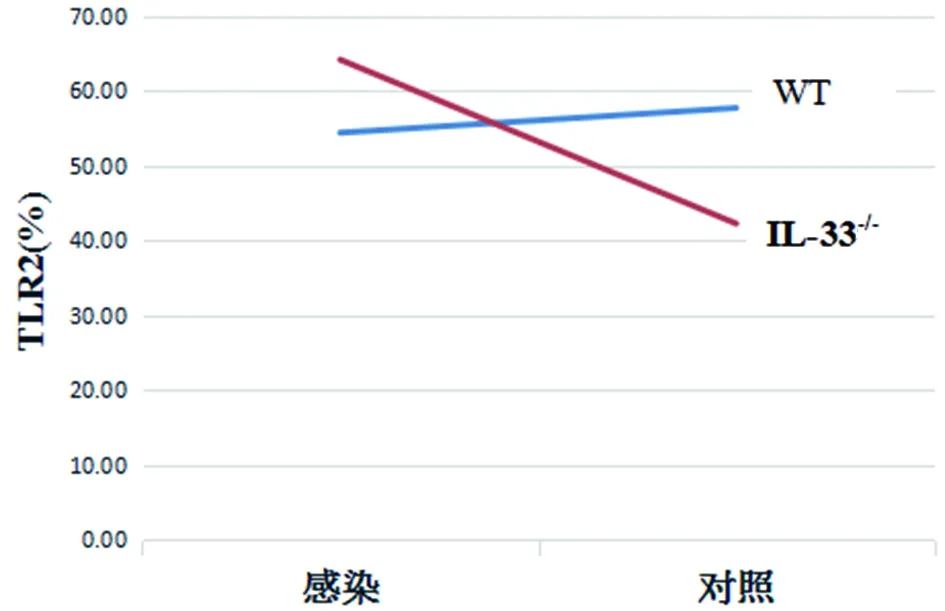
图3 IL-33敲除与感染对小鼠 pMφ TLR2表达的交互作用Fig.3 Interaction of IL-33 knockout and infection on the expression of TLR2 on pMφ
2.5IL-33-/-和弓形虫感染对小鼠pMφ M2型标志物表达的影响 与WT感染组比较,IL-33-/-感染组小鼠pMφ CD206的表达降低(t=-3.34,P<0.01);而弓形虫感染促进了WT和IL-33-/-小鼠pMφ IL-10的分泌(F=6.18,P<0.05);IL-33-/-和感染双因素对小鼠pMφ Arg-1、IL-10 mRNA、CD206、IL-10的表达无交互作用,见表4。
表4 pMφ M2型标志物检测结果比较
Tab.4 Expression of pMφ M2 marks

M2标志物No.IL-33-/-感染组IL-33-/-空白组WT感染组WT空白组IL-10(2-△△CT)61.45±0.592.09±0.852.34±0.951.44±0.596Arg-1(2-△△CT)60.64±0.261.10±0.450.82±0.330.45±0.18IL-10(pg/mL)106229.70±3673.16*5811.18±3484.134637.62±1645.85*4395.06±1469.16CD206(%)612.00±3.88**12.03±2.9614.96±2.5617.38±6.41
注:与各自未感染对照组比较,*P<0.05;与WT感染组比较,**P<0.01(独立样本t检验)。
3 讨 论
弓形虫感染pMφ 后,会劫持宿主细胞器进行繁殖[19],最终导致大量宿主细胞裂解破碎。本实验弓形虫感染pMφ 30 min后IL-33-/-小鼠pMφ 胞内速殖子的数量少于WT小鼠,提示IL-33-/-小鼠pMφ 与WT小鼠比较,抗弓形虫感染的能力增强。因此,本研究于弓形虫感染小鼠pMφ 24 h后同时检测pMφ mRNA的表达水平、细胞培养液中细胞因子和炎性介质的分泌水平、细胞表面标志性分子的表达水平,以达到比较客观的观察在IL-33-/-与弓形虫感染双因素作用下小鼠pMφ 的变化。IL-33-/-小鼠感染组细胞培养液中NO明显升高(F=16.68,P<0.01),提示感染早期IL-33-/-促进pMφ 生成NO,后者可与Mφ 氧化酶所产生的过氧化氢或过氧化物结合,产生杀伤微生物的过亚硝酸盐基[18,20]。弓形虫感染明显促进了感染组小鼠pMφ NO及TNF-α 的分泌,提示弓形虫感染增强了小鼠pMφ 的抗炎活性。而Real-time PCR检测弓形虫感染后小鼠pMφ iNOS、Arg-1、IL-1、IL-10、IL-12 mRNA表达水平显示,IL-33-/-和感染对各个指标mRNA表达水平变化无统计学意义,结合细胞培养液中NO和IL-10含量明显升高的变化,可能与检测的时间点滞后有关系。
弓形虫蛋白会抑制 γ-干扰素激活的Mφ 表达MHCⅡ类分子[21-22],而在本次研究中却观察到感染组小鼠pMφ 表面MHCⅡ类分子表达明显高于未感染对照组,分析结果显示:IL-33-/-小鼠pMφ弓形虫感染后MHCⅡ类分子的表达高于WT型感染组。同时,感染组小鼠pMφ CD86分子也明显高于未感染对照组。MHCⅡ类分子为激活CD4+T细胞提供第一信号,而CD86是CD28的配体,提供T细胞激活的共刺激信号。感染组小鼠pMφ 表面MHCⅡ类分子和CD86分子表达增高,提示弓形虫感染可能增强了CD4+T细胞激活的双信号,促进 T细胞的生长和分化。由于弓形虫为胞内寄生原虫,细胞免疫在整个抗弓形虫感染过程中发挥了极其重要的作用。CD4+T细胞在抗弓形虫感染中发挥重要的免疫调节作用,而CD8+T细胞发挥细胞杀伤作用[18]。本课题组前期的研究发现急性弓形虫感染时WT小鼠CD4+T细胞/CD8+T细胞比例逐渐降低,随着感染进展CD8+T细胞在数量上比CD4+T细胞占优势。而IL-33-/-小鼠则刚好相反。这一点和文献报道的弓形虫脑炎时NF-κB-/-小鼠脑中CD8+T细胞数量少于野生型小鼠相符[23]。因此IL-33-/-可能通过促进M1巨噬细胞CD86、MHCⅡ类分子的表达促进CD4+T细胞发挥免疫调节作用。
Toll样受体是一类跨膜受体,可识别并结合相应的病原体相关的分子模式(PAMP),在弓形虫感染中主要通过启动TLR/MyD88信号传导途径[24],诱导某些炎症介质(如细胞因子)和某些杀菌分子(如NO等),介导炎性反应并发挥杀寄生虫作用[25-26]。弓形虫糖基磷脂酰肌醇类(GPIs)可活化TLR2和TLR4[24]。我们发现感染组小鼠pMφ TLR4表达明显高于对照组,IL-33-/-促进了小鼠pMφ TLR4的表达。但在本次实验中,IL-33-/-小鼠感染组pMφ TLR2的表达明显低于WT感染组。Mun HS等观察到TLR2敲除小鼠口服感染弓形虫无毒株包囊后8 d内全部死亡,而TLR4敲除小鼠及野生型小鼠则全部存活;发现TLR2敲除小鼠 pMφ 感染弓形虫后未能产生NO和 γ-干扰素等抗弓形虫感染的炎性介质[27]。本实验 IL-33-/-小鼠pMφ 感染弓形虫后表面受体TLR2表达降低是否与受体内化有关还有待后续进一步研究。
综上所述,在急性弓形虫感染早期,IL-33-/-小鼠pMφ 高表达MHCⅡ类分子、NO、TLR4、CD86等M1型标志,而M2型标志物CD206表达降低。提示IL-33-/-可能通过调控Mφ 向M1亚群分化,分泌NO等活性介质,表达MHCⅡ类分子、CD86等分子参与抗弓形虫免疫应答。
参考文献:
[1] Tenter AM, Heckeroth AR, Weiss LM.Toxoplasmagondii: from animals to humans[J]. Int J Parasitol, 2000,30(12/13):1217-1258.DOI:10.1016/S0020-7519(00)00124-7
[2] Munoz M, Liesenfeld O, Heimesaat MM. Immunology ofToxoplasmagondii[J]. Immunol Rev, 2011, 240(240): 269-285. DOI: 10.1111/j.1600-065X.2010.00992.x
[3] Schmitz J, Owyang A, Oldham E, et al. IL-33, an interleukin-1-1ike cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J]. Immunity, 2005, 23(5): 479-490. DOI: 10.1016/j.immuni.2005.09.015
[4] Oboki K, Ohno T, Kajiwara N, et al. IL-33 is a crucial amplifier of innate rather than acquired immunity[J]. PNAS, 2010, 107(43): 18581-18586. DOI: 10.1073/pnas.1003059107
[5] Wang C, Dong C, Xiong S. IL-33 enhances macrophage M2 polarization and protects mice from CVB3-induced viral myocarditis[J]. J Mol Cell Cardiol,2016, 103(12): 22-30. DOI: 10.1016/j.yjmcc. 2016.12.010
[6] Tu Lei, Chen Jie, Xu Dandan, et al. IL-33-induced alternatively activated macrophage attenuates the development of TNBS-inducecolitis[J]. Oncotarget,2017, 8(17): 27704-27714. DOI: 10.18632/oncotarget. 15984
[7] 李康,郭强,王翠妮, 等. M1和M2巨噬细胞表型的比较分析[J]. 现代免疫学, 2008, 28(3): 177-183.
[8] 耿华,袁小林.巨噬细胞的研究进展[J].国际免疫学杂志,2013,36(6):450-454.DOI: 10.3760/cma.j.issn.1673-4394.2013.06.009
[9] 周宪宾,姚成芳.巨噬细胞 M1 /M2 极化分型的研究进展[J].中国免疫学杂志, 2012, 28(10): 957-960.
[10] 黄自坤,李俊明. 巨噬细胞极化及其在感染性疾病中的作用[J]. 国际免疫学杂志, 2012, 35(4): 255-281.DOI: 10.3760/cma.j.issn.1673-4394.2012.04.003
[11] Hazlett LD, Mcclellan SA, Barret RP, et al. IL-33 shifts macrophage polarization, promoting resistance againstPseudomonasaeruginosakeratitis [J]. Invest Ophthalmol Vis Sci, 2010, 51(3): 1524-1532. DOI: 10.1167/ivos.09-3983
[12] 吴媛媛,李龙,沈萍萍.巨噬细胞替代激活及调控[J]. 中国细胞生物学报, 2011, 33(2): 197-203.
[13] Kurowska-Stolarska M, Stolarski B, Kewin P, et al. IL-33 amplifies the polarization of alternatively activated macrophages that contribute to airway inflammation[J]. J Immunol, 2009, 183(10): 6469-6477. DOI: 10.404/jimmunol.0901575
[14] Prokop S, Heppener FL, Goebel HH, et al. M2 polarized macrophages and giant cells contribute to myofibrosis in neuromuscular sarcoidosis[J]. Am J Pathol, 2011, 178(3): 1279-1286. DOI: 10.1016/j.ajpath.2010.11.065
[15] Yang Z, Grinchuk V, Urban JF, et al. Macrophages as IL-25/IL-33-responsive cells play an important role in the induction of type2 immunity[J]. PLoS One, 2013, 8(3): e59441-e59452. DOI: 10.1371/journal.pone.0059441
[16] Besnard AG, Guabiraba R, Niedbala W, et al. IL-33-mediated protection against experimental cerebral malaria is Linked to induction of type 2 Innate lymphoid cells, M2 macrophages and regulatory T cells[J]. PLoS Pathog, 2015, 11(2): e1004607-e1004628. DOI: 10.1371/journal.ppat.1004607
[17] Oboki K, Ohno T, Kajiwara N, et al. IL-33 and IL-33 receptors in host defense and diseases[J]. Allergol Int, 2010, 59(2): 143-160. DOI: 10.2332/allergolint.10-RAI-0186
[18] Zhang X, Goncalves R, Mosser DM, et al. The Isolation and characterization of murine macrophages[J]. Curr Protoc Immunol, 2008, Chapter: Unit-14.1. DOI: 10.1002/0471142735.im1401s83
[19] He JJ, Ma J, Li FC, et al. Transcriptional changes of mouse splenocyte organelle components following acute infection withToxoplasmagondii[J]. Exp Parasitol, 2016, 167(8): 7-16. DOI: 10.1016/j.exppara. 2016.04.019
[20] Lang C, Gross U, Lüder CG, et al. Subversion of innate and adaptive immune responses byToxoplasmaGondii[J]. Parasitol Res, 2007, 100(2): 191-203. DOI: 10.1007/s00436-006-0306-9
[21] Leroux LP, Dasanayake D, Rommereim LM, et al. SecretedToxoplasmagondiimolecules interfere with expression of MHC-II in interferon gamma-activated macrophages[J]. Int J Parasitol, 2015, 45(5): 319-332. DOI: 10.1016 /j.ijpara.2015.01.003
[22] Lüder CG, Lang T, Beuerle B, et al. Down-regulation of MHC class II molecules and inability to up-regulate class I molecules in murine macrophages after infection withToxoplasmagondii[J]. Clin Exp Immunol, 1998, 112(2): 308-316. DOI: 10.1046/j.1365-2249.1998.00594.x
[23] Tajie H, Wilson EH, Tait ED, et al. NF-κB1 contributes to T cell-mediated control ofToxoplasmagondiiin the CNS[J]. J Neuroimmunol, 2010, 222(1/2): 19-28. DOI: 10.1016/j.jneuroim.2009.12.009
[24] Debierregrockiego F, Campos MA, Azzouz N, et al. Activation of TLR2 and TLR4 by glycosylphosphatidylinositols derived fromToxoplasmagondii[J]. J Immunol, 2007, 179 (2): 1129-1137. DOI: 10.4049/jimmunol.179.2.1129
[25] Yarovinsky F. Toll-like receptors and their role in host resistance toToxoplasmagondii[J]. Immunol Lett, 2008, 119(1-2): 17-21. DOI: 10.1016/j.imlet.2008.05.007
[26] Egan CE, Sukhumavasi W, Butcher BA, et al. Functional aspects of Toll-like receptor/MyD88 signalling during protozoan infection: focus onToxoplasmagondii[J]. Clin Exp Immunol, 2009, 156(1): 17-24. DOI: 10.1111/j.1365-2249.2009.03876.x
[27] Mun HS, Aosai F, Norose K, et al. TLR2 as an essential molecule for protecting againstToxoplasmagondiiinfection[J]. Int Immunol, 2003, 15(9): 1081-1087. DOI: 10.1093/intimm/dxg108
