酱油酿造中米曲霉和酱油曲霉复合制曲的研究
2018-05-17李荔童星
李荔,童星
(佛山市海天调味食品股份有限公司,广东 佛山 528000)
制曲是我国酿造工业的一项传统技术,广泛应用于多类传统发酵食品(酱油、酱类、豆豉、腐乳等) 的生产。制曲的实质是创造微生物生长的最适条件促进蛋白酶、淀粉酶、纤维素酶等的分泌从而将原料中的蛋白质、淀粉、纤维素水解产生氨基酸、多肽、葡萄糖等复杂的风味物质。在酱油生产过程中,米曲霉和酱油曲霉是常用的菌株,对酱油生产的原料利用率和酱油的风味起着决定性的作用[1]。我国自1957年全国酱油试点确定选用米曲霉3.863以后, 全国各地纷纷采用米曲霉及其变异株来生产酱油。米曲霉3.042是上海酿造实验工厂对原种AS3.863通过人工诱变得到的1株优良酱油酿造用菌株, 现已在全国普遍使用[2]。日本学者于20世纪30年代从酱曲中分离得到可产生大量碱性蛋白酶和高谷氨酰胺酶特性的酱油曲霉,并受到广泛重视,是日本酱油酿造的主要菌种之一[3,4]。我国因偏重米曲霉的应用,目前对酱油曲霉的关注不多。
近年来,不少学者提出了多菌种应用提高制曲质量的设想。李琴等[5]研究了米曲霉和黑曲霉混合制曲提高酱油酿造原料的利用率和风味。王素珍等[6]通过米曲霉与增香曲的复合应用,提高了酱油的红黄指数和改善了烹饪效果,均取得了一定的进展。目前关于米曲霉和酱油曲霉复合制曲的研究报道较少,本文通过分析米曲霉和酱油曲霉双菌混合制曲对酶系的分泌及发酵指标风味的影响,以期为酱油现代生产技术的提升提供理论基础,解决单一菌株制曲存在的风味不足问题。
1 材料与方法
1.1 材料
AS3.042(Aspergillusoryzae)和HT.AS125(Aspergillussojae)来自保藏菌株;大豆、面粉均为市售:其他试剂均为分析纯。
KDN-04A 定氮仪 上海昕瑞仪器仪表有限公司;722 微机型可见分光光度计 上海精密仪器有限公司;DK-S26电热恒温水浴锅 广东环凯微生物科技有限公司;PB-10 sartorius pH计 德国赛多利斯集团;FA/JA 系列电子天平 上海上平仪器公司;Leu-Gly-Gly 上海西宝生物科技有限公司。
1.2 方法
1.2.1 制曲方法
以重量百分比计,取70%黄豆,1.2 倍润水,用高压蒸汽灭菌锅115 ℃蒸料15 min。熟料快速冷却至37~40 ℃,拌入30%的面粉,按原料重量接入0.15%(m/m)曲霉菌种,拌匀。按照通风制曲培养方式进行培养,温度控制在30~35 ℃,制曲时间42 h。
1.2.2 混合制曲菌种复合方法
将AS3.042和HT.AS125曲种烘干磨碎按照重量比1∶0,6∶1,4∶1,2∶1,1∶1,0∶1进行混合拌料菌种,按照1.2.1的方法进行制曲。
1.2.3 发酵方法
采用高盐稀态发酵法,30 ℃发酵60天,对发酵醪汁过滤取滤液进行分析。
1.2.4 检测方法
1.2.4.1 粗酶液提取
称取5 g成曲,研磨后加入60 mL蒸馏水,40 ℃浸提1 h,每间隔20 min搅拌1次。根据不同酶活测定所需的缓冲液分别定容到合适的浓度,中速定性滤纸过滤即为粗酶液。同时测定曲料水分,酶活力统一用曲料干基重量表示,即U/g。
1.2.4.2 中性蛋白酶活力测定
参照国标GB/T 23527-2009[7],采用福林法测定中性条件下pH值为7.2的蛋白酶活力,酶活定义:在40 ℃每1 min水解酪蛋白产生1 μg酪氨酸所需酶量,定义为1个蛋白酶活力单位。
1.2.4.3 氨肽酶活力测定
以L-亮氨酸-对硝基苯胺为底物,在40 ℃,pH值为8.0条件下,每1 min水解生成1 μg对硝基苯胺所需要的酶量定义为1个酶活力单位[8]。
1.2.4.4 谷氨酰胺酶活力测定[9]
在40 ℃,pH值为7.2的条件下,每1 g酱油曲中的谷氨酰胺酶每1 min催化L-谷氨酰胺分解生成1 μmol L-谷氨酸,即为1个酶活力单位,以U/g表示。
1.2.4.5 α-淀粉酶的测定
采用DNS试剂法[10],以50 ℃,pH 4.8,每1 min水解淀粉生成1 μg葡萄糖为1个酶活力单位(U)。
1.2.4.6 理化指标的检测
全氮测定参照《食品中蛋白质的测定》方法(GB/T 5009.5-2003);氨基酸态氮和总酸采用电位滴定仪方法(GB/T 5009.39-2003);还原糖测定参照《食品中还原糖的测定》方法(GB/T 5009.7-2008)。
1.2.4.7 氨基酸生成率
氨基酸生成率(%)=酱油中氨基酸态氮含量/酱油中全氮含量×100%。
1.2.5 数据整理和分析
所有的试验均进行3次平行取平均值,采用SPSS 11.5和Origin 6.0软件进行统计分析。
2 结果与分析
2.1 AS3.042和HT.AS125酶系的差异
按照上述方法对比分析了AS3.042和HT.AS125单独制曲产酶的差异,结果见图1。
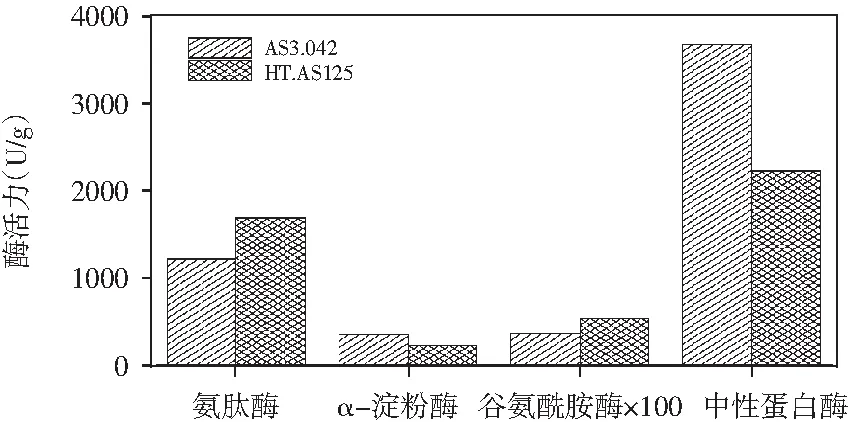
图1 AS3.042和HT.AS125制曲酶系对比
由图1可知,AS3.042的中性蛋白酶和α-淀粉酶活力较高;HT.AS125的谷氨酰胺酶和氨肽酶活力较高,中性蛋白酶低。说明两类菌株的产酶特性存在显著的差异,这与菌株自身的特性有一定的关系。较高的谷氨酰胺酶和氨肽酶活力是HT.AS125菌株的重要特性,这为双菌株的复合制曲提供了可能。
2.2 不同菌种复配比例对制曲质量的影响
AS3.042和HT.AS125按照菌种比例1∶0,6∶1,4∶1,2∶1,1∶1和0∶1进行混合制曲,从成曲的酶系、pH值等几个角度分析2种曲霉混合制曲对制曲质量的影响,结果见图2和表1。
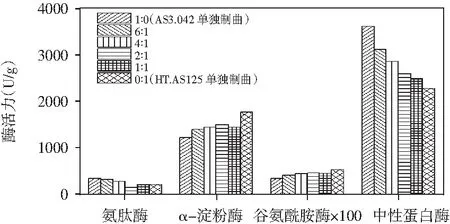
图2 AS3.042和HT.AS125不同比例复合制曲酶系对比
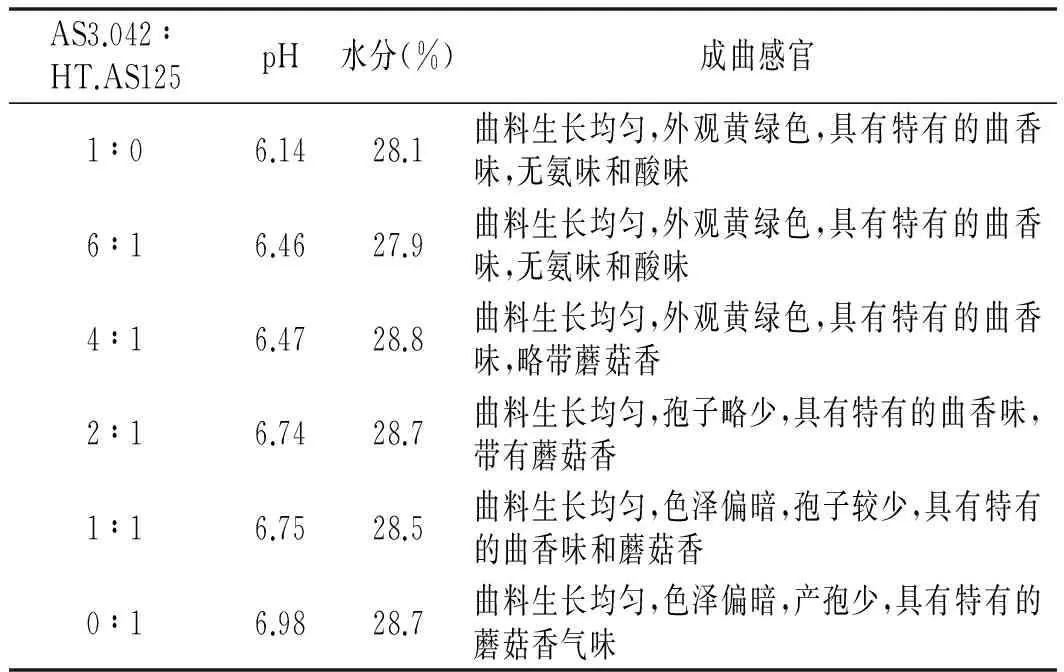
AS3.042∶HT.AS125pH水分(%)成曲感官1∶06.1428.1曲料生长均匀,外观黄绿色,具有特有的曲香味,无氨味和酸味6∶16.4627.9曲料生长均匀,外观黄绿色,具有特有的曲香味,无氨味和酸味4∶16.4728.8曲料生长均匀,外观黄绿色,具有特有的曲香味,略带蘑菇香2∶16.7428.7曲料生长均匀,孢子略少,具有特有的曲香味,带有蘑菇香1∶16.7528.5曲料生长均匀,色泽偏暗,孢子较少,具有特有的曲香味和蘑菇香0∶16.9828.7曲料生长均匀,色泽偏暗,产孢少,具有特有的蘑菇香气味
从2种菌株复合后曲料的指标来看,米曲霉中添加一定比例的酱油曲霉,随着酱油曲霉的增多,曲料的中性蛋白酶和淀粉酶呈现下降的趋势,而曲料的谷氨酰胺酶、氨肽酶、pH呈现递增的趋势,双菌复合制曲成曲的指标介于米曲霉和酱油曲霉单独制曲之间,说明2种菌株在制曲过程中分别发挥了自己的特点。但从变化规律来看,各指标无明显的线性规律,这主要与2种菌株之间的相互竞争协同作用有一定的关系。对比成曲的感官,AS3.042和HT.AS125按照6∶1复合时曲料的香气和感官与AS3.042单独培养比较接近;按照2∶1复合时曲料的感官的孢子生长和香气已经有明显的改变,说明酱油曲霉HT.AS125在混合菌株中已发挥较大的作用。
2.3 不同比例菌株复合发酵结果分析
根据制曲结果分析,2个菌株复合后在蛋白酶和氨肽酶、谷氨酰胺酶方面存在显著性差异,因此以氨基氮、全氮、谷氨酸、氨基酸/全氮等指标作为菌种复合比例确定的依据,结果见表2。
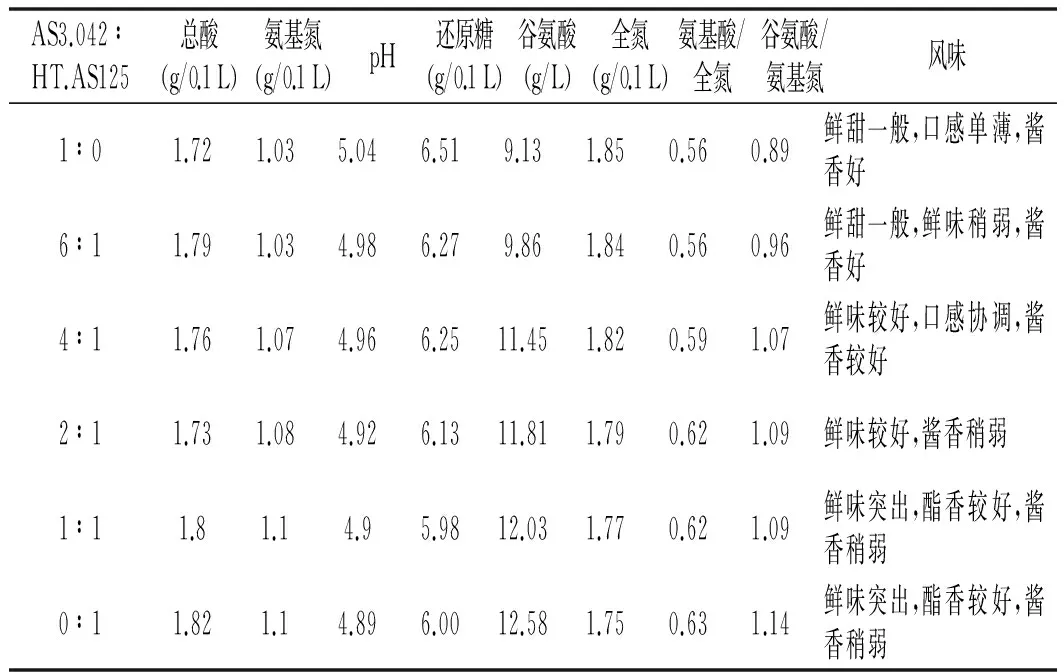
表2 不同比例菌株复合对发酵质量的影响
从发酵结果可以看出,米曲霉与酱油曲霉双菌种制曲后还原糖和全氮有一定的下降,这与酱油曲霉的蛋白酶和淀粉酶活力较低有直接的关系,但氨基氮和谷氨酸均有不同程度的提升。结合发酵油的感官鉴评结果,AS3.042和HT.AS125按照4∶1的比例复合,酱油的滋味有明显的改善,表现为鲜甜较好,口感协调,同时酱油的酱香较好,保留了原始产品的特征。AS3.042和HT.AS125按照1∶1的比例进行复合,酱油的氨基氮/全氮和谷氨酸生成率均有明显的提升,酱油具有鲜味突出的特点,但由于在香气方面已改变了原有菌株的特色,同时全氮较低,不适合在生产中应用。综合考虑,AS3.042和HT.AS125按照4∶1复合作为最佳的配比,氨基氮生成率提高5.37%,谷氨酸生成提高25.41%,酿造酱油的风味得到明显改善。
2.4 不同制曲温度对AS3.042和HT.AS125复合制曲产酶的影响
制曲过程分为曲霉的菌丝生长期和产酶期,制曲温度是影响曲霉生长和产酶最重要的因素之一。为研究混合制曲最佳的产酶温度,菌种比例按照AS3.042∶HT.AS125为4∶1混合,在第1次松曲以后,设置了26,28,30,32,34 ℃进行培养,分析谷氨酰胺酶生成能力,结果见图3。
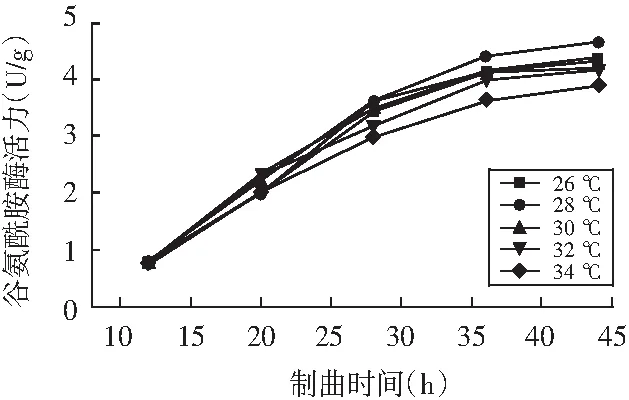
图3 不同培养温度下谷氨酰胺酶的生成情况
谷氨酰胺酶的生成主要集中在12~36 h,与培养温度有较大关系。在12~20 h期间,培养温度越高,谷氨酰胺酶的生成速率越快;20 h以后,26~30℃的温度更加有利于谷氨酰胺酶的分泌,最适合的温度为28 ℃,谷氨酰胺酶活力达到4.65 U/g。32 ℃时谷氨酰胺酶的分泌呈现下降趋势,34 ℃时谷氨酰胺酶活力最低,说明在制曲过程中谷氨酰胺酶的生成适合偏低温的环境。
3 结论
本文通过研究米曲霉与酱油曲霉双菌复合制曲,取得了以下结果:
米曲霉AS3.042和HT.AS125在酶的分泌上具有互补的特点,米曲霉AS3.042中性蛋白酶和淀粉酶活力较高,HT.AS125谷氨酰胺酶和氨肽酶活力较高,其中HT.AS125是AS3.042的1.48倍。
确定了AS3.042和HT.AS125菌种复合制曲的最佳比例为4∶1,氨基氮生成率提高5.37%,谷氨酸生成率提高25.41%。
确定了AS3.042和HT.AS125菌种复合制曲最适合生成谷氨酰胺酶的制曲温度是28 ℃,谷氨酰胺酶活力达到4.65 U/g。
结果表明:米曲霉与酱油曲霉混合制曲对于改善酱油风味有较好的应用效果,与米曲霉与黑曲霉复合制曲相比,解决了黑曲霉制曲过程中黑色孢子的环境污染问题,有良好的应用前景。下一步可继续研究米曲霉与酱油曲霉混合制曲过程中的协同作用机理和竞争抑制关系,为工业化应用奠定基础。
参考文献:
[1]包启安.酱油科学与酿造技术[M].北京:中国轻工业出版社,2011.
[2]胡学智,凌晨,李平作.酱油曲霉蛋白酶及其用于酱油酿造的研究[J].江苏调味副食品,2007,107(5):1-3.
[3]曹骏生.米曲霉和酱油曲霉制造酱油曲和酱油的比较分析[J].中国调味品,1991(2):32-33.
[4]张智文,李长田.传统腌制调味食品中真菌的概述[J].菌物研究,2013,11(1):57-62.
[5]李琴,杜风刚.双菌种制曲在酱油生产中的应用[J].中国调味品,2003(12):36-38.
[6]王素珍,刘文鹏,陶贵明,等.双菌种联合发酵酿制酱油应用研究[J].中国调味品,2009,34(4):55-57.
[7]GB/T 23527-2009,酶制剂[S]
[8]Nampoothiri K M,Nagy V,Kovacs K,et al.L-leucine amino peptidase production by filamentousAspergillusfungi[J].Letters in Applied Microbiology,2005,41(6):498-504.
[9]邹敏娟.酱油曲中谷氨酰胺酶酶活测定条件优化[J].食品与机械,2013,23(3):89-93.
[10]Chutmanop J,Chuichulcherm S,Chisti Y P,et al.Protease production byAspergillusoryzaein solid-state fermentation using agroindustrial substrates[J].Journal of Chemistry and Technology Biotechnology,2008,83:1012-1018.
