神经电生理监测结合神经导航技术切除脑干胶质瘤☆
2018-05-16戚生春刘家传刘光杰邵鸣徐燊王春琳
戚生春 刘家传 刘光杰 邵鸣 徐燊 王春琳
脑干胶质瘤是临床中较为常见的原发性脑干肿瘤,现阶段临床中在对脑干胶质瘤患者进行治疗时常采用手术方案进行治疗,但在手术前准确定位病灶区并在术中有效指导手术操作,具有十分重要的价值[1]。神经导航技术是临床中应用较广的技术,其主要以术前影像学检查资料作为依据,并融合功能像、代谢像图像。术中电生理监测可在手术中有效确认中央后回、中央前回、中央沟等,通过该技术可在手术过程中最大程度的在安全范围内切除病变组织。本研究以我院收治的行脑干胶质瘤治疗患者为研究对象,分析术中神经电生理监测结合神经导航多模态融合技术在切除脑干胶质瘤中的应用价值。
1 资料与方法
1.1 一般资料入组标准:①患者均为汉族且年龄不低于18岁;②经磁共振检测确诊为弥漫性脑干胶质瘤[2];③KPS评分≥60分;④入组前未接受放疗或化疗治疗;⑤手术结束后采用常规化疗方案治疗;⑥对本研究知情并签署知情同意书。排除标准:①精神异常,无法配合本研究;②存在远处转移病灶;③中断治疗或失访患者。经我院伦理委员会批准,采用单中心随机对照研究方案进行设计,依照参考文献[3]计算入组临床样本数,选取2013年1月至2015年1月间我院收治的120例脑干胶质瘤患者作为研究对象,将患者随机分为观察组及对照组,两组资料差异无统计学意义,见表1。
1.2 影像学检查对于招募入组的患者首先进行术前影像学检查,解剖磁共振成像(magnetic resonance imaging, MRI), 弥散张量成像(diffusion tensor imaging,DTI),任务态血氧水平依赖成像(blood oxygen level dependence imaging,BOLD)以及大脑静脉系统成像 (magnetic resonance imaging of cerebral venous sinus,MRV)等。解剖磁共振成像MRI是指利用核磁共振成像仪对患者的颅内病灶部位进行扫描,获得病灶部位的影像,采用西门子3.0 T超导磁共振成像仪进行扫描,设置MRI轴位扫描层厚为1.5 mm;对于弥散张量成像DTI,采用西门子3.0 T磁共振行单次激发平面回波成像序列,扫描参数设置为:厚度3.5 mm,扫描层数 40,TR=6000 ms,TE=90 ms,采用矩阵 128×128,FOV240 mm×240 mm,BW=1447 Hz/Px,共 25个方向行弥散权重采集,计时7.5 min,扫描范围覆盖颅内的全部脑组织;任务态BOLD成像采用组块设计方案,具体为患者两只手进行拇指和食指的对指运动,静息和运动依次交替,共完成10个组块,患者在进行单侧手运动时,身体其他部位尽可能保持静止,患者手腕和前臂不要离开台面,BOLD扫描仪器参数设置如下:TR=3000 ms,TE=30 ms,厚度 3.0 mm,层距 0.8 mm,矩阵 64 mm×64 mm,扫描时间为364.8 s。检测之前仪器设置好A、B两个程序:A为静止,B为触发运动,两者交替,每次30 s,总共5个轮回,最后进行数据后处理,获得激活区的影像。
1.3 手术方法对照组:将MRI数据导入到神经导航(Medtronic S7)系统,进行数据处理分析并构建多模态融合三维示意图,从而显示肿瘤患者病灶部位及其周围功能区的结构。根据术前影像学检查的结果结合肿瘤的部位及大小,采用相应的传统手术方法入路。
观察组:将MRI与DTI的数据传入导航计划工作站,融合并分析重建患者颅脑三维图像,能够清晰描绘出患者颅内肿瘤大小和部位,此外还能够清晰地展示癌旁组织的纤维束形态及其与肿瘤的关系。术中麻醉后用Mayfield头架固定肿瘤患者的头部,安装Brainlab导航系统,采用导航棒和Z-touch激光面部扫描双重注册方式注册,注册完成后测量所选结构间的距离并将导航信息整合至手术显微镜中。手术入路的方式同传统组。神经电生理(Cadwell Cascade TM)电刺激电流控制在5~10 mA,从低电流开始,一般6 mA足以引起肢体动作,刺激双极间距控制在5 mm。在肿瘤切除过程中,进行脑皮层下电刺激,及时予以脑棉片保护并给予激素冲击,术中打开骨瓣后,停止吸入和肌松等麻醉药物,以减少麻醉药物对神经电生理监测的干扰。术中利用导航探针寻找脑干安全切入点,避开重要的纤维束及功能区,避免损伤正常脑干组织。 两组患者术后采用伽马刀同步放疗及化疗方案治疗,术后采用卡莫司汀注射液(天津金耀氨基酸有限公司,H12020992),并依照患者复查结果及时调整放疗及化疗方案。

表1 患者一般资料调查结果
1.4 观察指标比较两组手术基本情况、临床疗效、KPS评分[4],并发症发生情况及生存率。按照RESICT标准进行18个月的近期疗效进行评价,将疗效分为完全缓解 (complete remission,CR)、部分缓解(partial remission, PR)、稳定(stable disease, SD) 和进展 (progressive disease, PD),以(CR+PR)/总例数计算有效率。按照美国国立癌症研究所通用毒性标准[5]对治疗过程中不良反应进行评级,共分为0~4级。采用KPS评分对患者功能状态进行评估,KPS得分越高,健康状况越好。对患者进行随访18个月,记录患者病情恶化及并发症情况,若患者出现死亡则记录死亡期,绘制卡密尔生存曲线。
1.5 统计学方法使用SPSS 19.0行统计学分析,验证计量资料符合正态分布后使用均值±标准差表示,行t检验。计数资料行χ2检验,检测水准α=0.05。
2 结果
2.1 治疗结果观察组手术切除情况优于对照组,且差异存统计学意义(χ2=30.998,P<0.05),且患者手术时间及住院时间均低于对照组,且差异存统计学意义 t=17.636、20.461,P<0.05), 两组治疗前后KPS评分有统计学意义(观察组t=12.815,对照组t=4.285,P<0.01)。治疗前两组KPS评分无明显差异(t=0.365,P>0.05);治疗后两组患者 KPS 评分均升高,且差异存统计学意义(t=7.160,P<0.05);观察组KPS评分改善情况(27.91±1.98)优于对照组 (12.11±2.13), 有统计学意义 (t=32.669,P<0.001)。观察组患者短期疗效优于对照组,且差异存统计学意义 (有效率 76.66%vs.53.33%,χ2=11.962,P<0.05),见表 2。
2.2 生存率调查结果观察组中位生存期14个月,对照组患者中位生存期10个月,观察组明显优于对照组,且差异存统计学意义(χ2=8.942,P<0.05),见图1。
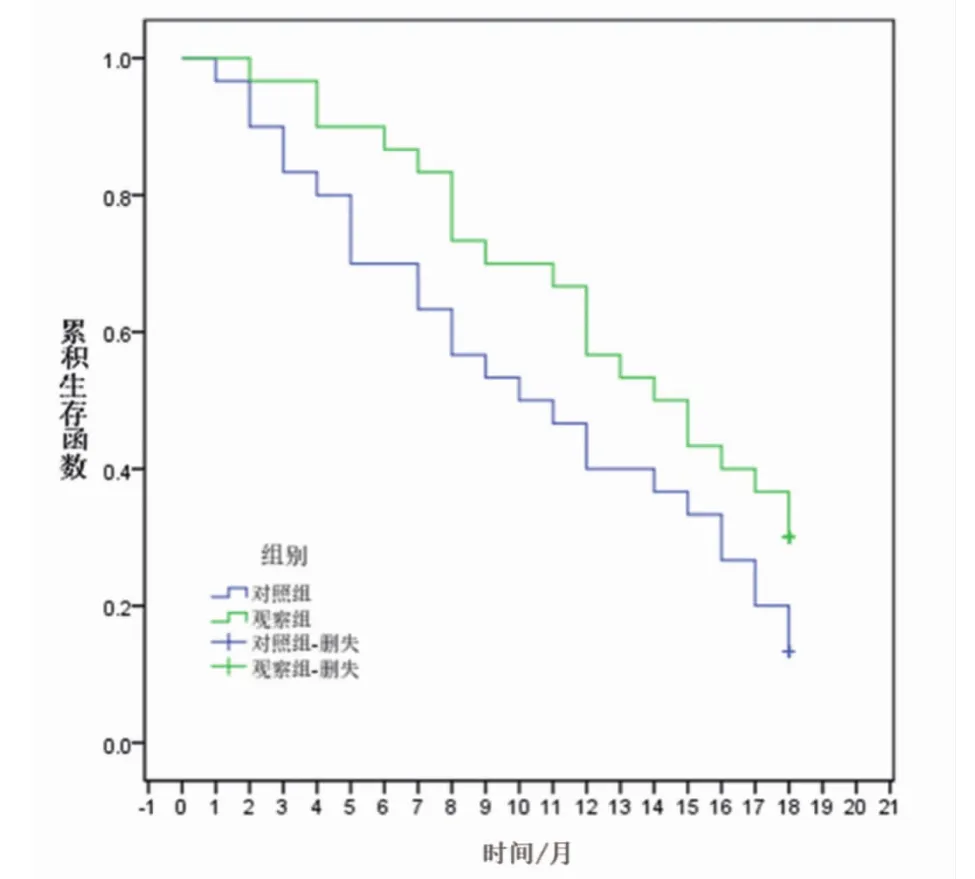
图1 K-M生存曲线
2.3 不良反应调查结果观察组患者呕吐发生5例,头痛8例,智力下降4例,患者不良反应总发生率为53.33%,对照组患者呕吐18例,头痛8例,智力下降6例,不良反应总发生率为70.00%,观察组不良发育发生率低于对照组,且差异存统计学意义(χ2=5.878,P<0.05)。
3 讨论
研究发现,位于神经功能区的病变,在治疗过程中保障神经功能区不被损伤将最终决定患者术后的生活质量与生存期[6]。神经导航系统,即术前采用影像学方法BOLD和DTI对患者进行初步检查,能够方便、有效、无创的对神经功能区进行定位,可在安全范围内最大程度地保护功能区,降低神经功能区受损的风险,提高患者术后的生活质量。为了实现更加安全地切除肿瘤,研究发现神经电生理监测可在术中实时确定中央沟、中央前回及中央后回,以及皮质下的传导束。

表2 治疗各指标调查结果
本研究将患者的常规MRI、DTI资料经过处理后融入导航系统,可直观地展示脑内病灶与瘤周重要组织的关系,制定更为合理的手术计划。随后进行神经导航多模态融合三维重建,描绘脑功能区病变周边皮质脊髓束和任务态BOLD激活区,三维图像能够显示显示病变对纤维束的压迫、推移或中断破坏程度等情况,以及与运动功能区、周边血管之间的关系。应用术中神经电生理监测可以尽早察觉由于手术操作造成的神经功能损害,提醒术者及时停止操作或改变操作方式,避免永久性的神经功能损伤。
本研究对运动功能区肿瘤的手术采用的联合治疗方式,即神经导航多模态融合结合术中电生理监测,具有显著的优势。设计个性化手术方案,选择最佳的手术入路,术前在没有传导束和功能区的肿瘤位置进行瘤内减压,随后在肿瘤病灶和传导束之间的界面进行处理,能够对机体的功能造成最小的损伤。对于一些难处理的肿瘤,如胶质瘤,神经导航可在显微镜下显示病灶部位的轮廓,能够最大程度的保护功能区。由于在神经导航术中能够产生严重的脑漂移,会出现诊断误差。本实验组术中采用电生理监测的辅助,得到的结果与多模态融合后重建DTI和BOLD的投影相符合。患者复查磁共振解剖像MRI和DTI扫描,能够确定患者肿瘤切除程度及其他功能区的完整性,进而可以预测患者术后状况[7-9]。神经导航多模态融合结合术中电生理监测处理的患者肿瘤全切率较高且术后致残较少,术后随访3个月之后均能生活自理,其效果与相关文献的报道结果相一致[10]。但是,该研究仅仅从形态学上描述了DTI和BOLD,若想安全地将此项技术应用到临床中需进一步加大样本进行定性定量分析。现阶段定量分析研究仍存在诸多争议,且尚缺乏可广泛推广的方法,有待后续深入研究。
综上,神经多模态融合可以准确定位运动功能区,在神经电生理监测下,可以显著提高患者肿瘤全切率,缩短手术时间,降低手术创伤及术后神经功能障碍的发生,改善患者术后生活质量,在安全范围内最大程度地切除病变。
[1] 中华医学会神经外科学分会肿瘤学组.脑干胶质瘤综合诊疗中国专家共识[J].中华医学杂志,2017,33(13):217-229.
[2] 魏社鹏,赵继宗.脑干胶质瘤[J].国际神经病学神经外科学杂志,2008,35(3):231-235.
[3] 李雪迎.临床研究样本量的统计学估算 [J].中国介入心脏病学杂志,2014,22(7):430-430.
[4] HUYNHLE MP,ZHANG Z,TRAN PT,et al.Low inter-rater reliability in grading of rectal bleeding using NCI CTC and RTOG toxicity scales:a survey of radiation oncologists[J].International Journal of Radiation Oncology Biology Physics,2014,90(5):1076-1082.
[5] 刘晓艳,康慧聪,胡琦,等.难治性颞叶癫痫患者术后生活质量分析[J].神经损伤与功能重建,2015,10(2):122-124.
[6] 周晗,汪逵,邓民强.恶性脑胶质瘤患者术后生存质量的影响因素[J].实用癌症杂志,2017,32(9):1470-1471.
[7] 付本升,陈燕,冯博,等.改良针刀松解术联合正中神经脉冲射频治疗腕管综合征临床观察[J].临床军医杂志,2016,44(6):643-643.
[8] GHANOUNI P,DOBROTWIR A,BAZZOCCHI A,et al.Magnetic resonance-guided focused ultrasound treatment of extraabdominal desmoid tumors:a retrospective multicenter study[J].European Radiology,2017,27(2):732-740.
[9] 周婷,曹荔,陆小燕,等.超声与MRI联合评估胎儿颅后窝池增宽的临床应用[J].东南大学学报(医学版),2017,36(1):62-66.
[10] 常枫,王淑琴.多模态神经导航联合电生理技术在颅底肿瘤手术中的临床价值[J].神经损伤与功能重建,2017,12(3):218-220.
