中枢神经系统脱髓鞘疾病患者APOE基因多态性与认知功能的关系☆
2018-05-16曹萌徐竹贺电邵冰吴钦华牟茂蒙延筱楚兰
曹萌 徐竹 贺电 邵冰 吴钦华 牟茂 蒙延筱 楚兰
中枢神经系统脱髓鞘病是一类免疫平衡状态失常、原有免疫稳态被打破,导致炎症细胞浸润、髓鞘反复脱失再生一系列炎性细胞因子分泌失调为主要病理生理过程的疾病。多发性硬化(mutiple sclerosis,MS)和视神经脊髓炎谱系疾病(neuromyelitis optical spectrum disorders,NMOSD)是两种较常见的慢性反复发作的中枢神经系统脱髓鞘疾病,好发于中青年,其临床症状相对复杂,通常累及感觉、运动、视力、括约肌等。越来越多的证据表明,认知障碍也常发生于这两种疾病[1],同样影响患者的生活质量。MS合并认知障碍已经普遍被人们所认识,报道证实认知障碍在MS患者中占相对较高的比例,约43%~70%[2],且在疾病早期即临床孤立综合征(clinically isolated syndrome,CIS)阶段就已存在[3-4],并随着时间的推移患病率增加。NMOSD认知障碍则是2008年BLANC等[5]首次报道了才逐渐引起人们关注。相对于感觉及运动障碍,认知功能障碍发病往往隐匿且逐渐进展,容易被忽视。其发生机制至今尚不完全清楚。关于MS认知损害的疾病相关基因研究最多的是APOEε4,有报道APOEε4基因阳性的MS患者认知损害更严重[6],也有学者持不同意见,认为与之无明显关联[7-8]。本研究旨在探讨载脂蛋白基因多态性与中枢神经系统脱髓鞘疾病认知功能障碍的关系。
1 对象与方法
1.1 对象选取2016年10月至2018年01月在贵州医科大学附属医院神经内科明确诊断的56例中枢神经系统脱髓鞘疾病患者,其中NMOSD患者46例,MS患者8例,CIS患者2例。该研究获得贵州医科大学附属医院伦理委员会的批准,所有检查和化验均经患者同意并签署了知情同意书。纳入标准:①NMOSD患者符合2015年WINGERCHUK等[9]修订的诊断共识;②MS患者满足MCDONALD等[10]2010年修订的诊断标准。③年龄限定在18到70岁之间。排除标准:①患有内分泌功能疾病、甲状腺疾病、颅内感染、颅脑外伤、急性出血或缺血性卒中、痴呆、神经系统退行性病变导致认知功能障碍。②酗酒史或药物滥用史。③存在严重的视觉或听觉障碍,不能正常完成认知功能评价。
1.2 方法对所有患者入院时进行APOE基因分型检测、MoCA评分、EDSS量表评分。MoCA量表包括视空间、命名、注意力、语言流畅、抽象思维、延迟记忆、定向力7个部分,对于受教育年限<12年的受试者,在测试结果上加1分,以矫正文化程度偏倚。根据MOCA量表评分,将MOCA评分26<分纳为认知功能障碍 (cognitive impairment,CI)组,MOCA评分≥26分纳为认知功能保留(cognitive preserved,CP)组。比较两组APOE各基因型和等位基因的分布。将所有患者分为APOEε4基因阳性组和APOEε4基因阴性组,比较不同基因组年龄、性别、受教育年限、EDSS评分。
1.3 统计学方法采用SPSS 24.0进行统计学分析,首先检验数据是否符合正态分布,正态分布数据以±s表示,组间比较采用独立样本t检验;计数资料组间比较采用卡方检验。非正态分布以中位数 (四分位间距)表示,组间比较采用Mann-Whitney检验,认知障碍形成的危险因素用logistic回归分析。检验水准α=0.05。
2 结果
2.1 一般资料本研究共纳入中枢神经系统脱髓鞘疾病认知功能障碍(CI)组患者30例,男7例,女23例(男:女=1:3.3)其中 NMOSD患者26例,MS患者 4例,年龄 21~70岁(43.87±13.70岁),受教育年限 0~16 年(10.33±4.31)。
共纳入中枢神经系统脱髓鞘疾病认知功能保留(CP)组患者 26例,男10例和女16例(男:女=1:1.6),其中 NMOSD患者 20例,MS患者 4例,CIS 患者 2例,年龄 22~69 岁(37.08±13.89 岁),受教育年限 0~16年(14.31±2.59)。 中枢神经系统脱髓鞘疾病患出现认知功能障碍率为53.57%(30/56),CI组与CP组间年龄、性别、病程及EDSS评分差异无统计学意义(P>0.05),受教育年限组间差异有统计学意义(P<0.01)(见表 1)。
2.2 APOE基因型与等位基因频率分布与认知功能对比分析表2显示:中枢神经系统脱髓鞘疾病患者APOE基因型频率中以ε33最高占76.8%,其次是 ε23 和 ε34, 各占 8.9%和14.3%,ε44、ε22和ε23均没有被检出。APOE各基因型和等位基因比较,差异无统计学意义(P>0.05)。
2.3 中枢神经系统脱髓鞘疾病患者不同基因组间比较根据是否携带ε4,将所有纳入患者分为APOEε4基因阳性组和APOEε4基因阴性组,其中阳性组8例(14.29%),阴性组48例。不同基因组年龄、性别、受教育年限、EDSS评分无明显差别,各认知域间视空间和注意力差别具有统计学意义(P<0.05),命名、言语流畅、抽象思维、延迟记忆差别无统计学意义(P>0.05)。见表3。
2.4 中枢神经系统脱髓鞘疾病患者认知障碍危险因素分析本研究将认知障碍与否作为因变量,年龄、性别、受教育年限、病程以及EDSS评分做自变量,进行Logistic回归分析,探讨认知障碍形成的危险因素。结果显示,受教育年限是中枢神经系统脱髓鞘疾病患者认知功能障碍的危险因素(P<0.01)。 见表 4。
3 讨论
尽管中枢神经系统脱髓鞘疾病认知功能障碍的现象已经引起人们的关注,但相关研究仍较少。MS患者其认知功能损害发生率为43%~70%[2],虽然NMOSD颅内病变不如MS常见,但研究表明其认知功能障碍存在也较普遍,发生率为54%~57%,且在病程初期就已出现认知受损现象[1,11]。本研究显示,约半数中枢神经系统脱髓鞘疾病患者存在认知功能障碍,发生率为53.57%(30/56),这与国内外多项报道相一致。与CP组相比,CI组脱髓鞘疾病的受教育年限更短。经logistis回归进一步分析提示,受教育年限是中枢神经系统脱髓鞘疾病患者认知功能障碍的危险因素。这与认知储备假说相符合,该假说认为先天的遗传因素,即脑生长的最大时间 (通过测量颅内体积量化),及后天环境因素(受教育水平、职业、智力、健康状况、业余活动等)都有助于抵抗疾病引起的认知下降。MS患者疾病早期,具有相似病理改变的背景下,认知储备较好的患者相对与认知储备差的患者,其认知功能受损的程度较轻[12]。YAOULIU等[13]指出海马体积及受教育水平是NMOSD患者认知功能的强预测因素。其机制可能是难度较高的学习任务可以使认知相关功能网络更高效地参与其中[14]。与CP组相比,CI组在年龄、性别及病程、EDSS评分方面无明显差异,提示认知功能障碍与患者残疾功能程度及病程长短无相关性。这与PAPADOPOULOU等[15]的报道相一致。AMATO等[16]在先前的研究发现EDSS评分与认知功能无相关性,但10年后对这些患者进行研究发现,EDSS评分是神经心理测试结果不佳的一个预测因素。这也可能是因为我们的患者残疾程度偏低、病程时间较短有关。

表1 CI组与CP组一般人口学和临床特征
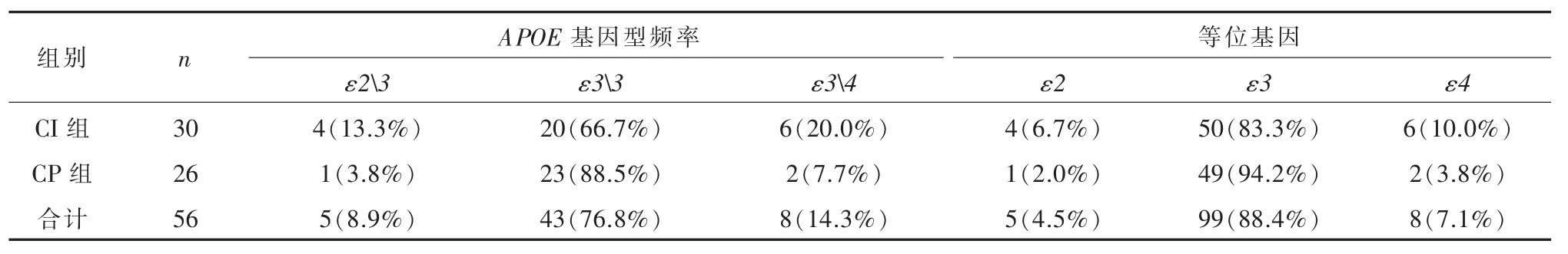
表2 APOE基因频率分布与认知功能改变对比分析

表3 APOEε4基因阳性组和APOEε4基因阴性组一般临床特征及各认知域

表4 中枢神经系统脱髓鞘疾病患者认知障碍危险因素分析
APOEε4在阿尔茨海默病 (AD)中起重要作用,其被认为是仅次于年龄的第二危险因素[17]。关于APOE是否同样参与CNS脱髓鞘疾病认知功能损害的相关报道尚存在争议。有研究认为APOE基因参与了MS认知障碍的形成[18],但也有研究认为其对认知障碍无关[19]。GHAFFAR等[19]比较了 50例 APOEε4阳性 MS患者和 50例APOEε4阴性MS患者的认知功能水平,发现两组间无明显统计学意义。SHI等[18]报道显示APOEε4阳性组认知水平下降更快,证实APOEε4参与了MS认知功能损害的过程。而国内外尚缺NMOSD认知功能与APOE的研究。本研究纳入的中枢神经系统脱髓鞘病患者中,APOEε3/3基因型频率最大,APOEε2/2、APOEε4/4 这两种基 因型并未出现。APOE各基因型和等位基因频率CI组和CP障碍组相比较,ε4等位基因频率两组差别无明显差异。也可能与纳入样本量较小有关。本研究又将APOEε4等位基因阳性与否认为两组,显示两组在年龄、性别、受教育年限、EDSS评分无明显相关性,而对各认知域进行进一步分析显示,APOEε4等位基因阳性组在视空间和注意力方面较APOEε4等位基因阴性组降低。在命名、言语流畅、延迟记忆、定向力、抽象思维两组无明显差异。Shi等报道显示APOEε4阳性组 MS患者较APOEε4阴性组主要在语言学习和记忆方面受累。KOUTSIS等[20]也报道了类似的结果。本研究与之结果不同之处可能在于测试方法较单一,只运用了MOCA量表。
本研究的不足之处在于:①由于选取样本量的时间和范围限制,所纳入样本量较小,APOEε4阳性患者比例偏小。因我国MS患者患病率低,本研究只纳入8例MS患者和2例CIS患者,因此并没有进行组间比较,而是统一为中枢神经系统脱髓鞘疾病组。②认知检测方法较单一,没有进行更精确具体的神经心理学量表进一步研究。③本研究所纳入的患者均为急性期发作的住院患者,一些可能影响认知障碍的药物治疗因素没有被进一步分析。
[1] KIM SH,KWAK K,JEONG IH,et al.Cognitive impairment differs between neuromyelitis optica spectrum disorder and multiple sclerosis[J].Mult Scler,2016,22(14):1850-1858.
[2] BRISSART H,LEROY M,MORELE E,et al.Cognitive rehabilitation in multiple sclerosis.[J].Neurocase,2013,19(6):553-565.
[3] 杨娉婷,徐枫,肖卫国.干燥综合征神经系统损害临床表现及诊治[J].中国实用内科杂志,2017,37(6):503-505.
[4] JULIAN LJ.Cognitive functioning in multiple sclerosis[J].Neurologic clinics,2011,29(2):507-525.
[5] BLANC F,ZÉPHIR H,LEBRUN C,et al.Cognitive functions in neuromyelitis optica.[J].Archives of Neurology,2008,65(1):84-88.
[6] MAZUREK AA,SHI J.APOE epsilon4 allele is associated with cognitive impairment in patients with multiple sclerosis.[J].Neurology,2008,70(3):185-190.
[7] VAN D WA,STANKOVICH J,BAHLO M,et al.Apolipoprotein genotype does not influence MS severity,cognition,or brain atrophy.[J].Neurology,2009,73(13):1018-1025.
[8] PORTACCIO E,GORETTI B,ZIPOLI V,et al.APOE-e4 is not associated with cognitive impairment in relapsing-remitting multiple sclerosis[J].2009,15(12):1489-1494.
[9] WINGERCHUK DM,BANWELL B,BENNETT J L,et al.International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J].Neurology,2015,85(2):177-189.
[10] POLMAN CH,REINGOLD SC,BANWELL B,et al.Diagnostic criteria for multiple sclerosis:2010 revisions to the McDonald criteria.[J].Annals of Neurology,2011,69(2):292-302.
[11] BLANC F,NOBLET V,JUNG B,et al.White Matter Atrophy and Cognitive Dysfunctions in Neuromyelitis Optica[J].Plos One,2012,7(4):e33878.
[12] ROCCA MA,AMATO MP,De S N,et al.Clinical and imaging assessment of cognitive dysfunction in multiple sclerosis[J].Lancet Neurology,2015,14(3):302-317.
[13] LIU Y,FU Y,SCHOONHEIM MM,et al.Structural MRI substrates of cognitive impairment in neuromyelitis optica.[J].Neurology,2015,85(17):1491-1499.
[14] SUMOWSKI JF,ROCCA MA,LEAVITT VM,et al.Brain reserve and cognitive reserve protect against cognitive decline over 4.5 years in MS[J].Neurology,2014,82(20):1776-1783.
[15] PAPADOPOULOU A,MüLLER-LENKE N,NAEGELIN Y,et al.Contribution of cortical and white matter lesions to cognitive impairment in multiple sclerosis[J].Multiple Sclerosis,2013,19(10):1290-1296.
[16] AMATO MP,PONZIANI G,SIRACUSA G,et al.Cognitive Dysfunction in Early-Onset Multiple Sclerosis:A Reappraisal After 10 Years[J].Archives of Neurology,2001,58(10):1602-1606.
[17] AFZAL S,BOJESEN SE,NORDESTGAARD B G.Reduced 25-hydroxyvitamin D and risk of Alzheimer’s disease and vascular dementia [J].Alzheimers& Dementia the Journal of the Alzheimers Association,2014,10(3):296-302.
[18] SHI J,TU J L,GALE SD,et al.APOE epsilon 4 is associated with exacerbation of cognitive decline in patients with multiple sclerosis[J].Cognitive&Behavioral Neurology Official Journal of the Society for Behavioral&Cognitive Neurology,2011,24(3):128-133.
[19] GHAFFAR O,REIS M,PENNELL N,et al.APOE epsilon4 and the cognitive genetics of multiple sclerosis.[J].Neurology,2010,74(20):1611-1618.
[20] KOUTSIS G,PANAS M,GIOGKARAKI E,et al.APOE epsilon4 is associated with impaired verbal learning in patients with MS.[J].Neurology,2007,68(8):546-549.
