精神分裂症药物治疗后血清神经肽Y变化与治疗干预的关系☆
2018-05-16赵静吕钦谕陆颖胡国芹鲍晨曦朱明环贾思程小燕耿瑞杰王颖怡茅卫兵徐健禹顺英易正辉
赵静 吕钦谕 陆颖 胡国芹 鲍晨曦 朱明环 贾思 程小燕 耿瑞杰王颖怡 茅卫兵 徐健 禹顺英 易正辉
精神分裂症是一种严重而病程迁延的疾病,功能残疾率高,给患者及其家属和社会带来沉重的负担。迄今为止,精神分裂症的病因尚不明确,对本病的理解还有赖于各种假说,其中包括神经发育假说等。新近的研究发现,外源性神经肽Y(neuropeptide Y,NPY)能促进体内海马神经生成,从而对大脑可塑性有重要调节作用[1]。体外研究发现NPY能增加营养支持、减弱神经炎症,起到神经保护作用[2]。可见NPY在神经发育过程中起重要作用,可能与精神分裂症的发病有关。近年来,国内研究多集中于外周血NPY蛋白水平与抗精神病药物治疗后体重、瘦素变化的相关性研究[3-4],且对于外周血NPY水平在精神分裂症患者和正常对照间有无差异各研究结果也存在争议。本研究旨在了解外周血NPY水平与精神分裂症发病及其与奥氮平治疗后患者精神症状改变的关系。
1 对象与方法
1.1 研究对象病例组来自2014年1月至2016年1月在上海市精神卫生中心门诊或住院患者。入组标准:①符合《美国精神障碍诊断与统计手册第四版》(DSM-Ⅳ)精神分裂症诊断标准;②汉族,性别不限,年龄<65岁,不存在血缘关系;③入组前至少4周未服用任何精神类药物;④文化、社会及受教育背景足以理解知情同意和研究内容。排除标准:①有严重、慢性躯体疾病者(包括高血压、糖尿病、脑血管病等);②符合除了精神分裂症外的DSM-Ⅳ诊断者(包括物质滥用/依赖);③近1月接受过电抽搐治疗;④妊娠和哺乳期妇女。共纳入 125例患者,男 72例,女 53例;年龄(22.13±7.52)岁;受教育年限(10.33±1.89)年;基线体质量指数(body mass index,BMI)为(21.64±1.95)kg/m2。对照组来自社区健康志愿者。入组标准:①不符合DSM-IV的任何一项精神疾病诊断 (包括物质滥用/依赖);②无精神疾病家族史;③汉族,性别不限,年龄<65岁,不存在血缘关系。排除标准:①有严重、慢性躯体疾病(包括高血压、糖尿病、脑血管病等);②妊娠和哺乳期妇女。共纳入136名对照,男 80 名,女 56 名;年龄(21.18±2.83)岁;受教育年限(13.18±1.81)年;基线 BMI(21.33±1.86)kg/m2。两组在性别、年龄、基线BMI均无统计学差异(P>0.05),两组受教育年限比较有统计学差异(t=-18.03,P<0.01)。
本研究经上海市精神卫生中心伦理委员会审批通过,批号:2012-26R。所有研究对象或其监护人均在研究之前已被告知具体的研究方案并签署知情同意书。
1.2 方法
1.2.1 研究方案 首先采取横断面研究方法,在基线检测病例组和对照组血清NPY浓度,同时进行一般资料收集、认知功能及精神症状量表的评估。然后对病例组进行前瞻性观察研究,所有病例单用奥氮平治疗4周(不能合并MECT),奥氮平剂量15~22.5 mg,根据病情进行调整,治疗4周后再次检测血清NPY浓度并评估精神症状。
1.2.2 临床评估 认知功能评估采用可重复的成套神经心理状态测量 (repeatable battery for the assessment of neuropsychological status,RBANS),包括5个因子:即刻记忆、空间结构、言语功能、注意力、延迟记忆。该量表对轻度认知损害较敏感,测查时间短,信效度良好。精神症状评估采用阳性与阴性症状量表 (positive and negative syndrome scale,PANSS),量表常规有 30项条目,另有 3个补充项,各条目采用7级评分方法(1~7分),程度越重,分值越高。PANSS可以分为阳性症状、阴性症状、一般精神病理分量表。
1.2.3 NPY测定 所有研究对象在抽血前8 h内禁食,确保处于空腹状态,肘前静脉抽血5 mL,离心后-20 ℃冰箱保存。采用 NPY(Human,Rat,Mouse)ELI Kit (EK-049-03)(美国 Phoenix Pharmaceuticals公司)进行酶联免疫吸附测定(ELISA)技术测定血清NPY浓度。该批号灵敏度0.09 ng/mL。由我单位生化室专人进行检测。
1.3 统计学方法所有数据应用SPSS 23.0进行分析。各协变量(性别、年龄、受教育年限、基线BMI)对血清NPY浓度的影响,以及用两组间认知功能的比较(将性别、年龄、受教育年限作为协变量)应用协方差分析;基线血清NPY浓度、年龄、受教育年限、基线BMI的组间比较均应用独立样本t检验;病例组治疗前后血清NPY浓度比较应用配对t检验;PANSS量表分不符合正态分布,治疗前后比较采用Wilcoxon符号秩检验;基线血清NPY浓度与认知功能及精神症状的相关性、治疗前后血清NPY浓度变化与精神症状变化的相关性均应用Spearman相关分析。两组间及病例组治疗前后血清NPY浓度结果采用GraphPad Prism 6.0软件绘图。检验水准α=0.05,双侧检验。
2 结果
2.1 基线期两组血清NPY浓度协方差分析示,性别、年龄、受教育年限、基线BMI及其交互作用对血清NPY浓度均无影响(P>0.05)。病例组基线期血清 NPY 浓度为(0.81±0.21)ng/mL,低于对照组的(0.97±0.28)ng/mL,差异有统计学意义(t=-5.79,P<0.01),见图 1。
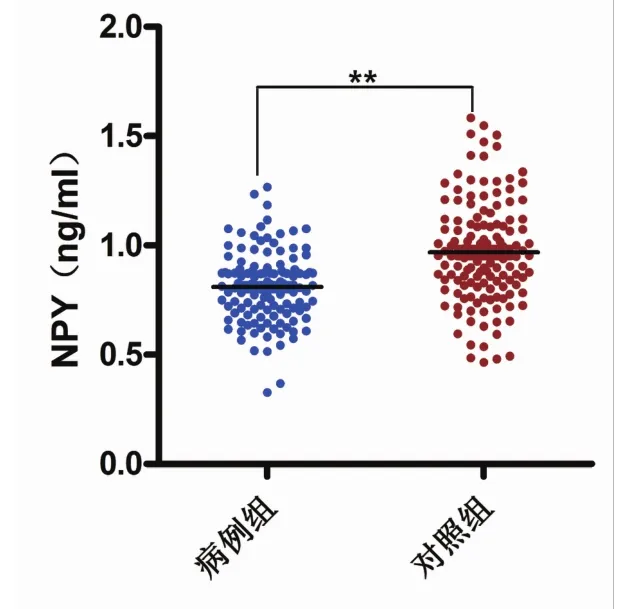
图1 精神分裂症病例组血清NPY浓度低于对照组(P<0.01)
2.2 病例组治疗前后血清NPY变化病例组共有108例患者完4周治疗随访。基线期和治疗后血清 NPY 浓度分别为 (0.80±0.18)ng/mL和 (0.85±0.19)ng/mL,治疗后较基线期升高且差异有统计学意义(t=-2.23,P=0.03),见图 2。
2.3 基线期两组间认知功能校正性别、年龄、受教育年限,协方差分析示,病例组RBANS总分及其各因子分均低于对照组(均P<0.01),见表1。
2.4 基线期血清NPY浓度与PANSS、RBANS的相关性在病例组中,基线期血清NPY浓度与RBANS量表注意因子分呈正相关 (r=0.20,P=0.04),与PANSS总分及分量表分相关性无统计学意义 (P>0.05);对照组血清NPY浓度与RBANS总分及各因子分相关性无统计学意义(P>0.05)。
2.5 治疗4周后血清NPY浓度变化与PANSS量表分变化的相关性病例组治疗4周后PANSS总分及其分量表分均下降(P<0.01),见表2。治疗4周后血清NPY浓度变化值(4周-基线)与PANSS量表分变化值(基线-4周)的相关性无统计学意义(P>0.05)。
表1 病例组基线期和对照组RBANS评分(±s)

表1 病例组基线期和对照组RBANS评分(±s)
1)与对照组比较,经协方差分析(性别、年龄、受教育年限为协变量),P<0.01
组别病例组对照组n 125 136 RBANS总分396.09±58.791)536.15±33.00即刻记忆70.17±14.641)101.20±11.75视觉广度87.05±17.141)109.53±8.59言语功能79.68±12.341)103.57±11.34注意87.25±15.781)118.79±14.68延时记忆71.94±21.371)103.56±10.88
表2 精神分裂症患者治疗4周前后PANSS量表评分(±s)

表2 精神分裂症患者治疗4周前后PANSS量表评分(±s)
1)与治疗前比较,经Wilcoxon符号秩检验,P<0.01
时间治疗前治疗后n 108 108总分91.86±17.18 69.82±11.481)阳性症状量表26.22±6.15 18.97±4.731)阴性症状量表23.03±7.40 18.98±4.731)一般精神病量表42.62±10.60 31.87±5.681)

图2 精神分裂症病例组治疗后血清NPY浓度较治疗前升高(P=0.03)
3 讨论
迄今为止,许多神经精神科疾病的发病机制仍然不清楚。研究这些疾病发生及发展过程中的分子机制主要通过比较病例和正常对照之间大脑组织中基因及其表达的差异。然而,由于脑组织的可及性有限,有关易于获得的外周组织(如血液)是否能代表脑组织中基因表达的相关研究,对于推进神经精神疾病研究进展显得尤为重要。WITT等[5]在2013年使用覆盖29215个表达基因的全基因组Affymetrix基因芯片比较大鼠血液、海马和前额叶皮层中基因表达差异,共检测到15717个基因表达,其中56.8%的基因在血液和至少一个脑组织中共表达,而其中55.3%的基因同时在这三个组织中共表达。重叠的基因包括一些与神经精神疾病(特别是双相情感障碍、精神分裂症和酒精成瘾)相关的基因,其中包括NPY基因。因此,推测外周血NPY水平可以代表脑组织内表达水平。
本研究探讨外周血NPY水平与精神分裂症发病及与药物治疗后患者精神症状变化的关系。以往研究显示老年大鼠的内侧前额叶皮层NPY表达水平下降,由此推测外周血NPY蛋白的表达可能与年龄相关[6-7]。KLEMETTILÄ等[8]在2016年的研究显示血浆NPY水平与年龄、性别、BMI水平相关,因而本研究在统计分析方面考虑到协变量可能对血清NPY浓度产生影响,将以上变量作为协变量进行协方差分析。研究结果显示:基线期病例组血清NPY浓度低于对照组(P<0.01),这和2013年YANIK等[9]的研究结果一致。然而宋梓祥等[10-11]的研究均显示停药6个月的精神分裂症患者和对照组间外周血NPY浓度并没有统计学差异。本研究结果与之不一致,可能与以下原因有关:首先,检测样本的组织来源不同(本研究检测的是血清NPY水平,之前研究检测的均是血浆NPY水平);此外,入组对象及样本量不同,宋梓祥等[10-11]的研究包括病例组30例,对照组30例,且均为女性,而本研究入组对象性别不限且样本量较大。根据以往的研究证据显示,NPY在脑中能抑制谷氨酸释放从而避免苯环己哌啶导致的精神病性症状出现,脑中NPY水平降低使得谷氨酸的神经元兴奋性毒性作用无法得到保护,因而与精神分裂症的精神病性症状发生有关[12]。本研究结果符合中枢NPY与精神分裂症发生的病因假说关系,提示外周血NPY水平可能成为精神分裂症的潜在生物标志物之一。
RAGHANTI等[13]的动物研究发现NPY和认知缺陷的可能机制为:NPY能保护皮层神经元免于谷氨酸的毒性作用[14],能保护神经元避免β淀粉样肽调节的毒性作用[15]。此外,NPY对神经发生也有重要作用,且目前有争论认为NPY对扩大脑容量也具有一定作用[14]。这些研究都能解释新皮层NPY减少与认知缺陷有关。本研究试图了解血清NPY浓度和认知功能的关系,比较分析发现病例组认知功能明显低于对照组,相关分析显示基线期血清NPY浓度与RBANS量表注意因子分呈正相关。本研究结果和2016年赵瑾等[16]的结果相似,该研究发现首发精神分裂症患者与对照组相比存在广泛的认知功能损害。黄国平等[17]的研究发现外周血NPY水平与记忆商数、短时记忆、再生、触摸等认知功能呈正相关。而本研究同样发现血清NPY浓度与RBANS量表的注意因子分 (包括数字广度、编码测验)呈正相关。
本研究结果显示治疗4周后病例组血清NPY浓度上升,这和AK等[18]的研究结果一致,提示与奥氮平的作用机制有关。为进一步了解血清NPY升高是否与奥氮平抗精神病疗效相关,本研究对治疗4周前后的NPY浓度变化和同期的PANSS量表分变化间进行相关分析。结果显示两者的相关性未达到统计学意义,提示血清NPY浓度的变化可能并不与奥氮平的抗精神病疗效相关。近年国内有研究显示奥氮平治疗4周后外周血NPY浓度的上升和体重变化呈正相关 (r=0.632,P<0.001),且能解释同期体重变化的40%,提示血清NPY浓度的变化可能与奥氮平治疗对体重增加的影响有关[4]。
总之,本研究对中国汉族人群精神分裂症患者经奥氮平治疗后血清NPY浓度与抗精神病疗效间关系做了初步探讨。由于随访困难,在前瞻性药物治疗观察阶段,本研究仅在治疗4周后进行随访评估,血清NPY浓度的变化与精神症状的变化可能尚未充分展开。在今后的研究中,需要进一步扩大样本量,并延长随访的时间,减少脱落,从而进一步探讨血清NPY浓度变化与精神分裂症抗精神病药物疗效的关系。
[1] THIRIET N,AGASSE F,NICOLEAU C,et al.NPY promotes chemokinesis and neurogenesis in the rat subventricular zone[J].J Neurochem,2011,116(6):1018-1027.
[2] DUARTE-NEVES J,PEREIRA DE ALMEIDA L,CAVADAS C.Neuropeptide Y(NPY)as a therapeutic target for neurodegenerative diseases[J].Neurobiol Dis,2016,95:210-224.
[3] 陈琪,徐乐平,施辉,等.氯氮平、阿立哌唑对精神分裂症患者血浆神经肽Y、瘦素水平的影响及其与体质量变化的关系[J].临床精神医学杂志,2016,26(3):171-174.
[4] 宋梓祥,陈琪,徐乐平,等.氯氮平对精神分裂症患者血浆神经肽Y及体重的影响[J].中国神经精神疾病杂志,2008,34(10):632.
[5] WITT SH,SOMMER WH,HANSSON AC,et al.Comparison of gene expression profilesin the blood,hippocampusand prefrontal cortex of rats[J].In Silico Pharmacol,2013,1:15.
[6] PEREIRA PA,MILLNER T,VILELA M,et al.Nerve growth factor-induced plasticity in medial prefrontal cortex interneurons of aged Wistar rats[J].Exp Gerontol,2016,85:59-70.
[7] FIUZA FP,SILVA KD,PESSOA RA,et al.Age-related changes in neurochemical components and retinal projections of rat intergeniculate leaflet[J].Age(Dordr),2016,38(1):4.
[8] KLEMETTILÄ JP,KAMPMAN O,SOLISMAA A,et al.Association study of arcuate nucleus neuropeptide Y neuron receptor gene variation and serum NPY levels in clozapine treated patients with schizophrenia[J].Eur Psychiatry,2017,40:13-19.
[9] YANIK T,KURSUNGOZ C,SUTCIGIL L,et al.Weight gain in risperidone therapy:investigation of peripheral hypothalamic neurohormone levels in psychotic patients[J].J Clin Psychopharmacol,2013,33(5):608-613.
[10] 宋梓祥,陈琪,徐乐平,等.氯氮平对精神分裂症患者血浆神经肽Y及体重的影响 [J].中国神经精神疾病杂志,2008,34(10):632-633.
[11] 宋梓祥,陈琪,徐乐平,等.氯氮平对血浆神经肽Y及体质量的影响[J].临床精神医学杂志,2009,19(2):88-89.
[12] BAPTISTA S,BENTO AR,GONÇALVES J,et al.Neuropeptide Y promotes neurogenesis and protection against methamphetamine-induced toxicity in mouse dentate gyrus-derived neurosphere cultures[J].Neuropharmacology,2012,62(7):2413-2423.
[13] RAGHANTI MA,EDLER MK,MEINDL RS,et al.Humans and great apes share increased neocortical neuropeptide Y innervation compared to other haplorhine primates[J].Front Hum Neurosci,2014,8:101.
[14] DECRESSAC M,BARKER RA.Neuropeptide Y and its role in CNS disease and repair[J].Exp Neurol,2012,238(2):265-272.[15]CROCE N,CIOTTI MT,GELFO F,et al.Neuropeptide Y protects rat cortical neurons against beta-amyloid toxicity and reestablishes synthesis and release of nerve growth factor[J].ACS Chem Neurosci,2012,3(4):312-318.
[16] 赵瑾,杜云红,杨鸽,等.奥氮平对首发精神分裂症患者认知功能的潜在作用[J].新乡医学院学报,2016,33(5):387-390.
[17] 黄国平,张亚林,邹韶红,等.儿童期性虐待受害者记忆、执行功能与血浆神经肽Y的关系[J].中华精神科杂志,2006,39(1):12-15.
[18] Ak M,Sezlev D,Sutcigil L,et al.The investigation of leptin and hypothalamic neuropeptides role in first attack psychotic male patients:olanzapine monotherapy[J].Psychoneuroendocrinology,2013,38(3):341-347.
