H 2S对大鼠心肌肥大与miRNA-133a和Ca2+/CaN/NFATc4信号通路的影响*
2018-05-15郭媛媛张元媛
吴 扬,郭媛媛,张元媛,张 宜
(南通大学航海医学研究所,江苏南通226019)
近些年来,科学家发现生物体内可合成内源性H2S,它作为一种新型的调节因子和信号传递分子,在神经、心血管等系统中发挥重要的生理调节作用,因而被称之为继NO和CO之后发现的第三种气体信使分 子[1,2]。胱硫 醚-γ-裂 解 酶 (cystathionineγlyase,CSE)是心血管系统中生成内源性H2S的主要合成酶[3]。近年来,H2S作为一种重要的气体信号分子,已成为心血管疾病研究的新靶标。研究[4,5]表明,miR-133a是心肌肥大重要的负性调控因子。CaN和 NFATc4已被证实是miR-133a的下游靶基因。H2S是否可能通过上调miR-133a表达,进而抑制其下游Ca2+/CaN/NFATc4信号通路的激活,参与调节心肌肥大发生发展过程,目前尚不十分清楚。
本研究应用异丙肾上腺素(isoproterenol,ISO)建立心肌细胞肥大模型,观察心肌细胞肥大时CSE/H2S体系的变化,明确内源性H2S在心肌细胞肥大中的作用,探讨H2S对心肌细胞肥大的调控作用及其机制。
1 材料与方法
1.1 主要试剂
炔丙基甘氨酸(propargylglycine,PAG)(Sigma,USA),rabbit anti-CaN、rabbit anti-NFATc4 (CST,USA),Lipofectamine 2000、Fluo-4/AM(Invitrogen,USA),miRNA-133a antagomir、miRNA-133a-antagmir-NC(吉玛生物技术有限公司)。
1.2 实验方法
1.2.1 心肌细胞培养 新生1~3 d SD大鼠(南通大学动物中心提供),取心脏置D-Hanks液中,将心室肌切碎约1 mm3,加入10 ml 0.125%胰酶搅拌消化。弃上清,细胞移至15%小牛血清DMEM培养液中孵育。将细胞接种于100 mm规格的无菌培养皿中,于5%CO2、饱和湿度的37℃培养箱中放置2 h。孵育后,加入Brdu使其终浓度为0.1 mmol/L。台盼蓝染色观察细胞存活率,细胞计数后接种于6孔培养板。培养48 h后,换无血清DMEM培养基,24 h后加入干预因素[6]。
1.2.2 心肌细胞表面积测定 心肌细胞加ISO持续作用48 h后,在相差显微镜下拍照,每孔取10个视野,每个视野约20个细胞。采用Leica图像分析系统,标尺测量细胞表面积,取平均值。
1.2.3 心肌细胞蛋白含量测定 将6孔板贴壁培养的心肌细胞用胰蛋白酶处理使其脱落悬浮,用细胞计数仪测定细胞数,一个样本的细胞数约为(8~9)×105cells。用BCA法测定心肌细胞总蛋白含量。
1.2.4 RNA提取和qRT-PCR 样品总RNA提取采用TRIzol试剂盒,按说明书步骤提取总RNA。逆转录和 qRT-PCR实验按说明书步骤进行。BNP,β-MHC,CSE,CaN,miRNA-133a,GAPDH引物(上海生工合成)序列如下:BNP上游引物 5’-CAGCTCTCAAAGGACCAAGG-3’,BNP下游引物 5’-CACTGTGGCAAGTTTGTGCT-3’;β-MHC上游引物 5’-AACCTGTCCAAGTTCCGCAAGGTG-3’,β-MHC下游引物 5’-GAGCTGGGTAGCACAAGAGCTACT-3’;CSE上游引物5’-TCCGATGACCTCAACGAAC-3’,CSE下游引物 5’-CGGTAGCCCAGGATAAATAA-3’;CaN上游引物 5’-CCACAGGGATGTTGCCTAGTG-3’,CaN下游引物 5’-GTCCCGTGGTTCTCAGTGGTA-3’;miRNA-133a上游引物 5’-ATGGTTCGTGGGTTTGGTCCCCTTCAACC-3’,miRNA-133a下游引物 5’-GCAGGGTCCGAGGTATTC-3’;GAPDH上游引物 5’-TCTACATGTTCCAGTATGA CTC-3’,GAPDH下游引物 5’-ACTCCACGACATAC TCAGCACC-3’。将配制的溶液置于 qRT-PCR仪中进行扩增,退火温度60℃,15 s。根据目的基因与内参基因的Ct值求得各样本目的基因表达水平。
1.2.5 Western blot检测 CaN、NFATc4蛋白的表达
提取各组心肌细胞总蛋白,BCA试剂盒进行蛋白定量,并调整上样量为30μl。10%SDS-PAGE分离,PVDF膜印迹。室温封闭2 h,加入一抗稀释液(anti-CaN抗体 1∶1 000、anti-NFATc4抗体 1∶1 000、anti-GAPDH抗体 1∶5 000、anti-PCNA抗体 1∶1 000稀释),4℃过夜,然后加入辣根过氧化物酶HRP标记的二抗孵育2 h。ECL化学发光显色,X光片显影、定影。将胶片进行扫描或拍照,美国 UVP公司GDS8000摄取图像,Image J分析软件对条带进行定量分析。
1.2.6 心肌细胞转染 每孔取1.25μl寡聚物稀释至50μl Opti MEM培养液;取 1.5μl lipofectamine 2 000稀释到50μl Opti MEM培养液,加至已稀释的寡聚物中孵育。弃培养基,加入400μl Opti-MEM,加至心肌细胞中,置培养箱培养24 h,换正常培养基,培养24 h后用于检测。用于转染的miRNA-133a抑制剂(miRNA-133a antagomir)和 miRNA-133a抑制剂的阴性对照(miRNA-133a antagomir-NC)。
1.2.7 Elisa法检测心肌细胞内H2S含量 将心肌细胞消化后收集,加入PBS稀释细胞悬液,细胞密度达到1×106cells/ml左右。反复冻融,使细胞破裂。4℃,2 000~3 000 r/min离心20 min,收集上清。BCA试剂盒测定各组蛋白浓度,然后进行心肌细胞内H2S含量测定。以空白孔调零,450 nm波长依序测量各孔吸光度(OD值)。
1.2.8 激光共聚焦显微镜检测心肌细胞钙离子浓度 心肌细胞加入 1 ml PBS(含 5μl Fluo-4/AM),37℃培养箱中避光染色30 min。用PBS洗去荧光染料,将培养板置激光共聚焦显微镜下,对心肌细胞进行扫描,激发波长为488 nm,发射波长为525 nm。将测取的钙荧光图像存入计算机,荧光强度值由Leica激光共聚焦显微镜自带软件Fluoview自动分析。
1.3 统计学分析
实验数据以均数±标准差(±s)表示。应用GraphPad Prism5软件进行统计分析,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果
2.1 H2S对心肌细胞肥大的负性调控作用
在用 10μmol/L ISO诱导心肌细胞肥大前30 min,分别应用100μmol/L NaHS增加细胞内 H2S含量,或应用2 mmol/L PAG降低细胞内H2S含量,观察对心肌细胞肥大的影响。实验分组:(1)对照组、(2)ISO组、(3)NaHS组、(4)NaHS+ISO组、(5)PAG组、(6)PAG+ISO组。结果显示:与对照组相比,ISO组或PAG组CSE mRNA表达均明显降低(P<0.05,P<0.01)。与ISO组比较,NaHS+ISO组CSEmRNA表达显著增加(P<0.01),PAG+ISO组则进一步降低(P<0.05)。NaHS组与对照组相比,无明显差异(图 1A)。
与对照组相比,ISO组心肌细胞内H2S含量降低(P<0.01),NaHS组 H2S含量增加(P<0.01),PAG组细胞内H2S含量降低(P<0.01)。与ISO组相比,NaHS+ISO组 H2S含量增加(P<0.01),而PAG+ISO组则进一步降低(P<0.01,图 1B)。
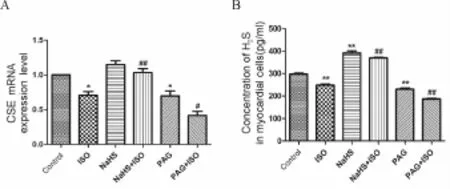
Fig.1 Effects of NaHSand PAGon the level of CSE/H2Sin the ISO-induced cardiomyotytes hypertrophy(±s,n=4)
与对照组相比,ISO组心肌细胞表面积、蛋白含量、BNP和β-MHC mRNA表达均明显增加(P<0.01)。NaHS+ISO组与ISO组相比,心肌细胞表面积、蛋白含量、BNP和β-MHCmRNA表达均明显减少(P<0.05,P<0.01)。PAG+ISO组与 ISO组相比,心肌细胞表面积、蛋白含量、β-MHC和BNPmRNA表达水平均增加(P<0.05,P<0.01)。NaHS或 PAG组与对照组相比,均未见明显差异(图2)。

Fig.2 Effects of negative regulation of H2Son cardiomyocyte hypertrophy(±s,n=4)
2.2 H2S对心肌细胞肥大抑制作用与miRNA-133a及Ca2+/CaN/NFATc4通路的关系
2.2.1 上调或下调 H2S含量对心肌细胞 miRNA-133a及Ca2+/CaN/NFATc4通路的影响 分别应用NaHS或PAG上调或下调心肌细胞内H2S含量,观察对心肌细胞 miR-133a及 Ca2+/CaN/NFATc4信号通路相关因子的影响。实验分组同前。结果显示:与对照组相比,ISO组miR-133a mRNA表达降低、心肌细胞内Ca2+浓度增加、CaN mRNA和蛋白表达均明显增加、NFATc4核转位增强、NFATc4胞浆蛋白表达减少而核蛋白表达增加(P<0.05,P<0.01)。NaHS预处理组明显逆转ISO引起的上述效应。相反,PAG预处理组则进一步增强ISO引起的上述效应(图 3)。
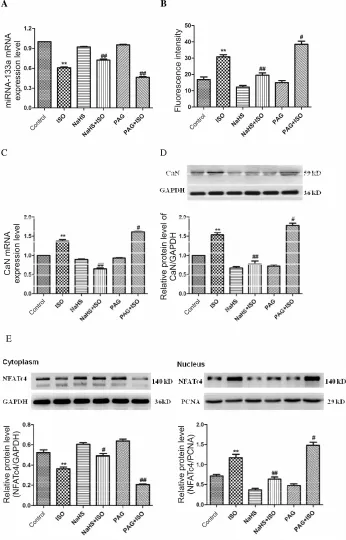
Fig.3 Effects of NaHSor PAG on the miRNA-133a and Ca2+/CaN/NFATc4 pathway in the ISO-induced cardiomyocyte hypertrophy(±s,n=4)
2.2.2 Antagomir-133a干扰对 H2S抑制心肌细胞肥大及miRNA-133a介导的 Ca2+/CaN/NFATc4信号通路的影响 应用miRNA-133a抑制剂antagomir-133a干扰,观察对心肌细胞肥大及Ca2+/CaN/NFATc4通路的影响。首先,检测应用lipofectamine 2 000将antagomir-133a转染至心肌细胞的转染效率。结果显示,将antagomir-133a转染细胞后,可显著降低miRNA-133a的表达水平,其干扰率达95%以上,表明转染效果很好。实验分组:(1)对照组,(2)ISO组,(3)NaHS组,(4)NaHS+ISO组,(5)antagomir-133a+NaHS+ISO组,(6)NC+NaHS+ISO组。
结果显示,与 NC+NaHS+ISO组相比,antagomir-133a+NaHS+ISO组心肌细胞表面积、蛋白含量、BNP和β-MHC mRNA表达增加(P<0.05)。NaHS+ISO组与NC+NaHS+ISO组相比,差异无显著性(图 4A、4B、4C、4D)。
与对照组相比,ISO组miRNA-133a mRNA表达降低、细胞内Ca2+浓度明显增加、CaN mRNA和蛋白表达均增加、NFATc4核转位明显增强、NFATc4胞浆蛋白表达减少而胞核蛋白表达增加(P<0.01)。与ISO组相比,NaHS+ISO组miR-133a mRNA表达升高、细胞内Ca2+浓度明显减少、CaN mRNA和蛋白表达均降低、NFATc4核转位减弱、NFATc4胞浆蛋白表达增加而胞核蛋白表达下降(P<0.05,P<0.01);与NC+NaHS+ISO组相比,antagomir-133a+NaHS+ISO组miRNA-133a表达降低、细胞内Ca2+浓度有所增加、CaN mRNA和蛋白表达增加、NFATc4核转位增强、NFATc4胞浆蛋白表达减少而胞核蛋白表达增加(P<0.05,P<0.01)。NaHS+ISO组与 NC+NaHS+ISO组相比,无统计学差异(图 4E、4F、4G、4H、4I)。

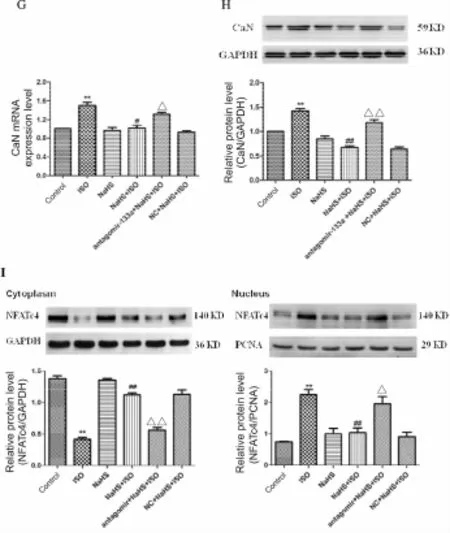
Fig.4 Effects of antagomir-133a interference on cardiomyocyte hypertrophy and miR-133a-mediated Ca2+/CaN/NFATc4 signal pathway(±s,n=4)
3 讨论
本课题组以往的实验表明[7],应用 10μmol/L ISO诱导心肌细胞肥大,可引起心肌细胞肥大的主要指标,即心肌细胞形态和细胞表面积均明显增大,细胞蛋白含量、以及心肌肥大标志基因BNP、β-MHC mRNA表达均增高,表明应用ISO能够成功构建心肌细胞肥大模型。
为了探讨H2S在心肌肥大中的作用,本研究应用ISO诱导心肌细胞肥大,观察心肌细胞内CSE/H2S表达变化。结果表明,ISO诱导的心肌细胞肥大,CSE/H2S水平明显下降。此外,应用 H2S供体NaHS上调细胞内H2S含量,或应用CSE特异性抑制剂PAG降低细胞内H2S含量,观察对心肌细胞肥大的影响。结果发现,NaHS预处理能明显抑制ISO诱导的心肌细胞表面积、蛋白含量以及 BNP、β-MHC mRNA表达水平的增加,提示NaHS能够抑制心肌细胞肥大。相反,应用PAG预处理减少内源性H2S生成,则增强ISO诱导的心肌细胞肥大的效应。
信号转导在心肌肥大的发生发展中是一个中心环节。有文献报道[8],过表达 CaN或 NFATc4的转基因小鼠出生后可出现与人类心肌肥大相似的病理变化,提示心肌细胞内可能存在一条致心肌肥大的信号转导通路,即CaN/NFATc4信号通路。CaN是一种受Ca2+调控的丝氨酸/苏氨酸蛋白磷酸酶。在细胞信号传递的过程中,CaN被Ca2+激活后使胞浆中靶蛋白NFATc4脱磷酸化后入核,继而和核内转录因子GATA4相互作用,激活心肌肥大相关基因表达从而诱导心肌细胞肥大。已有研究[4]证实,CaN是miR-133的下游靶基因。当心肌肥大时,miR-133表达降低、CaN的表达增加且活性增强;而当上调miR-133的表达或抑制CaN的表达则能够对抗心肌肥大。综上分析,我们推测H2S抑制心肌肥大作用可能与 miR-133a介导的 Ca2+/CaN/NFATc4通路相关。为了验证两者的关系,本研究分别应用NaHS或PAG预处理增加或减少心肌细胞内H2S的水平,观察对心肌细胞中 miR-133a表达、以及对 Ca2+/CaN/NFATc4信号通路的影响。结果发现,ISO刺激能使心肌细胞miR-133a表达降低、细胞内Ca2+浓度增加、CaN mRNA及蛋白表达增加、NFATc4核蛋白表达增加及核转位增强。应用NaHS增加细胞内H2S水平,可明显抑制ISO诱导的上述效应;而应用PAG减少心肌细胞内H2S的生成,则明显增强ISO诱导的肥大作用。
为了进一步探讨H2S抑制心肌细胞肥大作用与miR-133a介导的 Ca2+/CaN/NFATc4信号通路的关系,本实验应用miR-133a抑制剂antagomir-133a干扰ISO诱导的心肌细胞,观察对心肌细胞肥大及Ca2+/CaN/NFATc4信号通路的影响。结果发现,antagomir-133a能进一步加强ISO诱导的心肌细胞肥大效应,并增加ISO诱导的心肌细胞内Ca2+浓度、CaN mRNA和蛋白表达及NFATc4胞核蛋白表达、增强NFATc4核转位。此外,antagomir-133a还能部分逆转H2S抑制心肌细胞肥大的作用。
综上所述,H2S可通过负性调控作用抑制心肌细胞肥大。心肌细胞肥大发生可能与CSE/H2S体系功能降低,内源性H2S合成减少有关。H2S负性调控心肌细胞肥大的作用可能与H2S上调miRNA-133a的表达,抑制其下游 Ca2+/CaN/NFATc4信号通路的激活有关。本研究进一步阐明H2S对心肌细胞肥大的调控作用及其机制,将有助于全面了解心肌肥大的病理机制,并为该疾病的防治提供新的思路和理论依据。
【参考文献】
[1] Wang R.Physiological implications of hydrogen sulfide:A whiff exploration that blossomed[J].Physiol Rev,2012,92(4):791-896.
[2] Chen JT,Gao J,Sun WM,et al.Involvement of exogenous H2Sin recovery of cardioprotection from ischemic post-conditioning via increase of autophagy in the aged hearts[J].Int J Cardiol,2016,220(10):681-692.
[3] Predmore BL,Lefer DJ,Gojon G.Hydrogen sulfide in biochemistry and medicine[J].Antioxid Redox Signal,2012,17(1):119-140.
[4] Chen C,Huo R,Wang N,et al.Reciprocal repression between microRNA-133 and calcineurin regulates cardiac hypertrophy:a novel mechanism for progressive cardiac hypertrophy[J].Hypertension,2010,55(4):946-952.
[5] Small EM,Olson EN.Pervasive roles of microRNAs in cardiovascular biology[J].Nature,2011,469(7330):336-342.
[6] 吴 扬,耿 鹏,王玉琴,等.MicroRNA-1在心肌肥大中对L-型钙通道β2亚基的负性调控作用[J].中国应用生理学杂志,2012,28(4):304-308.
[7] 吴 扬,王宝霞,郭媛媛,等.PPAR-α对心肌肥大负性调控作用及与 PI3K/Akt/mTOR通路的关系[J].中国应用生理学杂志,2015,31(3):284-288.
[8] Wilkins BJ,Molkentin JD.Calcium-calcineurin signaling in the regulation of cardiac hypertrophy[J].Biochem Biophys Res Commun,2004,322(4):1178-1191.
