细胞粘附分子CHL1缺失对炎症性肠病的影响*
2018-05-15王晓萌朱玲玲吴奎武
王晓萌,赵 彤,成 祥,郭 宁,朱玲玲,施 明,吴奎武△
(1.军事科学院军事医学研究院认知与脑科学研究所,北京100850;2.徐州医科大学肿瘤生物治疗研究所,江苏徐州221004)
炎症性肠病(inflammatory bowel disease,IBD)包括溃疡性结肠炎和克罗恩病,是一种胃肠道的炎症性疾病,伴随着严重的病理学变化,预后不佳,病因未明[1]。IBD在欧美国家高发,在亚洲和南美洲,IBD的患病率也日益增高[2,3]。IBD的病因主要与环境、免疫、遗传等因素有关,反复发作的机制尚不清楚。部分观点认为,肠道慢性炎症的发生与肠道粘膜免疫缺陷有关[4,5]。近年来的研究发现,细胞黏附分子在肠道炎症发展的过程中起重要作用[5,6]。CHL1是一种在人体内普遍表达的神经细胞黏附分子(neural cell adhesion molecule,NCAM),在以往的研究中,发现它对成人神经回路轴突形成、神经元的生长和存活有着至关重要的作用[7,8]。另一方面,CHL1与结直肠癌删除分子(deleted in colorectal carcinoma,DCC)有相似的结构域。有研究表明,CHL1在结肠癌病人的结肠组织中表达降低[9,10]。但CHL1与炎症性肠病之间的关系尚缺乏探讨。本研究利用葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导小鼠结肠炎模型,探讨CHL1缺失对DSS诱导的小鼠结肠炎症的影响,以揭示CHL1在炎症性肠病的发生中的作用。
1 材料与方法
1.1 材料
1.1.1 动物 C57BL/6小鼠,雄性,16~20 g,购自军事科学院医学研究院动物中心;C57BL/6背景的CHL1(-/-)小鼠,雄性,16~20 g,繁殖于军事医学科学院动物中心。
1.1.2 试剂和仪器 DSS(MP Biochemical,US);其他常用化学试剂和实验器材均购自军事科学院医学研究院试剂库及条件处。
1.2 实验方法
1.2.1 动物实验 C57BL/6遗传背景的 CHL1(+/+)和 CHL1(-/-)小鼠饲养于军事科学院医学研究院SPF动物室,恒温23℃~26℃,恒湿40%~60%,保持每日 12 h(8:00~20:00)光照时间。使用普通生长饲料和三蒸水饲养,自由饮水饮食,每日加食,换水。每次实验前,随机区组设计法分组,参照体重值将小鼠分为数个体重相近的区组,之后按照随机数表,分为对照组,DSS模型组,CHL1缺失组,CHL1缺失DSS模型组(n=5)。
1.2.2 CHL1(-/-)小鼠炎症性肠病模型的建立 将10只C57/BL6为遗传背景的 CHL1(+/+)型小鼠按照随机原则分为数量相等的对照组和DSS模型组(n=5);将 10只 C57/BL6为背景的 CHL(-/-)型小鼠按照随机原则分为数量相等的CHL1缺失组和CHL1缺失DSS模型组(n=5);采用 DSS饲养小鼠诱导炎症性肠病模型;DSS模型组和CHL1缺失DSS模型组自主饮用7 d含1.5%DSS蒸馏水,随后改为蒸馏水饲喂2 d;对照组和CHL1缺失组饮用9 d蒸馏水,9 d后处死小鼠。
1.2.3 粪便隐血评分 用200μl枪尖随机挑取粪便至载玻片,用50μl PBS稀释,盖上载玻片,于高倍镜下观察红细胞个数。粪便隐血的评分由多名专业人员采取双盲法进行评分顶级,隐血评分根据红细胞的个数分为6个等级:(1)无隐血:镜下没有红细胞;(2)怀疑隐血:1~9个;(3)有隐血:10~30个;(4)轻度隐血;镜下红细胞大于30个;(5)中度隐血:镜下红细胞占2/3个视野;(6)重度隐血:镜下红细胞占全视野。
1.3 统计学处理
采用SAS 9.1进行统计学分析,计量资料均用均数±标准差(±s)表示,组间方差齐采用方差分析,组内两两比较采用Bonferroni法;生存资料采用Log-Rank生存分析;计数资料采用Kruskal-wallis秩和检验。
2 结果
2.1 CHL1缺失对DSS诱导的炎症性肠病模型小鼠体重的影响
与对照组相比,DSS模型组小鼠炎症性肠病的表现并不强烈,只是出现了一定程度体重减轻,但是CHL1缺失DSS模型组小鼠从刺激的第7天开始,体重明显减轻(P<0.01,表1)。
Tab.1 Comparison of body weight,the percent of weight change among different groups(±s,n=5)

Tab.1 Comparison of body weight,the percent of weight change among different groups(±s,n=5)
A:CHL1(+/+);B:DSS-induced CHL1(+/+);C:CHL1(-/-);D:DSS-induced CHL1(-/-)**P<0.01 vs A group
Time Body weight(g )A B C D A Percent of weight change(%)B C D Day 1 17.80±0.91 18.05±0.88 20.02±3.06 18.71±1.57 0±0 0±0 0±0 0±0 Day 3 18.94±1.04 19.03±1.81 21.97±2.40 20.45±1.9 6.35±0.89 5.30±6.32 10.40±6.36 9.21±1.28 Day 5 18.67±0.68 18.87±1.12 21.30±2.22 17.85±1.77 4.91±1.64 4.52±1.62 7.08±6.23-4.71±2.67 Day 7 19.06±0.25 18.34±1.19 21.98±1.97 14.80±1.86**7.24±4.25 1.55±1.89 10.77±8.71-21.08±4.70**Day 9 19.91±0.74 18.19±2.11 22.10±1.54 11.49±2.09**11.88±1.96 0.54±7.41**11.66±10.59-37.30±8.06**
2.2 CHL1缺失对DSS诱导的炎症性肠病模型小鼠死亡率的影响
随着炎症性肠病的发展,以C57/BL6为背景的DSS模型组小鼠并未出现死亡。但是,CHL1缺失模型组小鼠小鼠从第7天开始死亡,至DSS诱导的第9天死亡率高达80%,进行生存分析后显示,Log-Rank值为 15.42(P<0.01)。
2.3 CHL1缺失加重DSS诱导的炎症性肠病模型小鼠便血
以C57/BL6为背景的DSS模型组,炎症性肠病的表现并不明显,仅出现一定程度的粪便隐血(P<0.01)。与DSS模型组相比,CHL1缺失 DSS模型组小鼠,粪便隐血增多,从刺激的第7天开始,出现了明显的便血,便血评分明显升高(P<0.01,表2)。
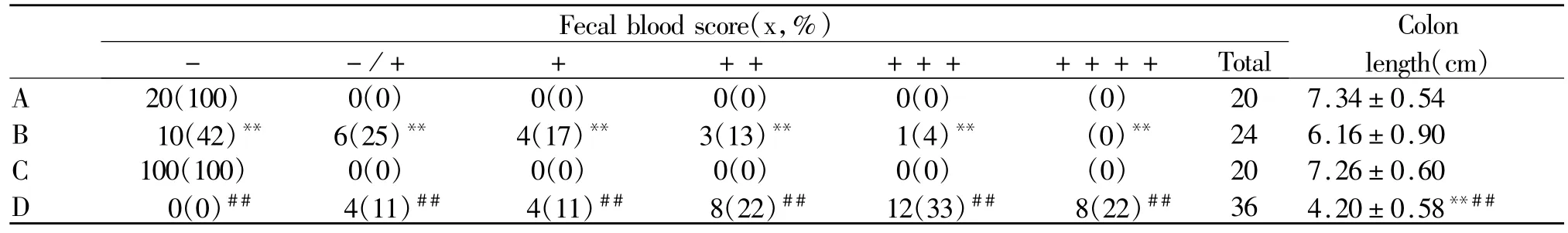
Tab.2 Comparison of fecal blood score and colon length among different groups
2.4 CHL1缺失对DSS诱导的炎症性肠组织的影响
小鼠结肠测量长度分析显示:CHL1缺失DSS模型组小鼠,与DSS模型组对比,其结肠组织明显缩短(P<0.01,图 1,表 2),这些现象都提示了 CHL1缺失加重了DSS诱导的炎症性肠病。

Fig.1 Changes of colon length after CHL1 deficiency on DSS-induced colitis
3 讨论
CHL1属于神经细胞黏附分子L1家族成员,是由CHL1基因(又名 L1CAM2)编码。2002年,CHL1基因敲除小鼠构建成功。这大大促进了对CHL1体内功能的研究。已有研究表明,CHL1在神经细胞的生存、增殖和分化中发挥重要作用。例如,在创伤修复过程中,CHL1参与神经突触形成、神经突触发生、神经突触可塑性和神经再生等过程[11]。在CHL1基因敲除小鼠中可观察到大脑皮质、嗅球和海马部位的形态改变和神经突触功能异常[12]。本实验室的前期工作中发现,敲除CHL1可抑制神经干细胞的增殖和分化[13]。最近的研究发现,CHL1还参与除神经系统以外的病理生理过程。例如,有研究报道CHL1在多种肿瘤中表达降低,是潜在的抑癌分子[14]。但截至目前为止,还没有CHL1参与炎症调控的相关报道。本研究应用DSS诱导的小鼠炎症性肠病模型发现,CHL1缺失可显著加重炎症性肠病的进展。这可能对于发现CHL1的新功能具有重要意义。
中枢神经系统与肠道联系起来的神经、内分泌网络成为“脑-肠轴”。脑-肠通讯把中枢神经信号,肠神经系统及包括免疫反应在内的肠功能有机联系在一起。参与脑-肠对话的任一环节功能异常均就有可能影响肠道的炎症反应[15]。慢性心理应激诱发的肾上腺素能神经信号可加速DSS诱导的小鼠炎症性肠病进程,伴随着炎症因子 IL-1β、IL-6及TNF-α的升高,以及 NF-κB信号通路的激活[16-18]。这些结果提示,神经系统和神经信号参与了炎症性肠病的发生发展。见于CHL1在神经系统中的重要工作,本研究的发现可能为阐明“脑-肠轴”或神经信号调控肠道炎症反应的机制提供了重要线索。
但是,由于本研究应用的 CHL1动物模型为CHL1基因全身敲除小鼠,目前还不能准确解析CHL1参与炎症性肠病进程的精确机制。后续的研究需要应用CHL1基因组织特异性敲除的小鼠进行深入研究。
【参考文献】
[1] Mikocka-Walus AA,Turnbull DA,Moulding NT,et al.Controversies surrounding the comorbidity of depression and anxiety in inflammatory bowel disease patients:a literature review[J].Inflamm Bowel Dis,2007,13(2):225-234.
[2] Ng WK,Wong SH,Ng SC.Changing epidemiological trends of inflammatory bowel disease in Asia[J].Intest Res,2016,14(2):111-119.
[3] Kaplan GG.The global burden of IBD:from 2015 to 2025[J].Nat Rev Gastroenterol Hepatol,2015,12(12):720-727.
[4] Ahmad R,Sorrell MF,Batra SK,et al.Gut permeability and mucosal inflammation:bad,good or context dependent[J].Mucosal Immunol,2017,10(2):307-317.
[5] Cromer WE,Mathis JM,Granger DN,et al.Role of the endothelium in inflammatory bowel diseases[J].World J Gastroenterol,2011,17(5):578-593.
[6] Nieves JR,Gorfu G,Ley K.Leukocyte adhesion molecules in animal models of inflammatory bowel diseases[J].Inflamm Bowel Dis,2008,14(12):1715-1735.
[7] Rolf B,Lang D,Hillenbrand R,et al.Altered expression of CHL1 by glial cells in response to optic nerve injury and intravitreal application of fibroblast growth factor-2[J].JNeurosci Res,2003,71(6):835-843.
[8] Nishimune H,Bernreuther C,Carroll P,et al.Neural adhesion molecules L1 and CHL1 are survival factors for motoneurons[J].J Neurosci Res,2005,80(5):593-599.
[9] Holm J,Hillenbrand R,Steuber V,et al.Structural features of a close homologue of L1(CHL1)in the mouse:a new member of the L1 famliy of neural recognition molecules[J].Eur J Neurosci,1996,8(8):1613-1629.
[10]Fearon ER,Cho KR,Nigro JM,et al.Identification of a chromosome 18q gene that is altered in colorectal cancers[J].Science,1990,247(4938):49-56.
[11]Jakovcevski I,Wu J,Karl N,et al.Glial scar expression of CHL1,the close homolog of the adhesion molecule L1,limits recovery after spinal cord injury[J].J Neurosci,2007,27(27):7222-7233.
[12]Schmalbach B,Lepsveridze E,Djogo N,et al.Age-dependent loss of parvalbumin-expressing hippocampal interneurons in mice deficient in CHL1,a mental retardation and schizophrenia susceptibility gene[J].J Neurochem,2015,135(4):830-844.
[13]Huang X,Zhu LL,Zhao T,et al.CHL1 negatively regulates the proliferation and neuronal differentiation of neural progenitor cells through activation of the ERK1/2 MAPK pathway[J].Mol Cell Neurosci,2011,46(1):296-307.
[14]Senchenko VN,Krasnov GS,Dmitriev AA,et al.Differential expression of CHL1 gene during development of major human cancers[J].PLoSOne,2011,6(3):15612.
[15]Bonaz BL,Bernstein CN.Brain-gut interactions in inflammatory bowel disease[J].Gastroenterol,2013,144(1):36-49.
[16]Deng Q,Chen H,Liu Y,et al.Psychological stress promotes neutrophil infiltration in colon tissue through adrenergic signaling in DSS-induced colitis model[J].Brain Behav Immun,2016,57:243-254.
[17]于 正,刘红菊,顿桓桓,等.白头翁汤对炎症性肠病中促炎细胞因子表达的影响[J].中国应用生理学杂志,2011,27(4):416-419.
[18]黄循铷,王承党,王瑞幸,等.溃疡性结肠炎小鼠肠道通透性改变与 TNF-α及NF-κB P65的关系[J].中国应用生理学杂志,2016,32(2):112-115.
