创伤性脂肪栓塞综合征的肺部CT表现和临床意义
2018-05-11华群王华潘云萍李飞鹏李先玉
华群 王华 潘云萍 李飞鹏 李先玉
脂肪栓塞综合征(fat embolism syndrome,FES)最常见的原因是骨折,特别是发生在年轻患者中的长骨骨折,肺循环和体循环栓塞是因为骨折处的脂肪滴释放进入静脉血流[1]。同时,在骨关节手术中,髓内钉的置入、膝关节及髋关节置换术均可引起FES[2]。严重的FES发病急骤,病势凶险,死亡率较高[3]。本文收集了本院2010年1月至2016年8月经临床诊治后证实的各种创伤所致的FES共69例患者,对其肺部CT表现特点进行归纳,并据此进行分型和探讨,旨在提高对FES的诊治水平。
1 资料和方法
1.1 一般资料 本组共69例,男52例,女17例,年龄14~72(43.6±15.0)岁。骨折 64例,其中多发骨折 46例,单发骨折18例(股骨骨折14例,胫骨骨折3例,肱骨近端骨折1例);髋关节置换术后2例,其中1例死亡;髌骨骨折拆内固定术后1例;左股骨转子间骨折术后1例;软组织挫伤1例。临床诊断标准参照Gurd等[4]提出的FES诊断标准。
1.2 胸部CT检查 所有患者均行胸部CT检查,其中2例行胸部CT增强扫描。使用PHILIPS Brilliance六排螺旋CT机,Siemens Somatom Definition AS 64排螺旋CT机;扫描层厚5mm,层间距5mm;螺距1.5,电压120kV,电流130mA;胸部CT增强使用碘比醇(法国Guerbet公司)100ml,高压注射器以3ml/s速率经肘静脉团注,扫描时相动脉期延迟25s,静脉期延迟70s。
2 结果
本组69例患者除1例院外发病5d后再入院死亡外,其余68例经积极治疗,病灶吸收。胸腔少量积液48例,胸腔中等量积液11例,无胸腔积液10例。69例患者心脏均未见明显增大。除1例死亡未复查,其余68例从第1次CT检查发现病变到明显吸收或完全吸收为2~35(10.3±6.7)d。2 例增强扫描各肺动脉分支均未见明显充盈缺损。为了提高对FES的认识、预判疾病的转归,对本组69例患者胸部CT影像学表现特点进行归纳、分型(均以第1次CT检查图像为标准进行分类),其中肺泡型28例,间质型9例,混合型32例。
2.1 肺泡型 以肺实质病变为主,部分可以有少许间质改变。除1例死亡未复查外,其余27例患者吸收时间为2~23(9.1±5.0)d。按病灶多少、形态及密度高低,归纳为 4种表现:(1)Ⅰ型 10 例,平均吸收时间(7.3±4.9)d,两肺各叶均有病灶,表现为多发斑片状及小片状略高密度影,可以散在分布或弥漫分布,边缘模糊;病灶之间常间隔有正常肺组织。肺间质一般无明显增厚。只有斑片状密度影的FES,笔者认为是轻型,临床症状相对较轻,预后较好(图1)。(2)Ⅱ型 6例,平均吸收时间(7.5±2.3)d,两肺均匀或较均匀弥漫磨玻璃密度影,基本覆盖两肺,看不到正常密度肺组织,但仍可显示肺血管纹理,有时候仅表现肺野透亮度减低。肺间质无明显改变(图2)。(3)Ⅲ型 8例,平均吸收时间(7.9±4.4)d,两肺云雾状背景下的多发腺泡结节、磨玻璃结节及不规则实变影,早期边缘较清,大小不等或相仿,病灶密度较前两型高;可融合成大片状高密度影,并按重力梯度分布(病灶前少后多);短期复查边缘模糊,部分吸收表现为多发斑片状影(图3)。(4)Ⅳ型4例,其中1例死亡,其余3例平均吸收时间(14.7±8.5)d,两肺弥漫分布的多形性病灶,有斑片影、腺泡结节和磨玻璃结节,并融合成大片高密度影,呈暴风雪样改变;可以有部分间质增厚。笔者认为是FES的重型,来势凶险,有较高的致死率,必须高度重视(图4)。

图1 FES肺泡型Ⅰ型,两肺弥漫分布斑片状密度增高影,其间尚夹杂正常肺组织
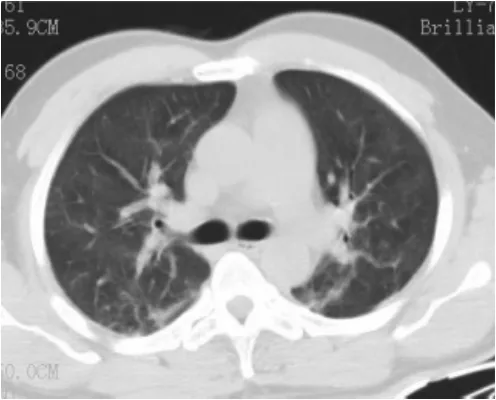
图2 FES肺泡型Ⅱ型,两肺磨玻璃密度影,密度较均匀,未见明确边界,肺血管纹理仍可见
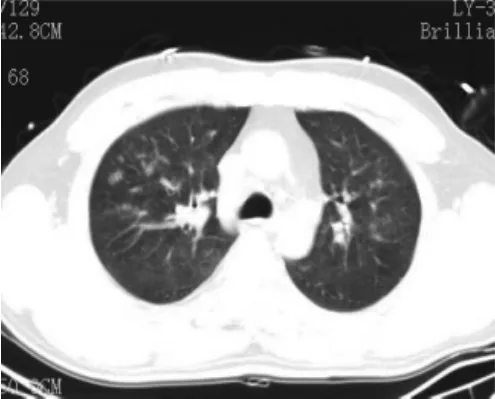
图3 FES肺泡型Ⅲ型,磨玻璃背景下两肺上叶多发腺泡结节影,边界较清
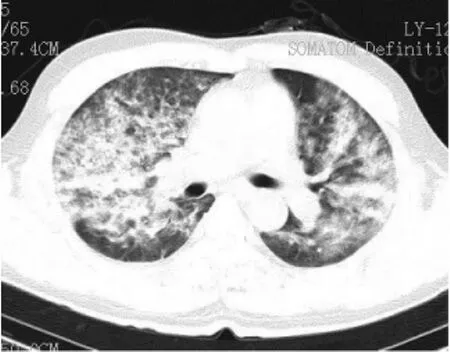
图4 FES肺泡型Ⅳ型,两肺弥漫分布多形性病灶,呈暴风雪样
2.2 间质型 吸收时间为6~35(15.2±9.3)d。以小叶间隔、小叶内间质或肺泡壁增厚为主,边缘相对较清,严重者呈蜂窝状改变(图5);肺泡内渗出较少见。经治疗后间质增厚程度减轻,出现肺泡内渗出,表现为斑片状及淡薄磨玻璃结节影。
2.3 混合型 吸收时间为2~27(9.8±6.5)d。既有肺泡病变,又夹杂间质增厚,肺泡病变常重于间质(图6)。早期表现为两肺上叶尖段小叶间隔增厚,下叶基底段小叶间隔部分可增厚,间质增厚程度比间质型轻,范围比较局限;短期复查,小叶间隔恢复正常或略增厚,肺泡病变吸收相对较慢。

图5 FES间质型,广泛间质增厚呈蜂窝样改变

图6 FES混合型,既有肺泡病变,又有间质增厚,肺泡病变往往重于间质
3 讨论
3.1 发病机制 创伤后肢体肿胀,甚至形成血肿,骨髓腔及周围软组织张力明显增高,且静脉系统开放、撕裂,脂肪滴容易进入静脉血流,引起肺栓塞。脂肪滴进入肺部血管引起肺损伤的机制目前尚不明确,但至少有3种机制被认为起重要作用:(1)脂肪滴直接机械性阻塞肺血管;(2)水解中性脂肪产生游离脂肪酸,增加毛细血管通透性,破坏肺泡结构、肺表面活性物质及血小板聚集;(3)脂肪滴刺激局部释放血清素、组胺等,引起出血、水肿、血管破裂[5-6]。
3.2 诊断 目前还没有用于诊断FES的实验室检查金标准[7],而且经常由于非特异性临床表现与创伤后或手术后呼吸窘迫等其他原因重叠而延迟诊断与治疗。虽然肺部影像表现被认为是非特异性的,但胸部CT检查在疑似FES患者的诊断中起重要作用[8]。有学者认为在大多数情况下,诊断可以通过经典的临床综合症状结合典型的影像学表现来实现[9-11]。胸部CT表现形式多样,以往经典文献均未进行分型,仅描述以肺实质为主的影像学表现;而本组患者中有间质改变者41例,占59.4%,因此有必要对FES进行详细分型,以提高对FES的认识、预判疾病的转归,有效减低致残率和致死率。通过对本组69例患者胸部CT表现进行归纳、分型,笔者认为FES的胸部CT表现具有以下特点:(1)本组所有患者均表现为两肺多发或弥漫分布病灶,两肺各叶均累及。(2)肺泡型的Ⅰ和Ⅱ型临床症状、影像学表现较轻,吸收、恢复较快。(3)肺泡型的Ⅲ型具有典型的多发腺泡结节特点,可随机分布,常为类圆形,边缘较清、但欠光整,边界不如转移瘤、血行播散性感染结节光整;常融合成大片状高密度影,并按重力梯度分布[12],靠前侧病灶较少、密度较低,靠背侧病灶较多、融合、密度较高。(4)肺泡型的Ⅳ型呈暴风雪样改变,本组仅出现4例,与以往文献报道不同。(5)间质型表现为两肺广泛间质增厚,重者呈蜂窝状,边界相对较清。后期间质恢复正常,出现肺泡内渗出,呈多发斑片状、小片状影,边缘模糊。吸收时间最长。(6)混合型早期尖段及基底段小叶间隔增厚,小叶中心区域见棉絮状较高密度影;短期内间质恢复正常,仅存肺泡内病灶。因此吸收时间短于间质型。
3.3 鉴别诊断 (1)肺挫伤及创伤性湿肺:直接撞击或气浪冲击胸部,伤后即有胸痛、胸闷、胸廓挤压痛。肺挫伤多发生在直接暴力部位,通常是单侧和不对称的;创伤性湿肺可发生在两肺。病理改变为毛细血管及肺泡损伤,肺间质及肺泡内血液、渗出液积聚,一般于受伤后即刻或伤后6h左右出现肺部病灶,24~48h开始吸收,3~4d可完全吸收。相反,FES是在创伤的潜伏期后出现,并且肺部改变通常是双侧和弥漫性的各叶受累。本组患者除1例外均发生于住院期间,入院常规X线胸片或胸部CT检查,均未发现肺部外伤性病灶,可以鉴别。(2)肺水肿:肺水肿是肺部血管外液体增多,过多的液体积聚在肺间质和终末气腔内。间质型肺水肿CT表现为小叶间隔增厚,肺纹理(支气管血管束)增粗、模糊;肺泡型肺水肿多数为中央型分布,蝶翼征是典型表现,边缘常模糊,肺野外围轻微或正常,常合并心脏增大;病变动态变化较快。本组患者均未发现心脏增大征象;其中1例表现两肺多发斑片状、大片状影,呈中心型分布,类似蝶翼状(图7),但边缘较清,而且心脏大小正常。(3)肺部感染:一般有典型的临床表现,常为局部病灶,按肺叶、肺段解剖分布,鉴别一般不难。
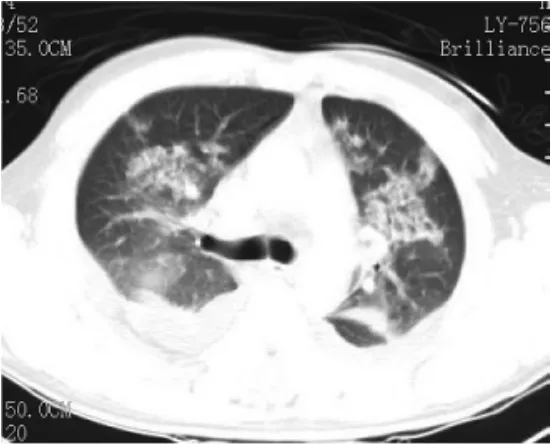
图7 FES肺泡型Ⅲ型,两肺多发斑片状、片状密度增高影,呈蝶翼状,需与肺水肿鉴别
[1]Akhtar S.Fat embolism[J].Anesthesiolclin,2009,27(3):533-550.
[2]Saigal R,Mittal M,Kansal A,et al.Fat embolism syndrome[J].J A-ssoc Physicians India,2008,56:245-249.
[3]Felman F,Ellis K,GreenWM.The fat embolism syndrome[J].Radioology,1975,114(3):535-542.doi:10.1148/114.3.535.
[4]Gurd AR,Wilson RI.The fat embolism syndrome[J].J Bone Joint S-urg Br,1974,56B(3):408-416.
[5]Peltier LF.Fat embolism.A perspective[J].Clin Orthop Relat Res,1998,232:263-270.
[6]Frase RS,Pare JAP,Frase RG,et al.Embolic and thrombotic diseases of the lungs.In:Synopsis of diseases of the chest[M].2nd Edition.Philadelphia:Saunders,1994:558-562.
[7]Dudney TM,Elliott CG.Pulmonary embolism from amniotic fluid,fat,and air[J].Prog Cardiovasc Dis,1994,36(6):447-474.
[8]Newbigin K,Souza CA,Armstrong M,et al.Fat embolism syndrome:Do the CTfindings correlate with clinicalcourse and severity of symptoms?Aclinical-radiologicalstudy[J].European JournalofRradiology,2016,85(2):422-427.doi:10.1016/j.ejrad.2015.11.037.
[9]Kosova E,Bergmark B,Piazza G.Fat embolism syndrome[J].Circulation,2015,131:317-320.doi:10.1161/CIRCULATIONAHA.114.010835.
[10]Newbigin K,Souza CA,Torres C,et al.Fat embolism syndrome:State-of-the-art review focused on pulmonary imaging findings[J].RespirtoryMedicine,2016,113:93-100.doi:10.1016/j.rmed.2016.01.018.
[11]Gurd AR.Fatembolism:an aid to diagnosis[J].J Bone JointSurg Br,1970,52(4):732-737.
[12]Piolanti M,Dalpiaz G,Scaglione M,et al.Fat embolism syndrome:Lung computed tomography findings in 18 patients[J].J C-omput Assist Tomogr,2016,40 (3):335-342.doi:10.1097/RCT.0000000000000376.
