超声在剖宫产瘢痕妊娠早期诊断及子宫动脉化疗栓塞术中的应用
2018-05-11苗立友徐文健张蕾查文王咏梅曹荔
苗立友 徐文健 张蕾 查文 王咏梅 曹荔
剖宫产瘢痕妊娠(CSP)是剖宫产远期风险之一,占有剖宫产史异位妊娠的6.1%[1]。随着剖宫产率的逐年增加,CSP的发病率也在逐年增长[2]。随着瘢痕处孕囊的生长发育,可导致难以控制的大出血、子宫破裂等严重并发症,甚至危及孕妇的生命。因此,早期诊断和有效治疗十分重要。但瘢痕妊娠无特征性临床表现,妇科检查无法触及,临床早起诊断较困难,目前临床上多采用子宫动脉化疗栓塞术(UACE)治疗。本文旨在对超声在CSP早期诊断及治疗中的应用价值作进一步探讨。
1 对象和方法
1.1 对象 选取2015年10月至2016年8月因CSP在本院接受UACE治疗的患者71例,年龄24~40(32.44±4.51)岁;孕次 1~8(2.92±1.35)次;均有剖宫产史,1次者58例,2次者13例;此次怀孕距首次剖宫产时间 12~192(82.99±47.86) 个月;停经时间 38~100(52.86±11.27)d。其中51例有阴道不规则流血史,流血时间 1~32(8.96±8.40)d;4 例患者因外院误诊为难免流产而盲目行人工流产术致使出血量多急诊转入本院;3例因药物流产不全行清宫术后出血量多转入本院。
1.2 仪器 采用SEQUOIA 512及PHILIPS HD15彩色多普勒超声诊断仪,腹部超声探头频率为3.5~5.5MHz。
1.3 方法
1.3.1 超声检查 患者取仰卧位,适度充盈膀胱,于患者耻骨联合上作纵、横、斜多切面扫查子宫及其附件,重点扫查宫腔及子宫瘢痕,发现孕囊或包块,仔细辨别其与子宫瘢痕部位的关系,并对妊娠物的大小、回声、形态及瘢痕处肌层的连续性进行观察,并行彩色多普勒(CDFI)及脉冲多普勒(PW)检查,观察其周边血流情况及其频谱特点,并记录血流参数。
1.3.2 治疗及监测 每例患者均行UACE,UACE后3~6d行超声复查,当孕囊或包块周边血供明显减少或消失时,在超声监测下行清宫术,重点监测瘢痕处肌层厚度及孕囊或包块,引导手术器械精准去除瘢痕处异物。术后行超声随访检查直至月经来潮和瘢痕部位包块消失。孕囊血流信号分为无血流信号(不丰富)、点状及短棒状血流信号(稍丰富)、半环状及环状血流信号(丰富)。
2 结果
2.1 UACE术前CSP的超声表现
2.1.1 瘢痕处孕囊部分突入型(图1) 本组患者31例,孕囊少部分位于瘢痕处肌层内,大部分位于宫腔,瘢痕处肌层薄弱,厚度0.1~0.5cm,CDFI示瘢痕处见丰富血流信号,为低阻力血流频谱,脐动脉血流阻力指数(RI)为0.31~0.52。部分患者表现出典型的滋养层血流特征,孕囊外形呈“泪滴”状,孕囊种植在瘢痕宫腔侧,向宫腔内生长,可能因孕囊略受牵拉而成“泪滴”样改变,可作为其特征性改变之一。
2.1.2 瘢痕处孕囊完全突入型(图2) 本组患者33例,宫区下段膨大,剖宫产瘢痕处肌层内见圆形或椭圆形孕囊,且向膀胱方向外突,活胎时可见原始心管搏动,瘢痕处肌层明显变薄,厚度0~0.4cm。部分患者于宫腔见少许无回声区,CDFI示孕囊周围见环状或半环状丰富血流信号,呈低速低阻型血流频谱,RI为0.34~0.58。
2.1.3 瘢痕处包块型(图3) 本组患者7例,瘢痕处见以实性为主并伴有蜂窝样或不规则暗区的混合回声包块且向膀胱方向隆起,瘢痕处肌层菲薄,厚度0.1~0.3cm,CDFI示包块周边见丰富血流信号,以低阻力血流频谱为主,RI为 0.27~0.51。
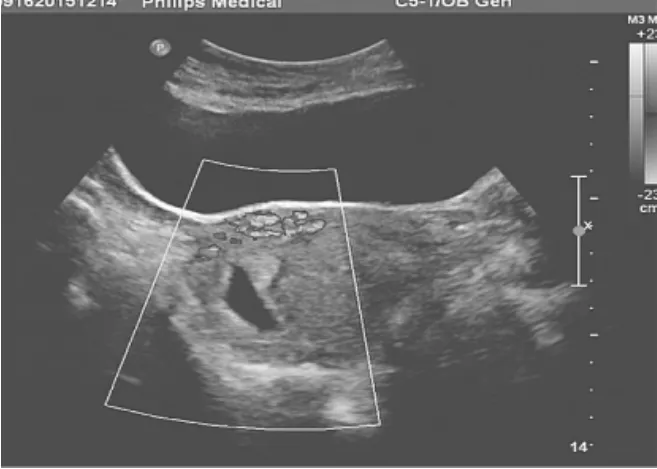
图1 瘢痕处孕囊部分突入型CSP,UACE前超声示瘢痕处血流丰富
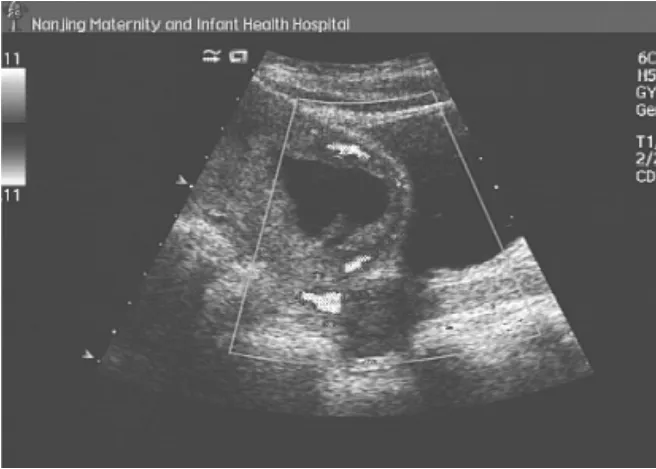
图2 瘢痕处孕囊完全突入型CSP,UACE前超声示孕囊周边见半环状丰富血流信号

图3 瘢痕处包块型CSP,UACE前超声示瘢痕处包块周边血流信号丰富
2.2 UACE后3~6d超声表现 二维超声:29例孕囊透声欠佳,周边回声增强;5例包块回声更不均匀;2例包块内见坏死液性暗区;其余35例二维超声未见明显改变。CDFI:63例孕囊或包块周边血流信号消失,8例仅见稀疏的点状血流信号,见表1和图4-6。PW:4例可探及低速的静脉频谱。

表1 CSP在UACE前后瘢痕处病灶的血流信号丰富程度比较


图5 瘢痕处孕囊完全突入型CSP,UACE 3d后超声示孕囊周边仅见点状血流信号

2.3 UACE后3~6d行超声下清宫术及术后动态随访情况 71例CSP患者均行超声引导下清宫术,刮出物病理报告均见绒毛组织。62例术后超声瘢痕处无包块形成;5例完全突入型CSP术后瘢痕处有包块形成,经超声随访,包块逐渐缩小,3~5个月内包块均消失;3例完全突入型CSP行清宫术后瘢痕处有包块,且反复出血,经超声随访包块大小改变不明显,均行宫腔镜下妊娠残留物电切术;1例完全突入型CSP清宫术后瘢痕处形成包块较大向外突且持续出血,行经阴道子宫瘢痕妊娠去除术+子宫修补术。71例患者血绒毛膜促性腺激素(HCG)均于术后2~3周降至正常,35~50d内月经恢复。
3 讨论
3.1 CSP的超声诊断价值 CSP的发生机制尚不明确,以往多数学者认为可能是剖宫产瘢痕愈合不良,在瘢痕和子宫内膜之间存在裂隙,孕囊在此裂隙或其附近着床,滋养细胞逐渐入侵甚至穿透子宫肌层[3-5]。有学者提出CSP超声诊断标准:宫内及宫颈管内无妊娠囊,妊娠囊生长在子宫峡部前壁,膀胱和妊娠囊之间肌壁薄弱,彩超在病灶处记录到滋养层周围血流频谱特征[6-7]。本组研究示31例瘢痕处孕囊部分突入型与7例瘢痕处包块型CSP在UACE后经超声引导下清宫术后,瘢痕处均未见包块形成。33例瘢痕处孕囊完全突入型CSP在清宫术后,有5例瘢痕处形成包块,后于3~5个月自行消失;4例清宫术后瘢痕处包块形成,由于包块较大且血流丰富,后均行手术治疗。由于不同分型的CSP的治疗结果不同,超声对CSP明确的分型诊断对提高瘢痕妊娠患者的治疗安全性和控制患者治疗进程有极其重要的作用。为提高超声诊断CSP的准确率还需与早期难免流产、低位妊娠及妊娠滋养细胞疾病相鉴别。瘢痕处孕囊完全突入型的CSP易与早期难免流产相混淆,后者超声显示孕囊位于宫腔下段宫颈内口处,形态变形,无胚胎原始心管搏动,宫颈内口多开放,子宫前壁肌层的连续性、厚度、回声正常,孕囊周围无血流信号,会有部分妊娠组织物排出体外,血HCG下降明显。瘢痕处孕囊部分突入型的CSP需与孕囊下缘延伸至瘢痕处的低位妊娠[8]相鉴别,后者孕囊着床在子宫下段切口上方>1cm处,瘢痕前方的蜕膜回声明显较孕囊其他周边的蜕膜要薄,而且瘢痕处肌层的厚度、回声正常,未见丰富的血流,也探测不到滋养动脉。瘢痕处包块型的CSP易被误诊为妊娠滋养细胞疾病,后者病灶多位于子宫体,病灶内部及子宫肌层见五彩镶嵌的彩色血流,为极低阻力频谱,血HCG异常升高。
3.2 超声在UACE治疗CSP中的评估价值 受精卵着床后局部形成蜕膜,母体动脉血进入滋养层间隙,形成具有特征性的血流信号。而胚胎死亡后,滋养层血流就会很快消失。UACE使孕囊或包块缺血、缺氧,促使胚胎及滋养细胞萎缩、坏死,局部注射甲氨蝶呤可使CSP患者滋养细胞分裂受阻,胚胎停止发育而死亡。本组研究UACE前41例孕囊或包块周边血流信号丰富,30例周边血流信号稍丰富。UACE后3~6d,63例孕囊或包块周边均未见明显血流信号,8例周边见稀疏的点状血流信号。因此,通过超声监测孕囊的血流状况,可以判断胚胎的存活状况,为临床进一步治疗提供参考。
3.3 超声在清宫术及术后随访中的应用 盲目清宫可能导致严重的子宫出血、子宫破裂等并发症,是治疗CSP的禁忌[9]。Zhang等[10]报道10例误诊为宫内妊娠而盲目行刮宫术,其中8例发生大出血,1例发生子宫穿孔,3例最终行子宫切除术。本组71例CSP患者均在UACE治疗3~6d后经超声实时监测下行清宫术,手术时间5~10min,出血量5~15ml。62例妊娠物被彻底清除;5例瘢痕处形成包块,超声随访3~5个月内包块均消失;4例瘢痕处包块经手术摘除。71例患者全部保留子宫成功,无严重并发症。超声引导下清宫术提高了手术安全性及成功率,避免了盲目清宫带来的严重并发症。
本研究显示超声不但可以早期准确诊断剖宫产瘢痕妊娠及其分型,还可有效评估UACE后的疗效,实时指导清宫术及进行术后动态观察,能有效避免大出血等严重并发症的发生,成功保留了患者子宫,具有非常重要的临床应用价值。
[1]Jurkovic D,Hillaby K,Woelfer B,et al.First-trimester diagnosis and management of pregnancies implanted into the lower uterine segment cesarean section scar[J].Ultrasound Obstet Gynecol,2003,21(3):220-227.doi:10.1002/uog.56.
[2]Timor-Tritsch IE,Monteagudo A.Unforeseen consequences of the increasing rate of cesarean deliveries:early placenta accreta and cesareanscarpregnancy[J].AmJ ObstetGynecol,2012,207(1):1429.doi:10.1016/j.ajog.2012.03.007.
[3]Timor-Tritsch IE,Monteagudo A,CaliG,etal.Cesarean scar pregnancy and early placenta accreta share common histology[J].Ultrasound ObstetGynecol,2014,43(4):383-395.doi:10.1002/uog.13282.
[4]Allornuvor GF,Xue M,Zhu X,et al.The definition,aetiology,presentation,diagnosis and management of previous caesarean scar defects[J].J Obstet Gynaecol,2013,33(8):759-763.doi:10.3109/01443615.2013.816663.
[5]Osser OV,Jokubkiene L,Valentin L.High prevalence of defects in Cesarean section scars at transvaginal ultrasound examination[J].Ultrasound Obstet Gynecol,2009,34(1):90-97.doi:10.1002/uog.6395.
[6]Godin PA,BassilS,Donnez J.An ectopic pregnancy developing in a previous caesarian section scar[J].FertilSteril,1997,67(2):398-400.doi:10.1016/S0015-0282(97)81930-9.
[7]徐惠英,陈萍,殷芳,等.经阴道超声在联合治疗剖宫产瘢痕处妊娠中的应用[J].中华超声影像学杂志,2006,15(11):877-878.
[8]何敬海,安霞,王聪,等.彩色多普勒超声在剖宫产瘢痕妊娠诊断中的应用[J].中国临床医学影像杂志,2012,23(8):565-567.
[9]Litwicka K,Greco E.Caesarean scar pregnancy:a review of management options[J].Current Opinion in Obstetrics and Gynecology,2013,25(6):456-461.doi:10.1097/GCO.0000000000000023.
[10]Zhang Y,Gu Y,Wang JM,et al.Analysis of cases with cesarean scar pregnancy[J].Journal of Obstetrics and Gynaecology Research,2013,39(1):195-202.
