1.3.6.8-四溴咔唑降解菌的筛选与鉴定
2018-05-09,,
,,
(浙江工业大学 环境学院,浙江 杭州 310014)
环境问题污染物包括日益增加的已知化学物质、具有毒性效应的新物质以及偶然发现的新化合物.新化合物可以包括诸如人工添加剂(例如新型卤代阻燃剂)[1-3]、个人护理产品(例如药物)和副产品[4-5]以及目前受管制的污染物的代谢物和降解产物[6].大量的卤代化合物有可能在环境中持续存在,具有生物蓄积性和毒性[7-10].近年来环境样品中陆续被检测出卤代咔唑,且已被确定为持久性有机污染物(POPs),这些咔唑主要存在于沉积物和土壤样品中[11-15].大多数的卤代咔唑在有机污染物的针对性分析中被发现,包括溴化阻燃剂[11,14]和有机氯农药[16],或者其他潜在污染物,如多环芳烃(PAHs)、多氯二恶英和呋喃(PCDD/Fs)以及多氯联苯(PCBs)[13,15,17].
由于20世纪工业有机化学的兴起,许多卤代化合物及其副产品大量涌入环境中.有关氯代咔唑的发现,最早报道之一是在20世纪80年代初,纽约布法罗河被一个工厂工业染料废弃物所污染[17].在此之后的30 年里,在德国的土壤和沉积物[14,16]、希腊的海洋沉积物[16]以及北美大湖地区的淡水湖泊和河流沉积物中均有关于卤化咔唑的报道[11-13].在对持久性有机污染物的降解过程中,生物降解法无疑是众多降解方法中对环境的二次污染影响最小的方法之一[17],且生物降解一直被广泛地运用于环境修复[18].
1 材料与仪器
1.1 菌种来源
样品采自苏州某制药厂的受污染土壤,土壤经多点采样后,混合均匀.
1.2 培养基
无机盐培养基(MSM)[19-20]:将1.00 g NaCl,1.00 g (NH4)2SO4,1.50 g K2HPO4,0.50 g KH2PO4和0.20 g MgSO4·7H2O溶于离子水中并定容至1 L,自然pH值,分装至锥形瓶中,在121 ℃高压灭菌锅中灭菌20 min.其固体培养基则需另加入体积比为2.0%的琼脂粉.
LB培养基:将10.0 g酵母粉,5.0 g蛋白胨,10.0 g氯化钠溶解在去离子水中并定容至1 L,自然pH值,装至锥形瓶中,在121 ℃高压灭菌锅中灭菌20 min.固体培养基则需另加入体积比为2.0%的琼脂粉.
微量元素溶液[21-23]:将0.13 g MnSO4·H2O,0.23 g ZnCl2,0.03 g CuSO4·H2O,0.42 g CoCl2·6H2O,0.15 g Na2MoO4·2H2O和0.05 g AlCl3·6H2O溶解在去离子水中并定容至1 L,备用.
1.3 实验方法
1.3.1 菌株的纯化与分离
称取5 g土壤样品置于100 mL含1 mg/L1.3.6.8-四溴咔唑的无机盐培养中,置于30 ℃,180 r/min恒温摇床中好氧培养一周.取5 mL上清液转移至新的100 mL含1 mg/L 1.3.6.8-四溴咔唑的无机盐培养集中,相同条件下再培养一周,重复上述操作4 次.
从最后一次富集的培养液中取5 mL进行稀释,稀释倍数分别为10倍,100倍和1 000倍.取0.1 mL稀释后的溶液分别涂布在含1 mg/L 1.3.6.8-四溴咔唑的无机盐固体培养基上,倒置在30 ℃恒温培养箱中培养2~3 d,待培养基上的菌落长到合适大小时,挑取不同形态的菌落分别在不同的LB固体培养基上划线,置于30 ℃恒温培养箱中培养.重复上一步操作数次,直至每块培养皿中的菌落单一.
将每株单菌接种至液体LB培养集中扩大培养,将培养好的菌液转移至离心管中,8 000 r/min离心8 min.用新鲜的MSM清洗菌液2次.将清洗干净的菌体转移至含有1 mg/L 1.3.6.8-四溴咔唑的MSM液体培养集中制成降解液,30 ℃,180 r/min摇床培养.
将降解液用等体积二氯甲烷萃取,通过旋转蒸发仪将萃取液用乙腈换相,用氮吹仪将降解液转移至2 mL棕色进样瓶中并定容至1 mL.用HPLC验证1.3.6.8-四溴咔唑的降解情况.其中,分析柱为Grace Alltima®C18柱(4.6 mm×250 mm,5 μm,美国Grace公司),流速0.8 mL/min,检测波长为246 nm.
1.3.2 菌株的鉴定
通过观察细菌形态,细菌生理生化特性及其16S rDNA序列对细菌种属进行鉴定.菌株生理生化特征参考《常见细菌系统鉴定手册》[24].16S rDNA序列交由上海生工生物工程股份有限公司完成.将测试结果对比Genbank中相关16S rDNA序列,用Neighbor-Joining法构建系统发育树.
1.4 菌株降解的条件优化
降解液的制备:将降解菌接种至LB液体培养基中扩大培养,将培养好的菌液8 000 r/min离心8 min,用新鲜无机盐洗涤2次,将清洗干净的菌液转移至含1 mg/L 1.3.6.8-四溴咔唑的无机盐中.
1.4.1 温度对菌株降解的影响
按上述方法配制降解液,确保降解液中的OD600=1.5,将若干制备好的降解液平均分为5 份,分别放置在温度为22,30,38,46,54 ℃,转速为180 r/min的摇床上培养.
1.4.2 pH对菌株降解的影响
按照上述方法配制新的降解液,将若干制备好的降解液平均分为5 份,每份降解液pH值分别调节至5,6,7,8,9,放置在30 ℃,180 r/min的摇床上培养.
1.4.3 不同底物质量浓度对菌株降解的影响
将清洗干净的菌体转移至MSM液体培养基中,制成种子液,将若干种子液平均分为5 份,分别添加1.3.6.8-四溴咔唑,使得每份种子液中1.3.6.8-四溴咔唑的质量浓度分别为0.1,0.5,1,5,10 mg/L,放置在30 ℃,180 r/min的摇床上培养.
2 结果与讨论
2.1 菌种鉴定
土壤样品富集数次以后,分离纯化出一株能有效降解1.3.6.8-四溴咔唑的降解菌,命名为JW.该菌株为革兰氏阳性菌,好氧,在LB固体培养基上培养2~3 d后,菌落呈淡黄色,菌落大致为边缘平整的圆形,表面光滑湿润(图1).菌株JW能够利用葡萄糖、乳糖、蔗糖和甘露糖,对卡那霉素、氨苄青霉素、链霉素和氯霉素等抗生素都具有抗性.16S rDNA序列构建系统发育树如图2所示,根据其同源性分析得知:该菌被鉴定为Stenotrophomonassp..

图1 菌株JW在LB培养基上生长3 d的菌落图Fig.1 The colonies of strain JW cultured in LB for 3 days
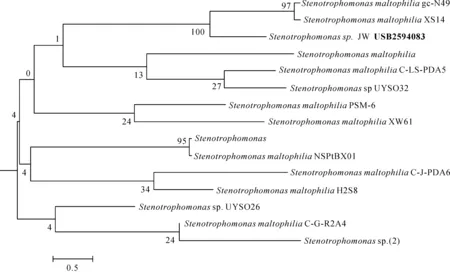
图2 菌株JW的系统发育树Fig.2 Phylogenetic tree by strain JW
2.2 菌株降解的条件优化
2.2.1 温度对菌株降解的影响
将放置在不同温度摇床中的锥形瓶培养20 d后取出,按照1.3.1中所述方法测定剩余1.3.6.8-四溴咔唑的含量.图3结果显示:菌株JW受温度的影响较大,当温度大于或小于30 ℃时,降解效率明显下降,当温度升高至50 ℃以上时,其降解效率甚至不足10%.由此可知,降解菌JW的最适温度为30 ℃.
2.2.2 pH对菌株降解的影响
将不同pH值的锥形瓶在相同条件下培养20 d后取出,按照1.3.1中所述方法测定剩余1.3.6.8-四溴咔唑的含量.图4结果显示:菌株JW更适合在中性条件下生长,当pH值大于或小于7时,降解效率会受到一定的影响.由此可知,降解菌JW的最适酸碱度为中性.
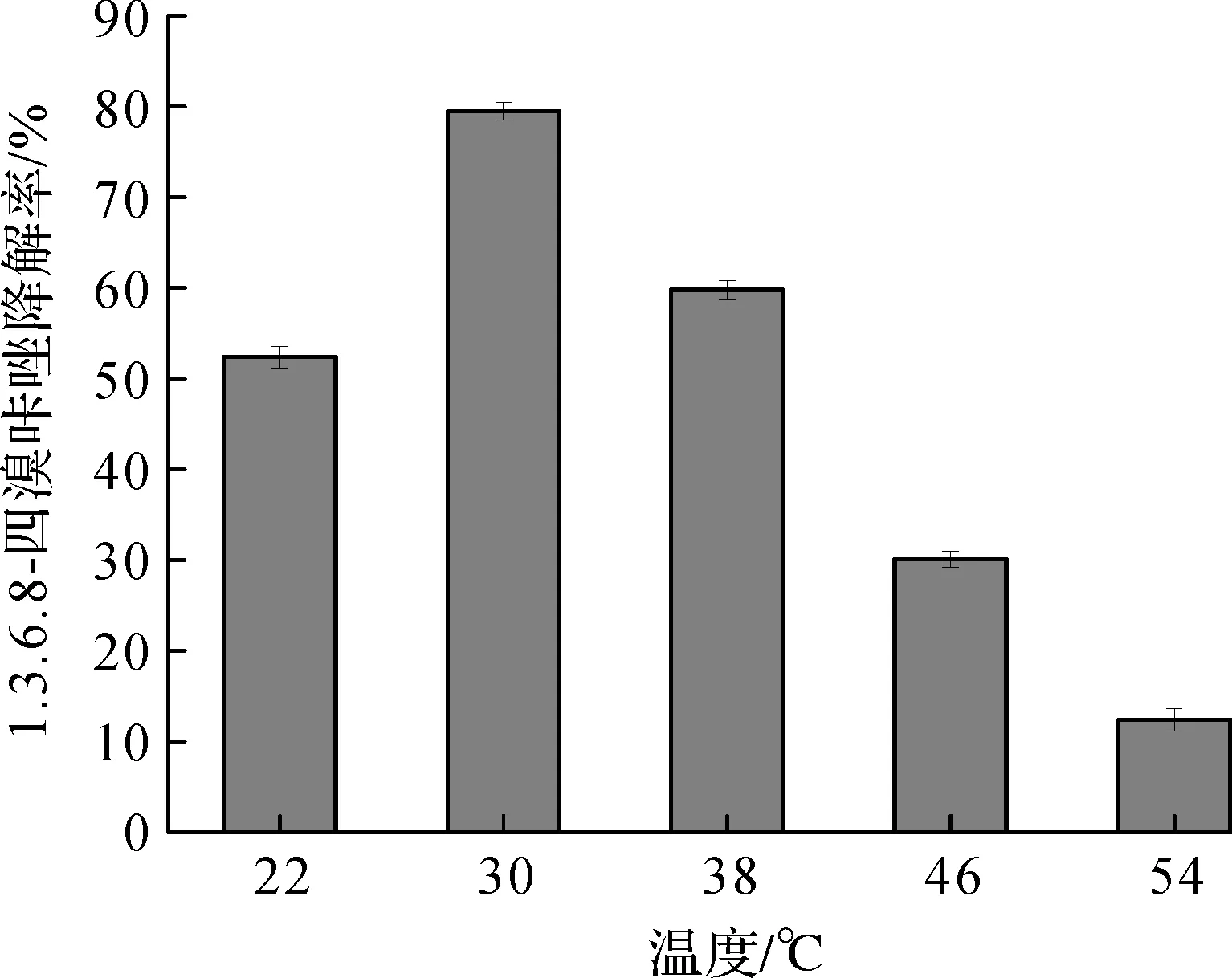
图3 温度对JW降解效率的影响Fig.3 Effect of temperature on degradation by strain JW
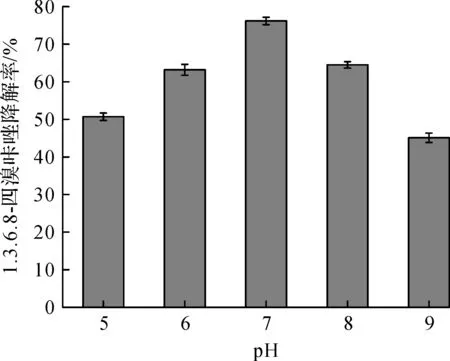
图4 pH值对JW降解效率的影响Fig.4 Effect of pH on degradation by strain JW
2.2.3 底物初始质量浓度对菌株降解的影响
每隔4 d从30 ℃摇床中各取出3 瓶不同底物质量浓度的样品,按照1.3.1中所述方法测定剩余1.3.6.8-四溴咔唑的含量.图5结果显示:菌株JW的降解效率大致与底物质量浓度成反比,即1.3.6.8-四溴咔唑质量浓度越低,菌株JW的降解速率就越快.

图5 初始质量浓度对JW降解效率的影响Fig.5 Effect ofinitial concentration on degradation by strain JW
3 结 论
从苏州某制药厂受污染土壤中筛选出一株能够有效降解1.3.6.8-四溴咔唑的菌株JW.该菌株在LB培养基上呈淡黄色、圆形、边缘平整、表面光滑、隆起,经16S rDNA序列鉴定为Stenotrophomonassp..该菌株可以在20 d内降解80% 1 mg/L 1.3.6.8-四溴咔唑,之后以缓慢的速率降解,直到50 d左右1.3.6.8-四溴咔唑基本降解完全.菌株JW在30℃,pH=7时降解效率最高,为卤代咔唑类化合物的生物降解提供了理论基础.
参考文献:
[1] POMA G, ROSCIOLI C, GUZZELLA L. Evaluation of spatial distribution and accumulation of novel brominated flame retardants, HBCD and PBDEs in an Italian subalpine lake using zebra mussel[J].Environmental science &pollution research international, 2014, 186(4):7683-7692.
[2] CEQUIER E, BECHER G, THOMSEN C. Human exposure pathways to organophosphate triesters-a biomonitoring study of mother-child pairs [J].Environmental science technology letter, 2014, 1(1):82-86.
[3] BALLESTEROSGOMEZ A, BOER J D, LEONARDS P E. A novel brominated triazine-based flame retardant (ttbp-taz) in plastic consumer products and indoor dust [J].Environmental science & technology, 2014, 48(8):4468-4474.
[4] RUDD M A, ANKLEY G T, BOXALL A B. International scientists’ priorities for research on pharmaceutical and personal care products in the environment[J].Integrated environmental assessment & management, 2014, 10(4):576-587.
[5] BIRCH GF, DRAGE D S, THOMPSON K. Emerging contaminants (pharmaceuticals, personal care products, a food additive and pesticides) in waters of Sydney estuary, Australia [J].Marine pollution bulletin, 2015, 97(12):56-66.
[6] STUBBINGS W A, HARRAD S. Extent and mechanisms of brominated flame retardant emissions from waste soft furnishings and fabrics:a critical review [J].Environment international, 2014, 71:164-175.
[7] BALLESTEROSGOMEZ A, BRANDSMA S H, DE B J. Analysis of two alternative organophosphorus flame retardants in electronic and plastic consumer products:resorcinol bis-(diphenylphosphate) (PBDPP) and bisphenol A bis (diphenylphosphate) (BPA-BDPP)[J].Chemosphere, 2014, 406(34):2503-2512.
[8] GAGOFERRERO P, SCHYMANSKI E L, BLETSOU A A. Extended suspect and non-target strategies to characterize emerging polar organic contaminants in raw wastewater with LC-HRMS/MS[J].Environmental science & technology, 2015, 49(20):12333-12341.
[9] ABDALLAH M A, ZHANG J, PAWAR G. High-resolution mass spectrometry provides novel insights into products of human metabolism of organophosphate and brominated flame retardants[J].Analytical & bioanalytical chemistry, 2015, 407(7):1871-1883.
[10] JOBST K J, SHEN L, REINER E J. The use of mass defect plots for the identification of (novel) halogenated contaminants in the environment[J].Analytical & bioanalytical chemistry, 2013, 405(23):3289-3297.
[11] GUO J, CHEN D, POTTER D. Polyhalogenated carbazoles in sediments of lake Michigan:a new discovery[J].Environmental science & technology, 2014, 48(3):12807-12815.
[12] WU Y, MOORE J, GUO J. Multi-residue determination of polyhalogenated carbazoles in aquatic sediments [J].Journal of chromatography A, 2016, 1434(23):111-118.
[13] ABAURREAM P, JOBST K J, RUFFOLO R. Identification of potential novel bioaccumulative and persistent chemicals in sediments from Ontario (Canada) using scripting approaches with GC×GC-TOF MS analysis[J].Environmental science & technology, 2014, 48(35):9591-9599.
[14] TROBS L, HENKELMANN B, LENOIR D. Degradative fate of 3-chlorocarbazole and 3, 6-dichlorocarbazole in soil[J].Environmental science & pollution research, 2011, 18(32):547-555.
[15] PENG H, CHEN C, SAUNDERS D M. Untargeted screening and distribution of organo-bromine compounds in sediments of lake Michigan[J].Environmental science & technology, 2015, 87(12):10237-10246.
[16] REISCHL A, JONECK M. Chlorcarbazole in BÖden [J].Umweltwissenschaften und schadstoff-forschung, 2005, 17(45):197-200.
[17]GRIGORIADOU A, SCHWARZBAUER J. Non-target screening of organic contaminants in sediments from the industrial coastal area of Kavala city (NE Greece) [J].Water air & soil pollution, 2011, 214(5):623-643.
[18] 胡志杭,徐士博,祝飞,等.二氯甲烷高效降解菌株的诱变选育[J].浙江工业大学学报,2011,39(1):7-12.
[19] 江吉红,商弘颖,吴立飞,等.尼古丁降解菌的分离鉴定和初步特性研究[J].浙江工业大学学报,2012,39(6):614-618.
[20] 邱乐泉,杨琳,钟卫鸿.一株脱有机硫菌AgrobateriumtumefaciensW3的分离鉴定及特性的研究[J].浙江工业大学学报,2009,37(5):520-524.
[21] 李娟,齐俊生,王婷,等.IPTG添加时机对大肠杆菌产α-酮基丁酸的影响[J].发酵科技通讯,2017,46(2):78-82.
[22] 楼坚,申雨珂,刘梦云,等.牛乳中嗜冷菌的PCR快速检测[J].发酵科技通讯,2017,46(1):36-41.
[23] 欧志敏,马兰.蜡样芽孢杆菌发酵产脂肪酶的分批发酵动力学[J].发酵科技通讯,2017,46(1):2-5.
[24] 蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
