他克莫司的发酵生产研究
2018-05-09,,,,,
,,,, ,
(1.杭州华东医药集团有限公司,浙江 杭州 311000;2.浙江工业大学 生物工程学院 浙江省生物有机合成技术研究重点实验室,浙江 杭州 310014)
他克莫司(Tacrolimus),又名FK506,是从筑波链霉菌发酵液中提取得到的一种大环内酯类免疫抑制剂,主要通过抑制T细胞活化相关细胞因子基因的转录及其蛋白的表达发挥免疫抑制作用,其IC50为环孢素A的1%[1].1984年由日本藤泽药品工业公司开发,其后国内外大力进行了他克莫司的基础和临床研究.该产品为单水合物,白色或类白色结晶性粉末,几乎不溶于水,易溶于乙醇、甲醇、丙酮、醋酸乙酯、乙醚、苯酚和氯仿[2-3],具有药效强、使用剂量低、移植物存活率高和急性排斥反应发生率低等优点[4].目前,国内的免疫抑制剂市场已经达到100 亿元的规模,其中国内重点城市公立医院他克莫司用药金额为5.03 亿元,而全球他克莫司市场一直处于20多亿美元的规模,他克莫司已成为器官移植免疫抑制剂市场的领头羊.
他克莫司作为一种具有独特化学结构和重要药理活性的大环内酯类化合物,其生产方法主要有化学合成法和生物发酵法.他克莫司的化学合成法最早是由Merck公司开发的不对称Evans-Aldol缩合反应法[5],该方法先通过合成各关键片段再进行结构单元的组装得到最终产品,但由于他克莫司的分子量大、手性及结构复杂,因此在合成过程中所需步骤较多,合成效率相对较低.随着研究者们对合成方法的不断探索和改进,发展了新的合成方法,并改进了部分结构单元的合成路径,衍化出目前较常用的汇聚式合成策略[6].但由于化学合成方法的限制较多,随着人们对他克莫司生物合成机制及特异性前体形成机制研究的不断深入,科研人员可以通过基因工程改造的方法获得产量提高、组分优化的新一代他克莫司生产菌株.研究者们通过位点特异性整合的方法获得了基因重组菌,其生产能力较原始菌株提高了120%.2003年,Kang等[7]筛选到了一株高产他克莫司的链霉菌StreptomycesclavuligerusCKD1 119,并提供了一种高产他克莫司的方法,经过7~8 d的发酵,最终得到350 mg/L的他克莫司.后期研究者们不断对菌株进行改良和发酵条件优化,最终其生产能力有了很大的提高.此外,在他克莫司的下游分离提取方面,因发酵液中含有较多的成分,且他克莫司在含水溶媒体系中易发生互变异构[8],大大增加了精制过程的难度,一般认为不能以反相柱色谱精制.Kino[9]和Okuhara[10]报道了他克莫司的分离提取方法,但都难以适应工业化生产.笔者通过选育高产突变株,突破发酵工艺的关键技术,改进下游分离纯化工艺,全面提高发酵水平,降低杂质含量,大幅降低生产成本,获得先进的他克莫司生产新工艺.
1 材料与方法
1.1 菌 种
筑波链霉菌(Streptomycestssukubaensis)No 9993,由实验室分离并保藏.
1.2 培养基
1.2.1 斜面培养基
麦芽浸出粉20 g/L,酵母浸出粉5 g/L,葡萄糖10 g/L,琼脂15 g/L,pH 7.0.
1.2.2 种子培养基
可溶性淀粉10 g/L,甘油10 g/L,干酵母5 g/L,玉米浆10 g/L,葡萄糖10 g/L,CaCO32 g/L,pH 7.0.
1.2.3 发酵培养基
糊精7%,固体玉米浆0.5%,啤酒酵母粉1.7%,面包酵母粉0.6%,L-异亮氨酸0.5%,硫酸铵0.1%,碳酸钙0.25%,泡敌0.3%.
1.2.4 补料培养基
糊精7%,固体玉米浆0.5%,啤酒酵母粉1.7%,面包酵母粉0.6%,L-异亮氨酸0.5%,硫酸铵0.1%,碳酸钙0.25%,泡敌0.3%,固体玉米浆0.1%,啤酒酵母粉0.5%,pH 9.0±0.5.
1.3 实验方法
1.3.1 补料分批发酵方法
从新鲜斜面上挑取1 环菌接种到20 mL种子培养基中,300 r/min培养 40 h,制备一级种子,按体积分数10%的接种量接入20 mL发酵培养基中.
1.3.2 活性炭脱色损失计算
在萃取液中分别加入20 g/L的活性炭,搅拌2 h后过滤,得到滤液.
脱色损失率=(U萃取-U滤液)/U萃取×100%
式中:U萃取为萃取液效价;U滤液为滤液效价.
2 结果与讨论
2.1 种子液碳源的筛选
淀粉是发酵生产他克莫司的必需碳源之一,但含淀粉的培养基黏度极高,从而影响发酵过程的供氧.为了探究种子对不同碳源的利用情况和适应程度,考察了五种不同碳源(玉米淀粉(10 g/L)、可溶性淀粉(10 g/L)、甘油(10 g/L)、葡萄糖(5 g/L)和麦芽糊精(10 g/L))对种子生长(38 h)及对发酵产他克莫司的影响.结果如图1所示.
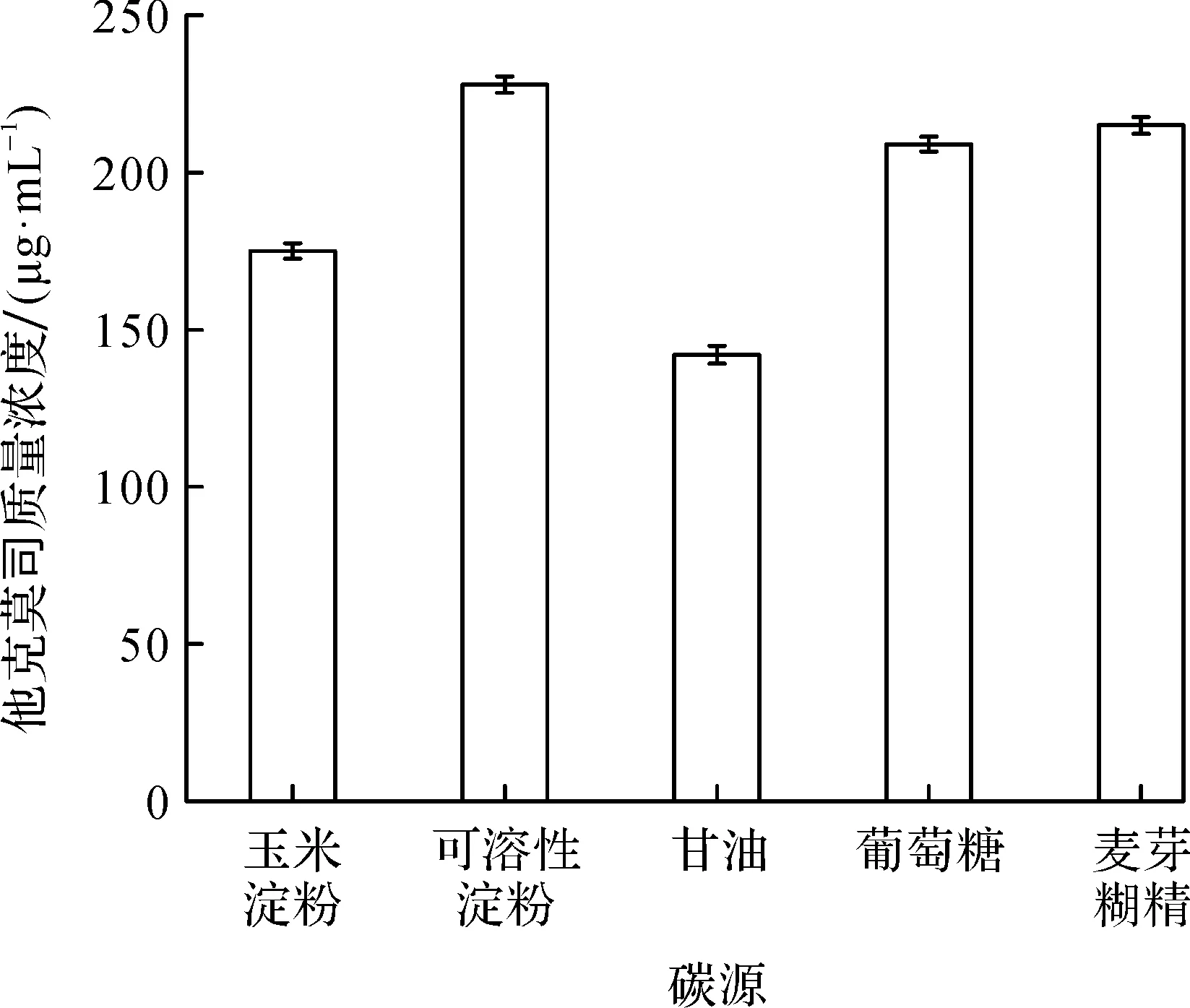
图1 不同碳源对发酵效价的影响Fig.1 The effect of carbon source on fermentation titer
由图1可知:种子液碳源为葡萄糖、可溶性淀粉和麦芽糊精时,发酵生产他克莫司的效价均较高;而用玉米淀粉和甘油为碳源时,发酵生产他克莫司的效价相对较低.后期通过镜检发现以葡萄糖为种子液碳源时菌丝生长快,菌丝体粗壮,菌丝生长呈网状,染色深,菌体对生长环境具有较大的耐受能力.
2.2 种子液中葡萄糖用量的优化
对种子培养基中碳源葡萄糖的质量浓度进行考察.种子培养48 h后移入发酵培养基,考察种子培养基中葡萄糖的添加量对发酵生产他克莫司的影响,以确定葡萄糖的最适用量.结果如图2所示.
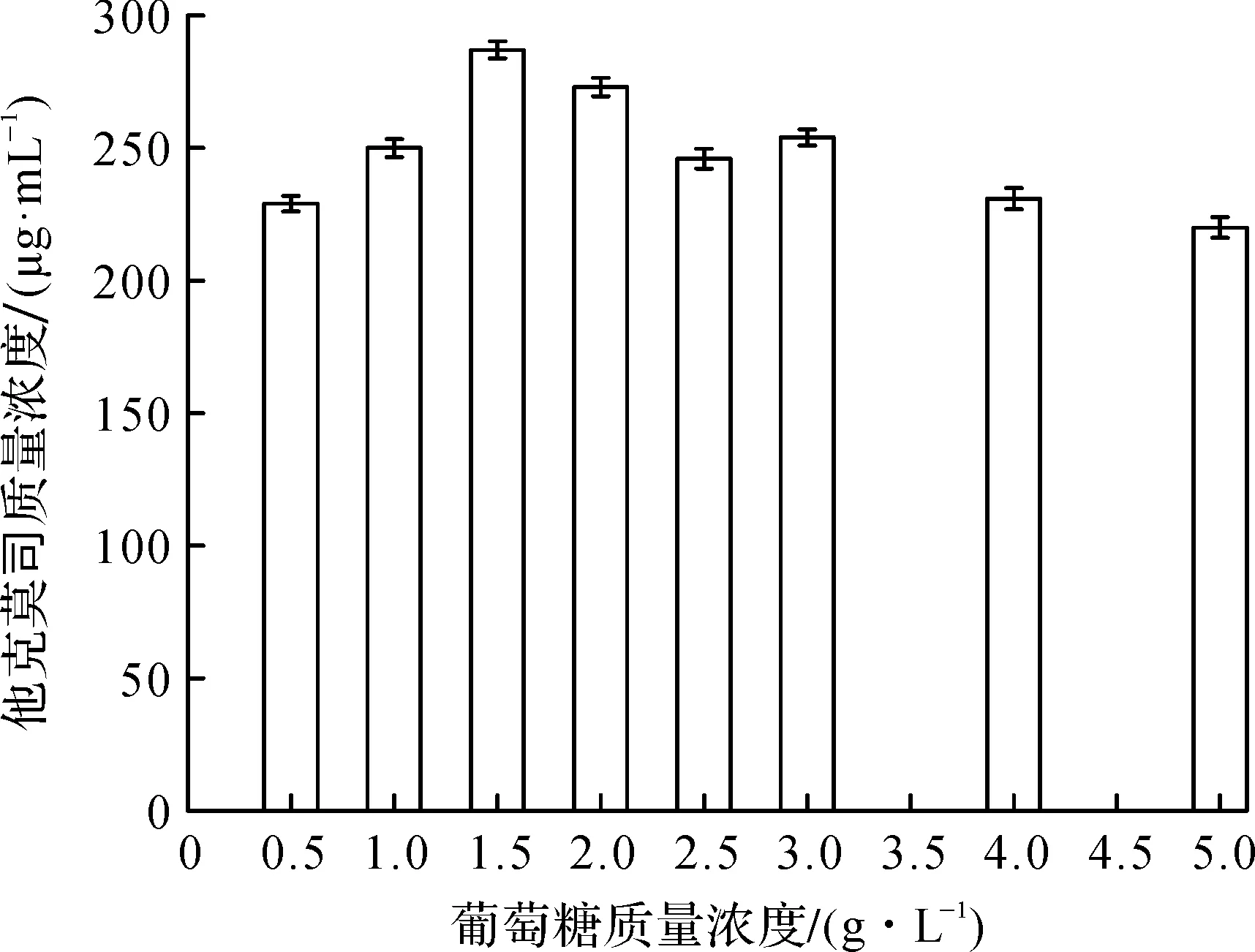
图2 种子液中葡萄糖添加量对发酵效价的影响Fig.2 The effect of addition of glucose on fermentation titer
种子液中葡萄糖质量浓度的高低会影响菌体生长速率,进而影响后续代谢产物的合成,因此需要选择合适的葡萄糖质量浓度以优化菌体的代谢过程.由图2可知:种子培养过程中碳源葡萄糖的质量浓度为1.5 g/L时,后续发酵生产他克莫司的水平可以达到287 μg/mL,此时菌丝镜检成网成团,菌丝粗壮,染色深.当种子液中的葡萄糖质量浓度较低时种子液中的碳源减少,种子生长速率下降;而当葡萄糖质量浓度过高时,菌种生长速率过快,积累大量代谢副产物.因此,本实验优化所得到的1.5 g/L葡萄糖质量浓度适合菌体生长代谢.
2.3 种子培养时间的确定
选用1.5 g/L葡萄糖作为种子碳源后,种子生长较快,生长周期发生了变化.种子培养时间直接影响产物的生成,为了确定较适宜的接种时间,实验分别选取不同种龄(24,32,40,48,56 h)的种子接到发酵培养基中,并最终以发酵液中的他克莫司效价判断发酵的结果.结果如图3所示.
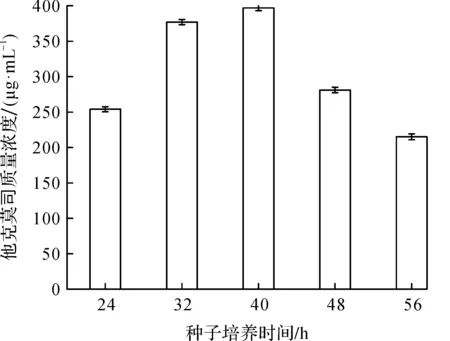
图3 种子培养时间对发酵效价的影响Fig.3 The effect of seed incubating time on fermentation titer
由图3可知:当种子培养时间分别为24,48,56 h时,转接后发酵液中的他克莫司质量浓度均较低,这是由于种子培养时间过短时,种子活力不够,而当种子培养时间过长时,种子进入平台期,此时种子活力差,状态也不稳.当种子培养至40 h时,转接发酵培养基,他克莫司的效价最高,此时的种子活性较高,状态稳,发酵水平和发酵液质量提高.因此,最终选取40 h为最佳接种时间.
2.4 不同接种量对发酵结果的影响
种子液的接种量会影响菌体的延滞期:接种量大,则延滞期短,菌体生长迅速,降低了产物的产量;接种量小,延滞期长,菌体生长缓慢,同样不利于产物的积累.因此需要考察接种量对效价的影响.将种龄为40 h的种子按不同接种量接至发酵培养基中进行发酵实验,考察不同接种量对发酵效价的影响.结果如图4所示.
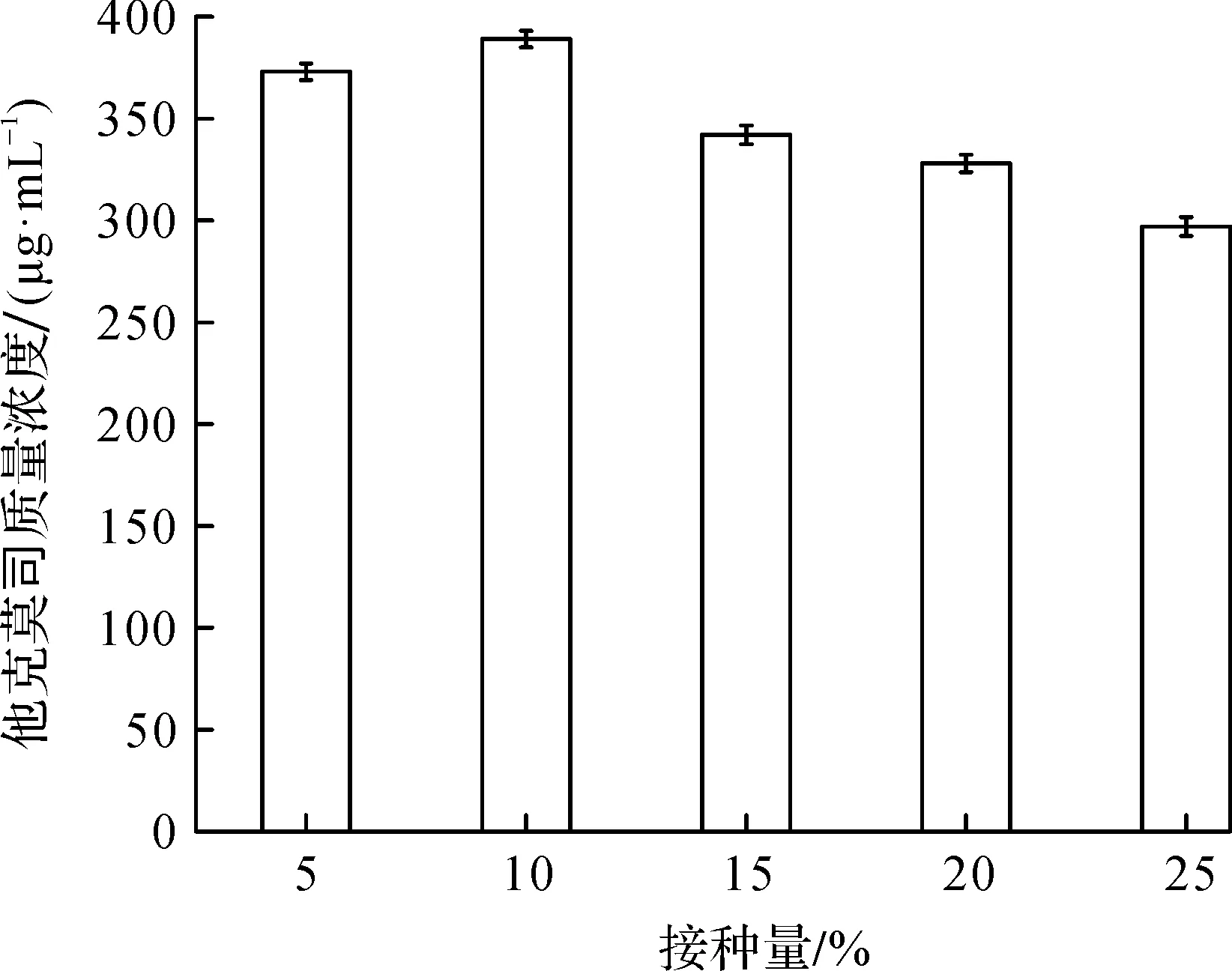
图4 接种量对发酵效价的影响Fig.4 The effect of inoculation amount on fermentation titer
由图4可知:当接种量逐渐升高时,发酵的效价呈明显下降的趋势,这是因为接种量增大时,菌体生长速率较快,大量消耗发酵培养基中的营养成分,导致用于代谢合成他克莫司的直接碳源大大减少,并且加剧了发酵液中副产物的积累.通过本实验可知:当接种量为10%时,发酵液中他克莫司的质量浓度最高.
2.5 发酵过程放大的研究
由摇瓶发酵放大到发酵罐发酵时,各方面条件有所变化,特别是对发酵条件的控制,如温度、溶解氧、pH值和装液量等主要参数的控制方式与摇瓶不同,会造成发酵结果与摇瓶的差异性,因此进行放大研究,评估装液量和溶氧等影响因素对发酵过程的影响.
2.5.1 装液量对发酵结果的影响
他克莫司的发酵属于好氧性发酵,在摇瓶发酵过程中,影响溶氧的因素主要是摇瓶的装液量和摇床的转数.控制摇床的转数为300 r/min,在500 mL摇瓶中测定不同装液量对发酵结果的影响.结果如图5所示.

图5 装液量对发酵效价的影响Fig.5 The effect of loading volume on fermentation titer
由图5可知:500 mL摇瓶的装液量为20 mL时,发酵液中他克莫司产量最高.这是因为在该装液量下,溶氧较高,有利于他克莫司的积累,并减少了副产物的生成.从实验结果中发现装液量是影响摇瓶发酵溶氧的重要因素.在发酵转速一定时,装液量越低,发酵液中的溶氧越高.但是在发酵过程中装液量过低时,由于培养基水分蒸发等因素造成的发酵液体积变化较大,并且随着菌体发酵代谢的不断进行,发酵液中营养成分不足导致发酵过程中产他克莫司的水平下降.
2.5.2 溶氧对发酵结果的影响
在筑波链霉菌发酵生产过程中,溶氧是影响发酵的关键因素,对微生物的生长和产物形成有重要的影响.要根据氧的溶解特性及微生物对氧的需求,分析溶氧对发酵的影响及对发酵产物的影响,进而确定溶氧量的控制及在发酵液中的传递,使生产效益最大化.笔者在20 t发酵罐中研究了10%,20%,30%溶氧对发酵产他克莫司产量的影响.结果如图6所示.
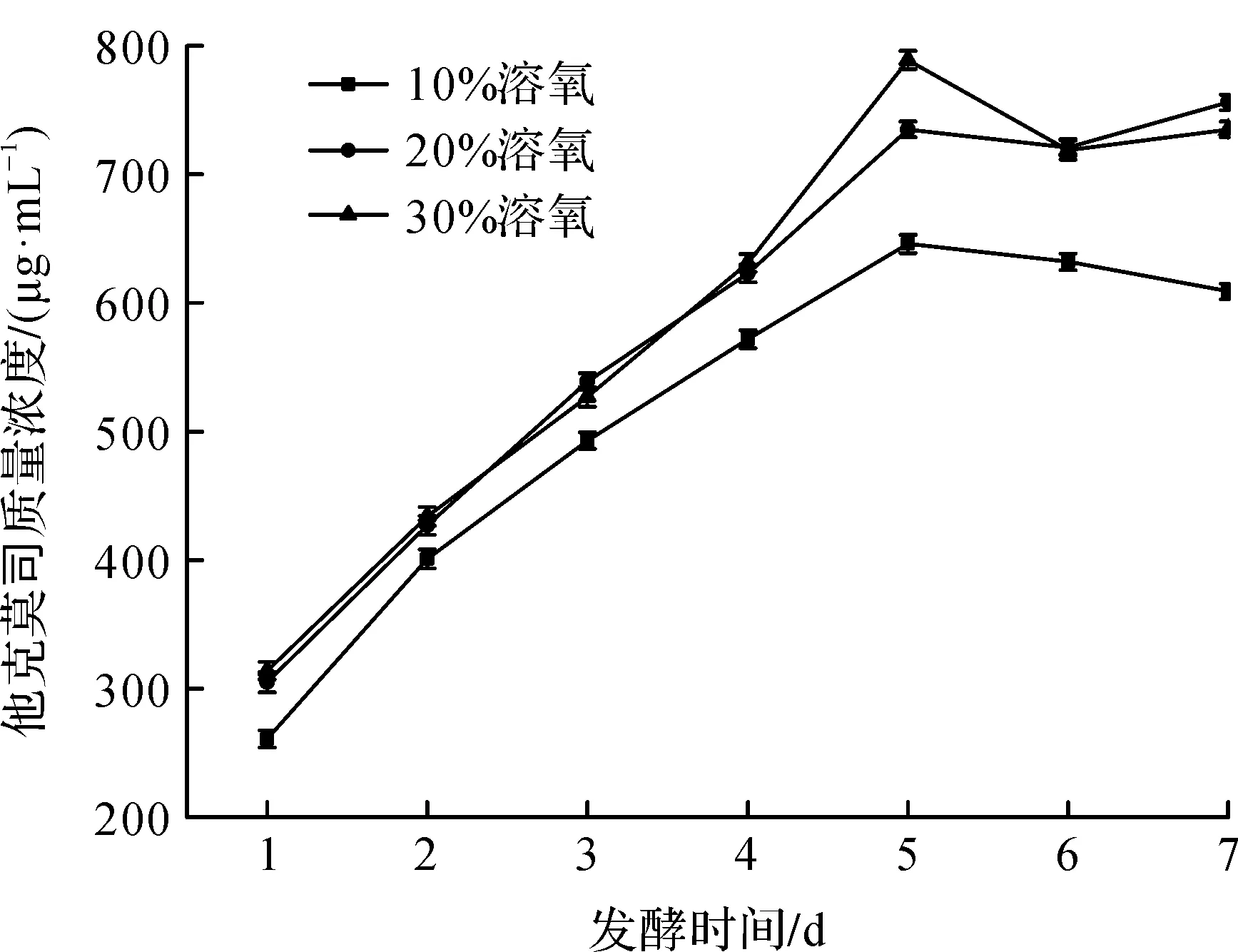
图6 溶氧对发酵效价的影响Fig.6 The effect of dissolved oxygen on fermentation titer
由图6可知:发酵前期,溶氧高低对发酵生产他克莫司的影响较小,溶氧较低时发酵效价相对较低.当溶氧超过20%时,他克莫司产量变化不明显.此外,可以发现在发酵后期溶氧高低对发酵结果影响不大,发酵效价处在一个稳定的水平,这可能是因为发酵中后期,菌丝体对溶氧的要求不高.因此在发酵对数生长期可以提高溶氧,促使菌体生长和代谢,在发酵中后期可以考虑降低空气供应量,同时降低搅拌转速,以此来节能降耗,降低成本.
2.5.3 分批补料发酵过程优化
根据前期摇瓶补料实验结果以及放大控制条件摸索,采用优化后的工艺配方,进行20 t罐补料放大实验,发酵过程中溶氧控制在20%以上,并在发酵中后期进行补料.结果如图7所示.
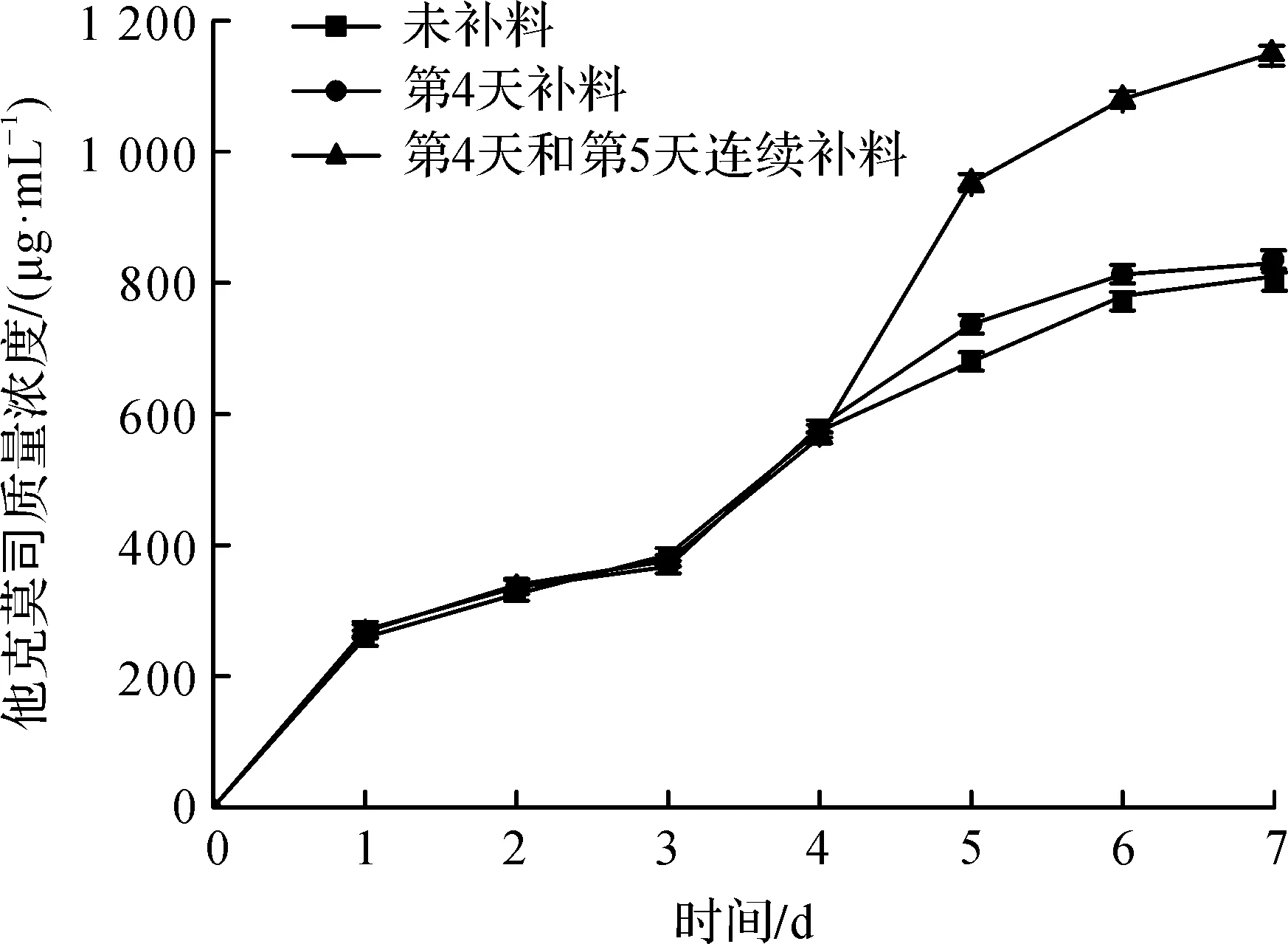
图7 分批补料发酵过程曲线Fig.7 Fermentation process curve of feed-batch
由图7可知:补料工艺的他克莫司质量浓度达到1 150 μg/mL,产量有大幅度提升.实验发现只在发酵第4天进行补料,对他克莫司产量影响较小.而在发酵第4天和第5天连续补料时,产量明显提高.这是由于在发酵中后期菌体消耗糖等速率快,生长达到最高值,并大量合成他克莫司,此时进行补料可以延缓菌体进入衰亡期,提高菌体的生产发酵能力.
2.6 提取与精制过程工业化研究
在微生物发酵液中,存在许多蛋白质和多糖等杂质,为后续产品的分离纯化带来了很大的难度.在他克莫司的发酵液中还存在很多异构体和类似物,主要杂质有二氢他克莫司、子囊霉素等,其中子囊霉素与他克莫司只相差1 个亚甲基,而二氢他克莫司与他克莫司相差2 个氢原子,因此子囊霉素、二氢他克莫司与他克莫司的结构极为相似(相似度95%以上),在溶剂中的溶解性和对溶剂的亲和力相近,因为这些物质的存在,常规的分离纯化方法无法完全分离他克莫司,产品达不到相应的纯度,纯化分离难度极大,生产工艺水平低,工艺成本居高不下.
2.6.1 提取工艺优化
为了除去发酵液中的色素等杂质,筛选了不同品种的活性炭(活性炭PT-A303,活性炭8815,PT303-1和白鹭-Z),考察脱色效果和粗品质量.结果如图8所示.

图8 脱色材料的选择Fig.8 Selection of decolorizing materials
由图8可知:活性炭PT-A303的脱色损失最小,而且经该脱色材料脱色后的结晶收率最高,这说明该脱色材料既能较好地吸附色素,而且对产品的吸附较少.脱色后,用V(乙酸乙酯)∶V(正庚烷)∶V(纯水)=1∶3∶2的结晶溶剂对脱色液进行浓缩结晶,30 ℃保温1 h,冷却至20 ℃,继续搅拌2 h,过滤得到他克莫司粗品.
2.6.2 他克莫司层析技术
为了进一步提高产品质量,提高提炼收率,并实现他克莫司中结构类似杂质子囊霉素(FK520)和8-丙基他克莫司(2H-FK506)的有效分离,开发了针对FK506分离纯化的Q5亲和层析工艺,利用这种材料具有选择性吸附某个化合物或某类结构相似的化合物的特点,高亲和性及高选择性分离目标化合物.选择亲和层析填料上的配基与FK506分子结构上的C36双键形成配位键,而类似物FK520和2H-FK506分子结构上C36无双键基团,不能与本亲和填料上的配基形成配位键,故本填料吸附FK506能力显著大于类似物FK520和2H-FK506,从而达到彻底分离去除FK520及2H-FK506杂质的目的,提高产品质量及纯化收率.以V(乙醇)∶V(乙酸乙酯)=45∶55的洗脱液洗脱分离FK520和2H-FK506杂质,最终只需一次层析即可达到彻底分离去除FK520及2H-FK506的目的,收率达86.6%,他克莫司的纯度达99.5%,FK520和2H-FK506杂质质量分数分别为0.13%和0.2%.
3 结 论
通过研究不同发酵条件对他克莫司发酵的影响,获得了最适摇瓶发酵培养条件:种子培养基中以1.5 g/L葡萄糖为辅碳源,种子培养时间40 h,500 mL摇瓶装液量为20 mL,接种量为10%;20 t发酵罐发酵培养过程中溶氧控制在20%以上,发酵周期为7 d,发酵第4天和第5天进行分批补料,最终发酵得到他克莫司的质量浓度为1 150 μg/mL.优化了他克莫司发酵液的提取和精制工艺,为其工业化生产提供了可靠的工业路线.粗提取时选择活性炭PT-A303进行萃取后脱色处理,经V(乙酸乙酯)∶V(正庚烷)∶V(纯水)=1∶3∶2混合溶剂对脱色浓缩液进行结晶得到粗品.精制的过程中,采用Q5亲和层析工艺,达到彻底分离去除FK520及2H-FK506等相似结构杂质的目的,收率达86.6%,他克莫司的纯度达99.5%,FK520和2H-FK506杂质质量分数分别为0.13%和0.2%.
参考文献:
[1] GOTO T, KINO T, HATANAKA H, et al. FK506:historical perspectives[J].Transplant proceedings, 1991, 23(6):2713-2717.
[2] 朱健,谢样茂,陈俊勇,等.他克莫司产生菌的选育和生产工艺研究[J].中国医药王艺杂志,2005,36(4):207-210.
[3] 徐亲民.他克莫司的工业化研究[J].国外医药抗生素分册,2000,21(4):151-155.
[4] LIU J, FARMER J D, LANE W S, et al. Calcineurin is a common target of cyclophilin-cyclosporin A and FKBP-FK506 complexes[J].Cell, 1991, 66(4):807-815.
[5] JONES T K, MILLS S G, REAMER R A, et al. Total synthesis of the immunosuppressant (-)-FK-506[J].Journal of the American chemical society, 1989, 111(3):1157-1159.
[6] MADDESS M L, TACKETT M N, LEY S V. Total synthesis studies on macrocyclic pipecolic acid natural products:FK506, the antascomicins and rapamycin[M]∥ Natural Compounds as Drugs. Basel: Birkhäuser Basel, 2008:13, 15.
[7] KANG T W, CHOI B T, KIM H S, et al. Microorganism productive method tacrolimus and mass-productive method tacrolimus using the same:WO 2005063963A1[P]. 2005-07-14.
[8] NAMIKE Y, KIHARA N, KODA S, et al. Tautomeric phenomenon of a novel potent immunosuppressant (FK506) in solution.I. Isolation and structure determination of tautomeric compounds[J].Journal of antibiotics, 1993, 46(7):1149-1155.
[9] KINO T, HATANAKA H, HASHIMOTO M, et al. FK-506, a novel immunosuppressant isolated from aStreptomyces.I. fermentation, isolation, and physico-chemical and biological characteristics[J].Journal of antibiotics, 1987, 40(9):1249-1255.
[10] CHIYOSHI K, TAKEHIKO O, MASASHI H. Tricyclo compounds, a process for their production and a pharmaceutical composition containing the same:US, US5266692[P]. 1992-01-09.
