卡那霉素连续补料发酵工艺的研究
2018-05-09,,
, ,
(浙江金华康恩贝生物制药有限公司,浙江 金华 321016)
卡那霉素(kanamycin)是1957年由日本人梅泽滨夫从卡那链霉菌(Streptomyceskanamyceticus)发酵液中提取出的一种氨基糖苷类抗生素[1].卡那霉素在国内已有30多年的生产史.长期以来,普遍采用不补料、不控制pH的分批发酵工艺,高浓度碳、氮源发酵培养基经灭菌、接种后进行发酵,发酵过程中每天补水1 次,发酵液流变性差、供氧和传质效果弱.发酵前期由于大量糖的消耗,pH过低,不利于链霉菌生长.发酵中后期,发酵液过多的氮源分解以及菌体的早衰导致pH过高,不利于菌体的代谢和卡那霉素的合成,发酵水平长期徘徊在8 000 U/mL左右.赖滨霞采用间歇补料工艺,效价达8 800 U/mL以上[2].补料分批发酵技术已大量应用于发酵过程中[3-5].
针对目前国内卡那霉素生产现状及问题,采用发酵过程连续补料工艺,均匀营养、改善供氧和发酵液流变性,控制pH,提高生产菌的代谢和卡那霉素的合成.新发酵工艺较大幅度提高了发酵水平.
1 材料与方法
1.1 材 料
1.1.1 菌 种
卡那链霉菌(Streptomyceskanamyceticus)0708,由浙江金华康恩贝生物制药有限公司研发中心提供;枯草芽孢杆菌63501由浙江金华康恩贝生物制药有限公司质量控制部提供.
1.1.2 培养基
种子培养基:玉米淀粉30 g/L,黄豆饼粉20 g/L,葡萄糖6 g/L,玉米粉10 g/L,NaNO31 g/L,CaCO34 g/L,淀粉酶0.03 g/L.pH自然,121 ℃灭菌30 min.
原发酵培养基:玉米淀粉60 g/L,麦芽糖50 g/L,黄豆饼粉50 g/L,蛋白胨5 g/L,NaNO38 g/L,KH2PO40.2 g/L,CaCO32 g/L,ZnSO4·7H2O 0.2 g/L,淀粉酶0.05 g/L,豆油5 g/L,PPE聚醚消泡剂0.1 g/L;pH 6.8~7.2,121 ℃灭菌30 min.
新发酵培养基:玉米淀粉50 g/L,黄豆饼粉30 g/L,蛋白胨5 g/L,NaNO34 g/L,KH2PO40.2 g/L,CaCO32 g/L,ZnSO4·7H2O 0.2 g/L,淀粉酶0.05 g/L,豆油10 g/L,PPE聚醚消泡剂0.1 g/L;pH 6.8~7.2,121 ℃灭菌30 min.
补料培养基:淀粉水解液400 g/L,酵母粉90 g/L,分别进行121 ℃灭菌30 min.
1.2 方 法
1.2.1 摇瓶培养条件
斜面培养条件:用接种环取卡那链霉菌0708在斜面上划线接种,28 ℃培养108 h.
种子培养条件:挖取斜面上活化的菌苔,接种到80 mL种子培养液中(750 mL园底三角瓶),摇瓶机转速220 r/min,28 ℃培养48 h.
发酵培养条件:按10%接种量,将种子液接种到80 mL发酵培养液中(750 mL园底三角瓶),27 ℃培养144 h,摇瓶机转速230 r/min.
1.2.2 发酵罐培养条件
50 L发酵罐装液量25 L,接种量10%,培养温度27 ℃,罐压0.05 MPa, 空气量15~35 L/min, 搅拌转速300~600 r/min,培养时间144 h.
补料方法:使用蠕动泵流加玉米淀粉水解液,控制发酵液总糖质量浓度(25±5) g/L;发酵72 h后,当溶氧回升时流加酵母粉溶液(2±0.1) g/(L·d);用工业氨水控制发酵液pH为6.8±0.02.
1.2.3 分析方法
卡那霉素效价测定方法:管碟法
其他参数测定方法:
1) 糖测定方法:斐林试剂法.
2) 氨基氮测定方法:甲醛法.
3) 菌体浓度的测定:取发酵液10 mL,3 500 r/min离心10 min,计算沉降物占发酵液的百分比.
2 结果与分析
2.1 降低发酵培养基初始糖质量浓度对卡那霉素合成的影响
原发酵培养基配方中含有玉米淀粉60 g/L、麦芽糖5 g/L,初始糖质量浓度高,导致发酵液流变性差.为降低发酵液黏度、提高溶氧、节约成本,研究降低发酵培养基初始糖质量浓度对卡那霉素合成的影响,结果见表1.
表1降低发酵培养基初始糖质量浓度对卡那霉素合成的影响
Table1Effectofreducingfermentationculturedinitialsugarconcentrationonkanamycinsynthesis
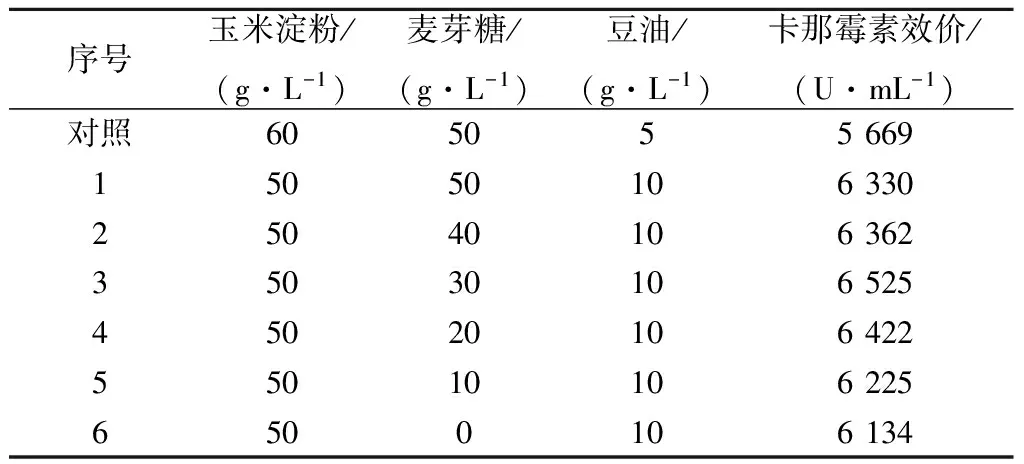
序号玉米淀粉/(g·L-1)麦芽糖/(g·L-1)豆油/(g·L-1)卡那霉素效价/(U·mL-1)对照60505566915050106330250401063623503010652545020106422550101062256500106134
由表1可见:1) 玉米淀粉从60 g/L降到50 g/L,豆油从5 g/L升到10 g/L,效价提高11.66%;2) 玉米淀粉从60 g/L 降到50 g/L,豆油从5 g/L升到10 g/L,麦芽糖从50 g/L降到30 g/L,效价比对照提高15%,说明适当地降糖加油有利于卡那霉素合成;3) 维持玉米淀粉50 g/L、豆油10 g/L,只是麦芽糖质量浓度从50 g/L 降到30 g/L,效价提高3%,麦芽糖质量浓度继续从30 g/L降到0 g/L,效价下降6%.说明麦芽糖对卡那霉素合成的影响不显著,出于经济成本考虑,发酵培养基初始配方中选择玉米淀粉50 g/L、豆油10 g/L、麦芽糖0 g/L作为新配方的碳源组合.
2.2 降低发酵培养基含氮量对卡那霉素合成的影响
原发酵培养基中含有黄豆饼粉50 g/L,NaNO38 g/L,降低发酵培养基含碳量有利于卡那霉素合成,为平衡碳氮比,研究降低发酵培养基含氮量对卡那霉素合成的影响,结果见表2.
表2降低发酵培养基含氮量对卡那霉素合成的影响
Table2Effectofreducingfermentationculturednitrogencontentonkanamycinsynthesis
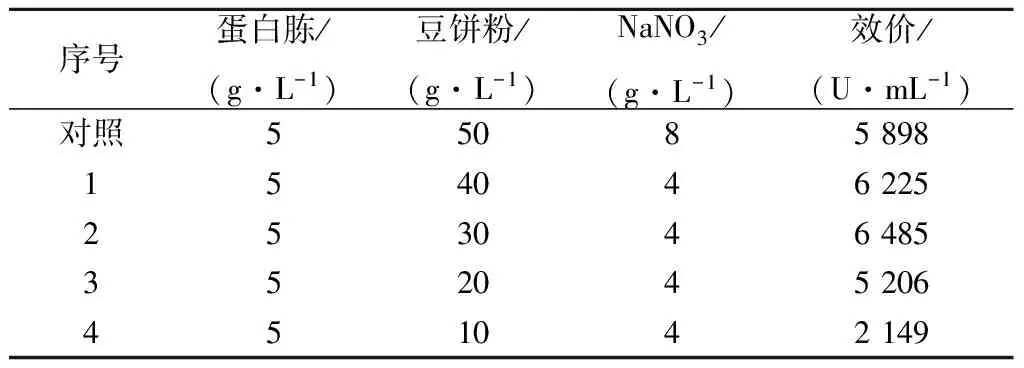
序号蛋白胨/(g·L-1)豆饼粉/(g·L-1)NaNO3/(g·L-1)效价/(U·mL-1)对照55085898154046225253046485352045206451042149
由表2可见:黄豆饼粉从50 g/L降到30 g/L,NaNO3从8 g/L降到4 g/L,卡那霉素效价提高10%;黄豆饼粉质量浓度继续从30 g/L 降到10 g/L,效价不断下降.说明发酵培养基初始配方中黄豆饼粉30 g/L、NaNO34 g/L、蛋白胨5 g/L为最佳氮源组合.
由2.1和2.2的摇瓶发酵结果可见:降低初始碳和氮的质量浓度,不仅没有降低产量,卡那霉素的效价反而提高,说明发酵培养基可以降低组分浓度.
2.3 连续补料对卡那霉素合成的影响
抗生素是次级代谢产物,在发酵后期营养物质匮乏的情况下才能合成,但营养物质的缺乏又不能大量持久地合成抗生素.因此连续低浓度补料可以维持抗生素的长时间合成.发酵液pH的变化会影响各种酶活、基质利用速率和细胞结构,影响菌体细胞膜电荷状况,引起膜渗透性的变化,从而影响菌体对养分的吸收和代谢产物的分泌[5].因此控制好发酵液的pH值有利于卡那霉素合成.
为更好地进行连续补料发酵,对不补料发酵过程的工艺参数作图分析,结果见图1.
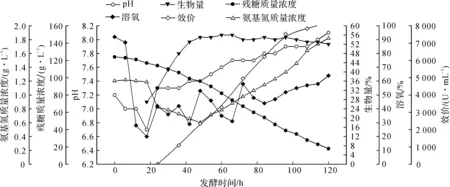
图1 不补料工艺的发酵曲线Fig.1 No feeding process of fermentation
由图1可见:在发酵18,42,66,85 h,通过4 次补水稀释发酵液,使溶解氧回升;发酵至96 h,pH高达7.9,糖和溶氧耗速率下降,卡那霉素效价增长趋缓,说明营养及环境条件不适合菌体合成卡那霉素,需要补料及代谢条件的平衡.
应用50 L自控发酵罐,按方法1.2.2发酵120 h.每6 h取样,通过斐林试剂法测定发酵液残糖含量.通过流加玉米淀粉水解液,控制发酵液总糖质量浓度在(25±5) g/L.通过自动流加氨水控制pH为6.8±0.05.发酵72 h后,依据维持较高的摄氧率流加酵母粉溶液.连续补料发酵结果见表3.
表3连续补料对卡那霉素合成的影响
Table3Effectofcontinuousfeedingonkanamycinsynthesis
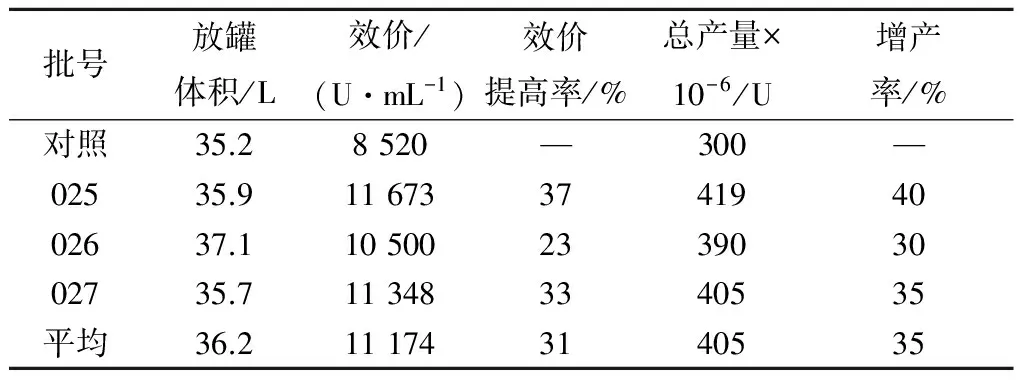
批号放罐体积/L效价/(U·mL-1)效价提高率/%总产量×10-6/U增产率/%对照35.28520—300—02535.911673374194002637.110500233903002735.7113483340535平均36.2111743140535
取表3中025批次发酵罐的发酵参数作图,结果见图2.由表3和图2可见:采用补料工艺,控制发酵液pH,卡那霉素效价平均提高31%,最高达37%,总产量平均提高35%,最高增产率达40%.
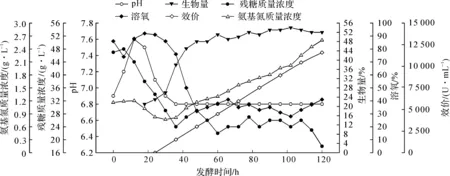
图2 补料工艺的发酵曲线Fig.2 Feeding process of fermentation
2.4 延长发酵周期对卡那霉素合成的影响
分析图1,2两条发酵曲线发现:连续补料发酵至120 h时,发酵液中残留总糖和氨基氮含量仍较高,比较补料与不补料两种发酵过程中卡那霉素的效价及合成速率,结果见图3.
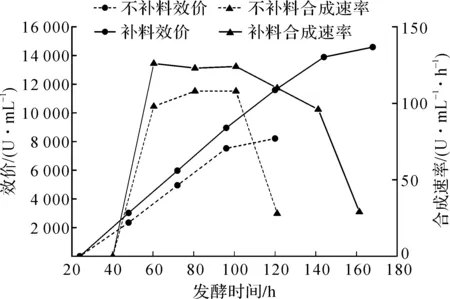
图3 连续补料与不补料发酵过程中卡那霉素效价与合成速率的变化Fig.3 Variation of kanamycin titer and synthesis rate in continuous and non-fed fermentation
由图3可见:不补料发酵工艺卡那霉素合成速率96 h后出现大幅下降,而流加补料工艺发酵至96~120 h,卡那霉素合成速率仍较高,达110 U/(mL·h);发酵周期延长到144 h,卡那霉素合成速率仍在96 U/(mL·h),再延长到168 h,卡那霉素发酵合成速率降低明显,因此卡那霉素补料工艺的最佳发酵周期为144 h.
2.5 卡那霉素补料新工艺稳定性的研究
采用低浓度碳氮源发酵培养基,通过流加玉米淀粉水解液和酵母粉溶液,控制pH和溶氧,延长发酵周期至144 h,平行3 罐验证发酵新工艺的稳定性,结果见表4.
表4卡那霉素补料新工艺稳定性的验证结果
Table4Verificationresultsofnewfeedingprocessstabilitykanamycinfermentation
实验批号效价/(U·mL-1)放罐体积/L总产量×10-6/U效价提高率/%增产率/%对照820635.22891001000401397337.05171701790411337637.24981631720421388736.7510169170平均1374537.0508167176
由表4可见:连续补料发酵工艺与原不补料工艺比较,卡那霉素效价最多提高70%,平均提高67%,产量最多提高79%,平均提高76%.平行3 罐验证发酵新工艺的稳定性好,效价和产量差异均小于5%.
3 结 论

参考文献:
[1] 王嶽, 方金瑞. 抗生素[M]. 北京:科学出版社, 1988.
[2] 赖滨霞. 间歇补料发酵方法在卡那霉素发酵中的应用[J].海峡药学, 2010,22(12):23-24.
[3] 王炫, 谢希贤, 蔡传康, 等. 谷氨酸棒杆菌KGA-3产α-酮戊二酸补料分批发酵工艺优化[J].发酵科技通讯, 2016,45(1):45-49.
[4] 魏春, 刘利峰, 孔令民, 等. 毕赤酵母生产重组β-半乳糖苷酶的指数补料分批发酵研究[J].发酵科技通讯, 2015, 44(4):6-9.
[5] 李继安, 林惠敏, 牛金刚, 等. 流加补料技术在林可霉素发酵中的应用[J].中国医药工业杂志, 2012,43(9):739-742.
[6] 储炬, 李友荣. 现代工业发酵调控学[M]. 3版. 北京:化学工业出版社, 2016.
