基于单中心的局部巨大乳腺癌手术切除后胸壁重建及巨大创面修复策略
2018-05-04马晓飞杨燕文冯自豪亓发芝顾建英
朱 明, 马晓飞,杨燕文, 张 勇*, 冯自豪*, 亓发芝, 顾建英
1. 复旦大学附属中山医院整形外科,上海 200032 2. 御颜医疗美容诊所,北京 100000
局部巨大乳腺癌(locally advanced breast cancer, LABC)一直缺乏统一的定义,目前一般参照美国临床肿瘤协会(American Joint Committee on Cancer, AJCC)2011年的标准将肿瘤直径大于5 cm、累及皮肤或胸壁、伴有淋巴结融合固定(T3/T4N2)或同侧锁骨下淋巴结转移(N3)且无远处转移证据(M0)的乳腺癌定义为LABC[1]。随着乳腺癌知识的普及,乳腺癌的筛查以及诊断技术的发展,早期乳腺癌的诊断率越来越高,治疗效果也越来越好,但由于地区发展的不平衡性、接受教育水平差异等因素,仍有很多患者就诊时瘤体巨大,甚至侵及胸壁全层,失去了保留乳房或微创治疗的机会,而只能接受LABC的综合治疗[2-3]。
AJCC推荐的LABC术前辅助治疗,无论是新辅助化疗或放疗,目的均是缩小肿瘤体积,消除潜在的远处微小转移,为最终外科手术切除创造机会。LABC手术切除后常遗留巨大的缺损创面,术后有效修复巨大创面以重建胸壁功能、保留美观外形是目前亟待解决的临床难题[4]。为此,2006年3月至2017年8月11年间,我科尝试采用局部皮瓣、胸大肌肌皮瓣及乳房瓣、侧胸壁皮瓣、带蒂背阔肌肌皮瓣、腹直肌肌皮瓣、游离腹壁下动脉穿支(deep inferior epigastric perforator, DIEP)皮瓣等多种方法对LABC术后巨大创面进行修复重建,取得了初步疗效,形成了初诊的诊疗策略,现总结如下,供同行参考。
1 资料与方法
1.1 一般资料 回顾性分析2006年3月至2017年8月我科收治的252例LABC患者的临床资料。LABC诊断标准:肿瘤直径>5 cm,肿瘤累及皮肤或胸壁,伴有淋巴结融合固定(T3/T4N2)或同侧锁骨下淋巴结转移(N3)的乳腺癌,且无远处转移证据(M0)[1]。本研究经医院伦理委员会审核批准,所有患者均知情同意并签署知情同意书。
1.2 术前辅助治疗及准备 术前与患者及家属充分沟通,纠正贫血、低蛋白血症,稳定全身状况,相关科室联合会诊确定手术指征及围手术期治疗方案。142例患者接受术前化疗,均为多柔比星+环磷酰胺(AC)方案,其中89例化疗3次后肿瘤略有缩小,53例化疗未见明显缩小。
1.3 肿瘤切除及创面修复
1.3.1 肿瘤切除 所有患者接受全身麻醉。麻醉满意后,于肿瘤边缘2 cm以上扩大切除肿瘤及周围皮肤和软组织。切开皮肤后逐层分离结扎瘤体主要滋养血管,由四周向中央剥离切除,完整分离肿瘤。切除深度超越肿瘤累及层次的下一个层次。若肿瘤侵及胸骨或肋骨,术中将胸骨或肋骨一并切除。切除肿瘤送术中快速冰冻病理检查,确认四周及基底切缘有无肿瘤累及,确认均无累及后进行创面修复。
1.3.2 创面修复 切除肿瘤后,遗留胸壁巨大创面,需要采用整形外科技术进行修复和重建。对于胸骨或肋骨切除患者,胸膜均不予修复。3根以下肋骨缺损或胸骨部分缺损不影响胸壁稳定性,可不修复,直接皮瓣覆盖修复创面。3根及以上的肋骨缺损或胸骨全部缺损,以个性化钛网固定恢复其胸壁结构的完整性和连续性。对于软组织缺损,根据创面大小可选择局部皮瓣、胸大肌肌皮瓣及乳房瓣、侧胸壁皮瓣、带蒂背阔肌肌皮瓣、腹直肌肌皮瓣、DIEP皮瓣等进行修复。皮瓣下放置引流管负压引流,关闭创面。
1.4 术后处理及综合治疗 术区适当给予加压包扎,注意保护皮瓣蒂部。患侧上肢制动,防止术区皮瓣下积液。引流管视引流量,可放置5~7 d以上。所有患者术后均按照美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)最新《NCCN乳腺癌临床实践指南》给予规范化术后综合治疗,包括化疗、放疗等。
1.5 术后随访 所有患者术后每3~6个月至门诊随访,检查内容包括:局部复发情况(体格检查)、乳腺影像学检查、头胸腹CT或腹腔彩超检查、子宫附件彩超和全身骨扫描等检查,收集患者术后并发症、局部复发及远处转移等指标。随访时间截至2017年11月30日。
生存质量评价:采用世界卫生组织生存质量问卷(World Health Organization Quality of Life with 100 question, WHOQOL-100)进行生存质量评价,包括100个问题涵盖与生存质量相关的6个领域,每个条目为5级评分法(1~5),得分越高,表示该领域生存质量越好,各领域分数之和作为评价生存质量的指标。

2 结 果
2.1 患者基本人口学特征及病理分型 所有患者均为女性,年龄38~67岁,平均(47.5±9.2)岁,均为单侧,左侧肿物137例(54.4%),右侧肿物115例(45.6%);肿物所占面积均超过乳房1/4;173例表现为乳房肿块伴有疼痛,56例伴破溃,23例合并胸骨或肋骨骨髓炎症状。197例为原发性晚期乳腺癌(78.2%),55例为复发肿瘤(21.8%)。术后病理类型包括:乳腺浸润性导管癌91例(36.1%),分叶状纤维肉瘤64例(25.4%),腺癌53例(21.0%),黏液癌35例(13.9%),鳞状细胞癌9例(3.6%)。
2.2 手术相关情况 所有患者乳腺肿块均被顺利切除,患者住院时间9~45 d,平均(12.9±3.4) d,术后随访5~72个月,平均(18.7±9.6)个月。平均手术时长(3.8±1.7) h,术中平均出血(348.4±106.6) mL。83例接受术中输血,输血量平均(230.6±90.2) mL。肿块面积最大为30 cm×25 cm,最小为5 cm×13 cm;合并胸骨或肋骨缺损71例(28.2%),其中30例无需钛网修复,41例应用个性化钛网重建胸壁。
修复软组织缺损皮瓣面积为14 cm×6 cm~29 cm×30 cm,其中应用侧胸壁皮瓣34例(13.5%,图1A)、胸大肌肌皮瓣及乳房瓣31例(12.3%,图1B)、带蒂背阔肌肌皮瓣98例(38.9%,图1C)、腹直肌肌皮瓣56例(22.2%,图1D)、DIEP皮瓣17例(6.7%,图1E)、局部皮瓣修复16例(6.3%)。
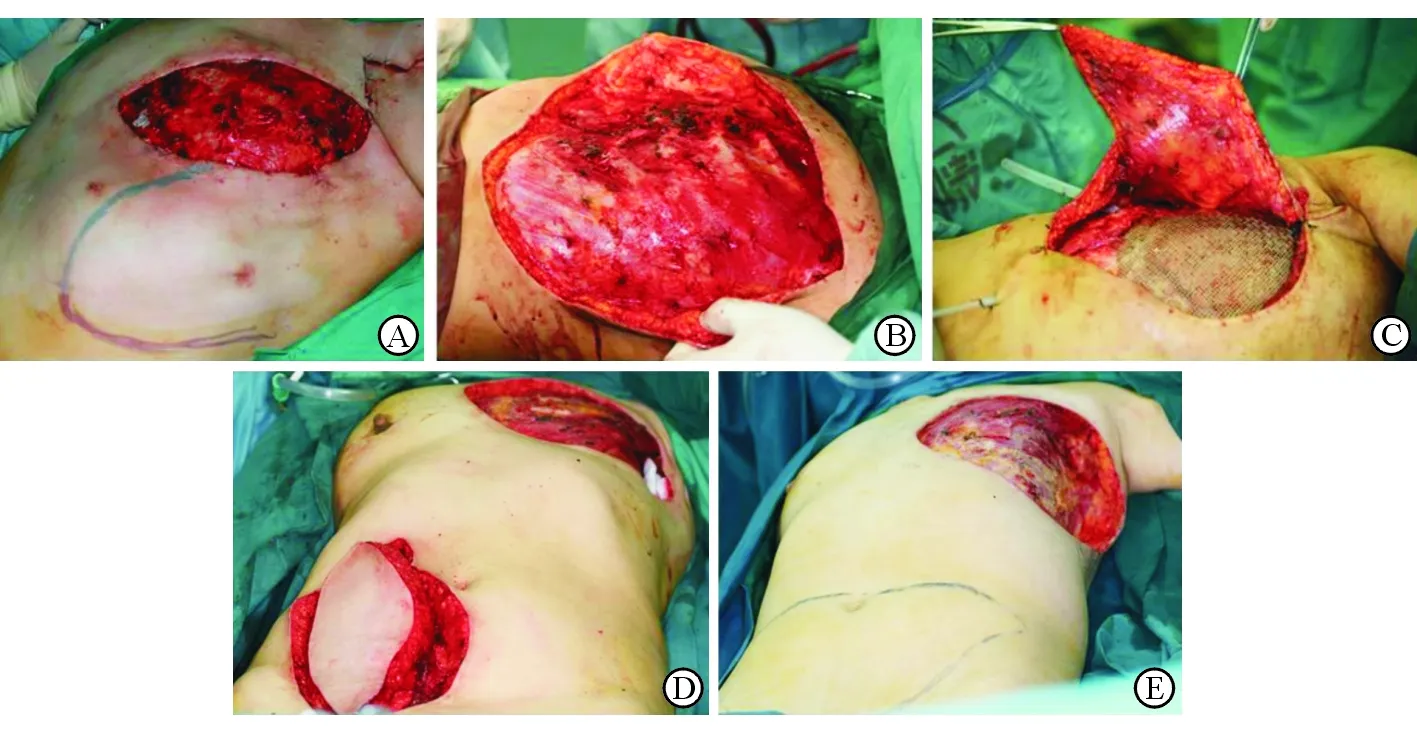
图1 LABC巨大创面修复常用皮瓣
2.3 术后疗效及随访 术后皮瓣均存活良好,2例皮瓣远端出现淤血及表皮糜烂,采用50% MgSO4湿敷及全身应用前列地尔等改善皮瓣血运后二期愈合。1例由于胸壁钛网塑形不佳,于术后1年发生皮肤穿破行二次手术,经钛网修剪重塑后,愈合良好,形态满意。其余病例均恢复良好,皮瓣外形及功能恢复满意,生活质量评分从术前的(54.3±7.8)分升高至术后的(114.7±6.6)分,差异有统计学意义(P<0.01)。术后117例接受内分泌治疗,35例接受靶向治疗。至随访结束,肿瘤复发11例,死亡5例。
2.4 典型病例
2.4.1 病例1 患者女性,40岁,7个月前因左侧乳腺癌在外院行左乳癌根治术,术后接受化疗、放疗,缺少外院资料。患者于2009年3月11日至我院就诊,体格检查:左侧胸壁中央偏外侧区肿块,大小约7 cm×9 cm,质硬,固定伴破溃,双侧腋窝淋巴结未触及肿大(图2A)。
入院后完善相关术前检查后行手术治疗,手术完整切除肿瘤,并切除第2~5肋部分肋骨。经钛网重建胸壁骨性支撑后,行左侧带蒂背阔肌肌皮瓣关闭创面(图2B~2F)。术后病理示浸润性导管癌。术后患者恢复良好,接受化疗、放疗及内分泌治疗,随访3年无肿瘤复发。
2.4.2 病例2 患者女性,34岁,2年前发现左乳外下象限扪及一肿物,形状不详,肿块增长迅速,未及时就诊,自行服中药治疗。近4个月来肿物出现破溃流脓,伴恶臭,严重影响日常生活,遂于2013年6月20日来我院就诊。体格检查:肿块侵及整个左乳,大小约15 cm×20 cm,表面覆有脓苔,肿块质硬,不可推动;左腋下扪及融合成团的肿大淋巴结(图3A)。
入院后完善相关术前检查后行手术治疗,手术完整切除肿瘤,包括左侧整个乳房及第3~6肋软骨(图3B),术中冰冻病理提示切缘阴性后行胸壁重建,钛网修复胸壁骨性缺损,右侧带蒂背阔肌肌皮瓣修复软组织缺损(图3C、3D)。术后病理提示分叶状纤维肉瘤。患者术后恢复良好,接受化疗,随访1年肿瘤无复发。
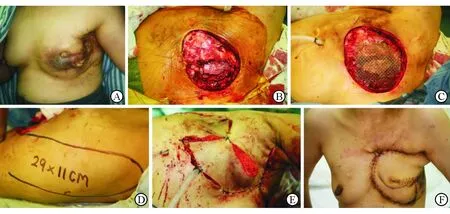
图2 典型LABC病例1手术前后局部表现
A: 左侧LABC术前;B:肿瘤切除后创面;C:螯合钛网修复胸壁骨性支撑;D:设计同侧背阔肌肌皮瓣修复创面;E:关闭创面即刻;F:术后1周正面观
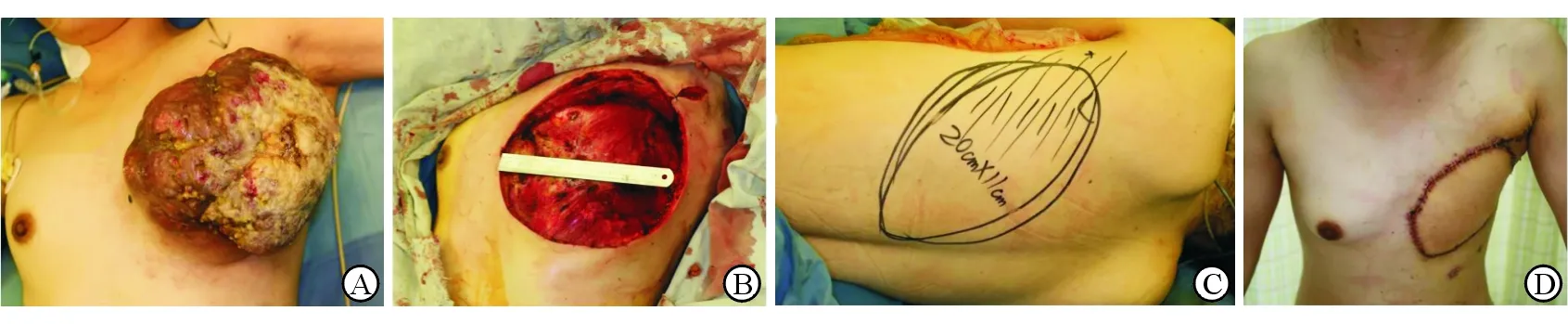
图3 典型LABC病例2手术前后局部表现
A: 左侧LABC术前;B:肿瘤切除后遗留创面;C:设计同侧带蒂背阔肌肌皮瓣修复;D:术后1周正面观
3 讨 论
乳腺癌发病率占女性恶性肿瘤的第一位,且逐年上升,并有年轻化的趋势[2]。手术治疗目前仍是乳腺癌根治的首选手段,但LABC术后的巨大创面修复一直是临床棘手的难题[5]。因此,本研究回顾性分析了我科既往11年的LABC患者的相关资料,总结了围手术期处理原则、手术切除及术后创面修复经验,切实提高LABC患者的治疗水平。
3.1 LABC综合治疗流程 总结11年252例LABC患者的治疗经验,我们逐渐形成了精准、特色的LABC患者综合治疗流程及创面修复策略(图4):LABC患者入院后应先考虑肿瘤科会诊,辅以新辅助化疗或放疗。目的是希望通过非手术手段减小肿瘤负荷,为手术切除、创面修复等创造积极因素,再考虑手术切除。手术切除原则是切除范围至少沿肿物外缘扩大2 cm,深度超过肿瘤侵犯深度的下一层次,以保证充分的阴性切缘。若伴有胸壁全层缺损,连续缺损3根以上肋骨,考虑钛网修补,恢复胸廓完整性。胸廓外遗留的巨大软组织创面视缺损大小和缺损部位,行局部皮瓣、侧胸壁皮瓣、带蒂背阔肌肌皮瓣、腹直肌肌皮瓣、胸大肌肌皮瓣及乳房瓣和DIEP皮瓣修复。
3.2 LABC术前准备策略 乳腺癌属于全身性疾病而非局部疾病,发病早期就可出现血行扩散,而LABC的远处转移可能性更大。因此,LABC患者术前需要接受新辅助化疗。新辅助化疗能够提供有效的全身系统治疗,达到控制局部肿瘤病灶、消除远处亚临床微小转移灶的目的,导致肿瘤降期,而提供手术时机。接受新辅助化疗后接受手术切除的患者,其无瘤生存期明显高于未接受新辅助化疗的患者[6]。因此,临床收治的LABC患者应常规先接受新辅助化疗,视化疗后的治疗反应制定下一步手术方案。
3.3 LABC手术切除及创面修复策略
3.3.1 肿瘤切除范围的选择 肿瘤按外科原则切除,切除范围至肿瘤边缘2 cm以上,深度跨越肿瘤侵犯层次的下一层次。对肿瘤已侵犯胸骨、肋骨及肋间肌甚至胸膜者,需行全层胸壁切除术。全层胸壁缺损的修复包括胸膜腔的处理、胸廓支架和软组织的覆盖。由于术中一般不涉及胸膜腔内器官,仅切除部分壁层胸膜,故胸膜可以不修复,依靠黏膜爬行或假膜形成[7],必要时也可用肌瓣或大网膜瓣来修复、填塞其残端。
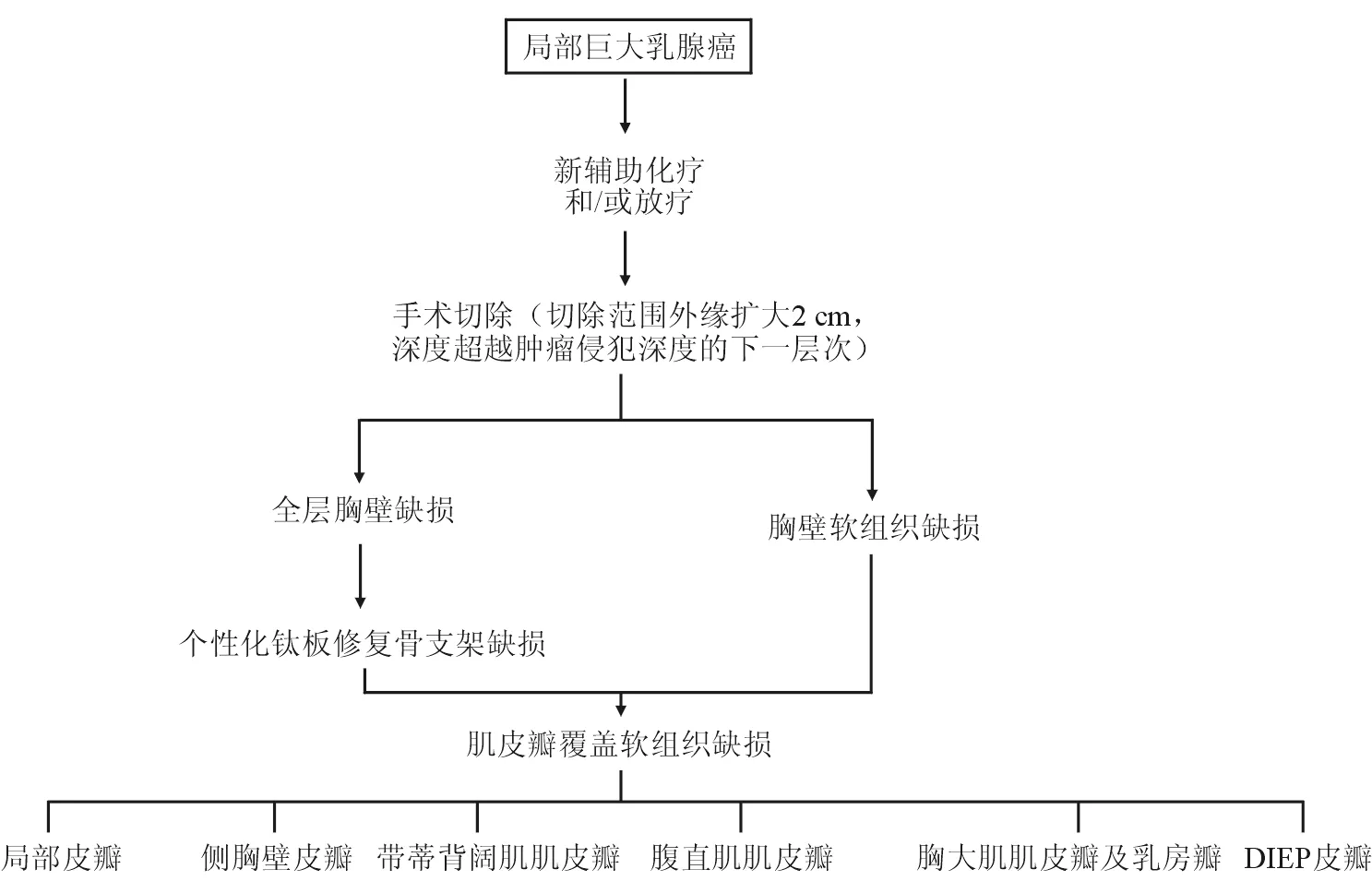
图4 LABC患者综合治疗流程及创面修复策略
3.3.2 胸壁重建方法的选择 稳定的胸廓结构是正常呼吸及保护胸腔内重要器官的前提,故术中恢复胸壁的连续性和稳定性极其重要[7]。我科的经验是:3根以下的肋骨缺损或胸骨部分缺损不影响胸壁的稳定性,可不修复,直接皮瓣覆盖修复创面;3根及以上的肋骨缺损或胸骨全部缺损,影响了胸壁的连续性,会遗留反常呼吸等严重后果,一般建议修复。目前多采用钛网螯合一定的角度制备出个性化钛网,以顺应胸廓的弧度来重建胸壁的立体性,并且钛网具有质轻、硬度适中的优势,能够支撑胸廓活动的稳定性。本研究的长期随访结果提示,钛网是修复胸廓骨支架缺损的理想材料,仅1例出现钛网变形,边缘翘起后患者疼痛,经二次手术钛网修剪和重塑后,症状消失,患者满意,与文献研究[8]结果基本类似。
3.3.3 巨大创面修复方法的选择 在重建胸廓的完整性后,LABC遗留的巨大软组织创面常不能直接拉拢关闭,因此需要采用整形外科修复重建手段,选择合适的皮瓣或肌皮瓣修复创面。如何选择合适的皮瓣以达到胸壁形态的良好恢复需要整形外科医师多角度的考量[9-10],根据缺损部分的面积大小、肌肉组织缺失量、缺损位置选择合适的皮瓣修复,常用皮瓣包括局部皮瓣[11]、胸大肌肌皮瓣及乳房瓣[12]、侧胸壁皮瓣[13]、带蒂背阔肌肌皮瓣[14]、腹直肌肌皮瓣[15]、DIEP皮瓣[16]等。根据我们的经验,若缺损面积较小,在不影响乳头乳晕位置形态的前提下,可灵活选用局部皮瓣修复。若胸壁缺损面积不大,且靠近胸壁中部,可选择对侧乳房瓣或胸大肌肌皮瓣。若创面局限于一侧胸壁,且前胸容量没有太大缺失,侧胸壁皮瓣是较合适的选择。若前胸容量有较大缺失,且同侧肩胛下血管保存完好,背阔肌肌皮瓣则是理想的选择,应用肌皮瓣修复,不仅可以有效关闭创面,还能够补充一定的容量缺损[17]。该皮瓣可切取范围较大,基本可达到同侧胸壁创面的任何部位,且肌肉组织量丰富,是LABC切除后修复胸壁缺损较理想的材料,占本研究修复方法的38.9%。腹直肌肌皮瓣血供确定,切取方便,术中无需变换体位,也是有效的修复方式。但由于该肌皮瓣破坏部分腹壁肌力,且修复胸骨上1/3区域时因张力过大而受到一定的限制。DIEP皮瓣由于其组织量丰富,尤其适合于有乳房一期再造要求的患者,但由于腹壁下动脉穿支存在变异,较难解剖,且要求术者具有较娴熟的显微外科技术。因此,DIEP皮瓣在临床上的应用受到一定限制,常作为缺损修复的最后一道防线。
当然,修复胸壁缺损的皮瓣有多种选择,应根据手术具体情况灵活运用,必要时可选择多个皮瓣联合修复,也可结合游离断层皮片移植技术[18]。同时,术后的护理也至关重要,皮瓣的供区和移植区需各放置负压引流管1根,背阔肌肌皮瓣供区下的引流管由于背部活动的剪切力,容易皮下积液,可多放置一段时间。
3.4 术后综合治疗方案 LABC的治疗需采取综合治疗的理念和态度,以手术等多种方式联合控制肿瘤的发展,需整形外科、肿瘤内科等多学科的合作[19],以期获得在切除肿瘤的同时,使患者的心理和生理创伤最小化,提高患者的生存质量。术后需要根据患者病理结果及个人情况接受化疗、放疗、内分泌治疗以及心理治疗。
综上所述,LABC患者的治疗需要多学科的协作,术前新辅助化疗的应用、术中肿瘤切除范围的选择、巨大创面的修复及术后综合治疗方案均需全面考虑、精准制定,以达到最佳的恢复效果,提升患者的生存质量,改善患者预后。
[ 1 ] 冯自豪, 张 勇, 杨燕文, 等. 巨大局部晚期乳腺癌的手术和修复[J].中华乳腺病杂志(电子版),2010,4(6):701-711.
[ 2 ] VAN SCHALKWYK L, BENN C, BERGSTROM K. Reconstruction in locally advance breast cancer: who, what and when?[J]. S Afr J Surg, 2017,55(3):74.
[ 3 ] 王 珏,蔡 慧,傅忠星,等.2004—2011年上海市原卢湾区女性乳腺癌的发病率及死亡率分析[J].中国临床医学,2017,24(5):732-735.
[ 4 ] ARNAOUT A, BOILEAU J F, BRACKSTONE M. Surgical considerations in locally advanced breast cancer patients receiving neoadjuvant chemotherapy[J].Curr Opin Support Palliat Care, 2014,8(1):39-45.
[ 5 ] KANG H J,LEE S A,PARK K S,et al.Simultaneous chest wall reconstruction after sternectomy and modified radical mastectomy in locally advanced breast cancer with solitary sternal metastasis[J].J Breast Cancer, 2012,15(4):462-467.
[ 6 ] KHALIL H H,MALAHIAS M N,BALASUBRAMANIAN B,et al.Multidisciplinary oncoplastic approach reduces infection in chest wall resection and reconstruction for malignant chest wall tumors[J]. Plast Reconstr Surg Glob Open, 2016,4(7):e809.
[ 7 ] HILLE U, SOERGEL P, ZARDO P, et al. Chest wall resection and reconstruction for locally advanced primary breast cancer[J].Arch Gynecol Obstet, 2013,287(6):1205-1209.
[ 8 ] NODA M, ENDO C, HOSAKA T, et al. Dedifferentiated chondrosarcoma of the chest wall: reconstruction with polypropylene mesh using a transverse rectus abdominis myocutaneous flap[J]. Gen Thorac Cardiovasc Surg, 2011,59(3):199-201.
[ 9 ] ZUCCA MATTHES A G, UEMURA G, KERR L, et al. Feasibility of oncoplastic techniques in the surgical management of locally advanced breast cancer[J].Int J Surg, 2012,10(9):500-505.
[10] PETIT J Y, RIETJENS M, LOHSIRIWAT V, et al. Update on breast reconstruction techniques and indications[J].World J Surg, 2012,36(7):1486-1497.
[11] PARK J S, AHN S H, SON B H, et al.Using local flaps in a chest wall reconstruction after mastectomy for locally advanced breast cancer[J].Arch Plast Surg, 2015,42(3):288-294.
[12] BONOMI S,SALVAL A,SORBI F,et al.Chest wall reconstruction for locally advanced breast cancer with the V-Y thoracoabdominal perforator flap[J].Plast Reconstr Surg,2012,129(2):361e-362e.
[13] HAZEL K,WEYANT M J.Chest wall resection and reconstruction: management of complications[J].Thorac Surg Clin,2015,25(4):517-521.
[14] SEPESI B.Management of breast cancer invading chest wall[J].Thorac Surg Clin,2017,27(2):159-163.
[15] PANTELIDES N M,YOUNG S S,IYER S.The rectus abdominis muscle advancement flap as a salvage option for chest wall reconstruction[J].Ann R Coll Surg Engl, 2017,99(5):e142-e144.
[16] LEE S,JUNG Y,BAE Y.Immediate chest wall reconstruction using an external oblique myocutaneous flap for large skin defects after mastectomy in advanced or recurrent breast cancer patients: A single center experience[J]. J Surg Oncol, 2018,117(2):124-129.
[17] LAFORGIA R, PUNZO C, PANEBIANCO A, et al.Surgical approach for ulcerated locally advanced breast cancer. A single Center experience: a retrospective study[J].Ann Ital Chir,2017,88. pii: S0003469X1702615X.
[18] TANOS G, PROUSSKAIA E, CHOW W, et al. Locally advanced breast cancer: autologous versus implant-based reconstruction[J].Plast Reconstr Surg Glob Open,2016,4(2):e622.
[19] HARATI K, KOLBENSCHLAG J, BEHR B, et al.Thoracic wall reconstruction after tumor resection[J].Front Oncol, 2015,5:247.
