基于单中心的原发性局限期食管小细胞癌根治手术临床疗效分析
2018-05-04徐志远陆超敬李春光王晓伟杨立信陈和忠
徐志远, 陆超敬, 李春光, 王晓伟, 金 海, 杨立信, 陈和忠, 朱 吉
海军军医大学附属长海医院胸外科,上海 200433
原发性局限期食管小细胞癌是食管肿瘤的特殊类型,发病率低,仅占食管肿瘤的0.5%~2.4%,但具有上皮及神经内分泌双重特性,恶性程度高,预后差[1-2],目前尚缺乏有效的临床诊治共识[3]。其中,关于根治性手术切除能否提高局限期原发性局限期食管小细胞癌的远期预后目前争议较大[4]。因此,本研究基于单中心原发性局限期食管小细胞癌患者的临床资料进行回顾分析,探讨根治性手术切除与患者预后的相关性,为规范原发性局限期食管小细胞癌的临床诊治提供参考。
1 资料与方法
1.1 一般资料 回顾性分析海军军医大学附属长海医院胸外科2010年10月1日至2017年7月31日收治的经病理确诊的1 997例食管癌患者的临床资料,对其中病理确诊的30例(1.6%)原发性食管小细胞癌患者进行深入分析 (排除他部位转移肿瘤)。30例患者中男23例,女7例;年龄42~77岁,平均年龄(60.6±8.3)岁。术前活检病理诊断为鳞癌15例,低分化癌9例,小细胞癌4例,平滑肌瘤2例;术后病理均诊断为小细胞癌。术前、术后病理诊断一致率为13.33%(4/30)。术后根据小细胞肺癌的VALSG标准进行病理分期,30例患者均为局限期,TNM分期ⅠB 3例、ⅡB 15例、ⅢA 1例、ⅢB 6例、ⅢC 5例。术后病理:胃周淋巴结转移10例,纵隔淋巴结转移8例,颈部淋巴结转移3例。本研究经医院伦理委员会审核批准,所有患者均知情同意并签署知情同意书。
1.2 手术治疗
1.2.1 术前准备 原发性食管小细胞癌患者术前接受常规胃镜检查,取活检组织行病理诊断,先期已在外院获得活检组织需经本院病理科会诊。采用上消化道钡餐及胸部增强CT检查进一步明确患者临床分期并评估手术方式。确诊后完善相关术前检查,所有患者术前心肺功能检查需能够耐受手术。
1.2.2 根治性切除手术 采用静吸复合麻醉单肺通气,13例采用左胸手术入路,17例采用右胸腹两切口入路。经左胸食管癌根治术:后外侧切口第7肋进胸,根据肿瘤位置游离食管至下肺静脉水平或主动脉弓下;在肝脾间打开膈肌进入腹腔,打开小网膜并离断网膜左动脉,切开大网膜,暴露胃左动脉并离断;制作管状胃于胸腔行食管-胃端侧吻合;最后清扫纵隔及腹腔淋巴结,对CT提示颈部淋巴结明显增大的患者行颈部淋巴结清扫及左颈吻合。
胸腹两切口食管癌根治术:侧卧位右后外侧或麻花位前外侧切口进胸,切断奇静脉弓,游离胸部全长食管至胸顶;上腹正中切口进腹,游离胃大小弯,保留网膜右血管;于胰腺上方胃左动脉根部离断该血管,使胃充分游离;制作管状胃,并于胸腔顶行食管-胃端侧吻合(全腔镜患者采用三切口颈部吻合);常规清扫纵隔及腹腔淋巴结,对CT提示颈部淋巴结明显增大者行颈部淋巴结清扫。
1.3 辅助治疗方案 化疗方案:紫杉醇(paclitaxel,PTX;商品名为紫素,北京协和制药厂产品)175 mg/m2,静脉滴注3 h,d1;顺氯氨铂(DDP,澳大利亚Faulding公司产品)40 mg/m2,静脉滴注,d2、d3;21 d为1个周期,化疗有效者最多接受6个周期治疗。
放疗方案:直线加速器2野照射,第1~4周(第1~28天)常规分割2.0 Gy/次,1次/d,5 d/周,连续治疗,总剂量40 Gy。
1.4 术后随访 术后常规进行定期门诊及电话随访,随访截止时间为2017年6月30日。
1.5 统计学处理 采用SPSS 21.0软件进行数据分析,Kaplan-Meier生存曲线分析术后生存情况,Cox回归模型分析患者预后影响因素,检验水准(α)为0.05。
2 结 果
2.1 手术情况及患者预后 30例患者均顺利完成手术,住院期间发生吻合口瘘2例,胸腔出血1例;术后30例患者均顺利出院,住院时间10~25 d,平均住院时间为(12.5±2.8) d。治疗方式:术前化疗+根治性切除手术+术后化疗2例,单纯根治性切除手术4例,根治性切除手术+术后化疗19例,根治性切除手术+化疗+放疗3例,根治性切除手术+放疗2例。
结果(图1A)表明:随访(34.86±15.15)个月,30例患者总体中位生存时间为15.27个月,95%可信区间(confidence interval,CI)为8.86~21.68个月;术后1年生存率为54.8%,2年生存率为35.1%,3年生存率26.4%。
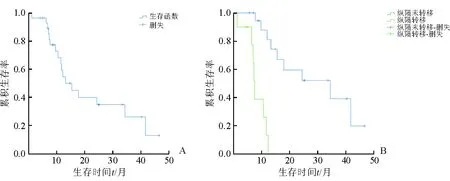
图1 原发性局限期食管小细胞癌患者术后生存曲线
2.2 患者预后影响因素分析 Cox回归模型分析结果(表1)表明:纵隔淋巴结转移是影响患者预后的危险因素(P<0.01)。进一步分析发现,未出现纵隔淋巴结转移患者生存时间明显高于纵隔淋巴结转移患者(图1B)。纵隔淋巴结未转移患者术后1年生存率为81%,2年生存率为51.9%,3年生存率为39%;而纵隔淋巴结转移患者术后1年生存率为12.9%,2年、3年生存率均为0%。2组患者中位生存时间分别为34.17、7.23个月(表2)。
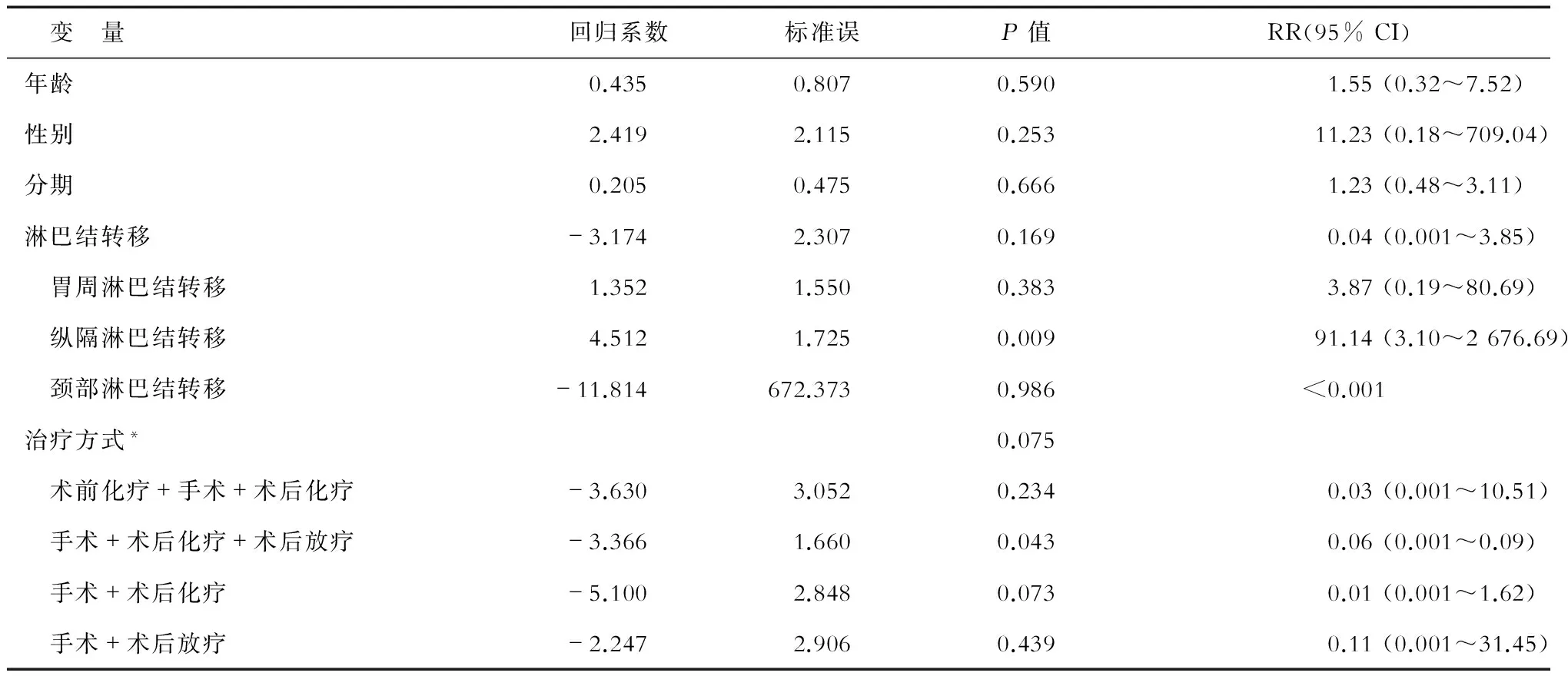
表1 原发性局限期食管小细胞癌患者术后预后影响的多因素Cox回归模型分析
*以单纯手术患者为参照进行比较;RR:风险比

表2 纵隔淋巴结是否转移患者术后生存时间的对比
3 讨 论
原发性食管小细胞癌于1952年首次被Mckeown等发现并报道,因显微镜下类似燕麦巢状结构被命名为“食管燕麦细胞癌”[5]。后续研究[2,6]进一步发现其与肺小细胞癌的生物学行为类似,恶性程度高,进展迅速;其治疗方式以化疗为主,但疗效有限,特别是对处于广泛期的患者疗效甚微。该病发病率较低,患者整体样本量较小[7-9],限制了高级别临床诊疗证据的形成,因此目前缺乏关于该病临床诊疗的统一共识与指南[4]。尤其是对于根治性手术切除及辅助治疗对该病的预后价值仍有争议。
部分研究[7,9]认为在化疗或放疗的基础上联合根治性手术切除对部分局限期患者可获得较理想的治疗效果,但相关研究缺乏对照及长期随访结果。本研究30例患者均接受根治性手术治疗,手术联合化疗的比例为80%(24/30)。长期随访结果表明,患者术后1年、2年、3年生存率分别为54.8%、35.1%和26.4%,提示根治性手术切除有助于改善局限期食管小细胞癌患者的预后。Chen等[10]的研究认为,对于局限期食管小细胞癌患者采用根治性手术切除联合化疗的治疗模式,术后3年生存率接近30%。
另外一部分研究[11-12]认为:无论是否进行根治性手术治疗,化疗是食管小细胞癌不可或缺的治疗手段。即使在原发病灶非常局限的情况(如肿瘤浸润深度为黏膜下层)下,病理学检查仍然发现肿瘤已有脉管侵袭且出现淋巴结转移[13]。食管小细胞癌发生早期已普遍存在转移潜能,特别是淋巴结转移提示预后不良。Lu等[12]回顾性研究发现:淋巴结转移患者1年、2年、3年生存率分别为31.3%、11.4%、5.3%,而未发生淋巴结转移的患者1年、2年、3年生存率明显高于前者,分别为77.3%、42%、28.6%。宋岩等[4]研究发现,66.3%(65/98)的食管小细胞癌患者存在区域淋巴结转移,且区域淋巴结转移是患者预后的重要影响因素(P=0.003)。本研究结果表明,纵隔淋巴结转移与否与患者生存时间显著相关性。多元Cox回归分析发现,相对于纵隔淋巴结未转移患者,纵隔淋巴结转移患者预后更差。结果提示,对于食管小细胞癌患者化疗是基础治疗方式,根治性手术切除联合化疗可改善局限期患者的预后,而一旦出现淋巴结转移,即使选择根治性手术切除亦无法有效改善预后。因此,术前明确病理诊断,明确是否伴淋巴结转移,是判断食管小细胞癌患者预后并决定治疗方案的前提。
本研究中术前胃镜活检病理学诊断的准确率仅13.33%(4/30),低于此前报道的33.8%[4]。较低的诊断准确率给后续治疗方案的选择造成了极大的干扰。术前诊断不准确的原因主要包括2个方面:一是从影像学和内镜大体形态上,食管小细胞癌与食管鳞癌或腺癌难以鉴别,确诊主要依靠病理学诊断[11];二是术前病理诊断H-E染色常不能确诊小细胞癌,主要是因为送检标本过小,取材时受到挤压引起肿瘤细胞严重变形,未分化癌具有多向分化能力,组织中常伴鳞癌或腺癌成分,导致病理确诊困难[1]。为避免上述问题,在胃镜下应多部位取材,注意避免过度挤压组织,镜下病理诊断应结合相应的免疫组织化学染色结果进行综合判断[1,4]。一旦明确诊断为小细胞癌,应通过PET或进一步的活检明确是否存在淋巴结转移,为下一步的临床治疗提供决策依据。
综上所述,原发性食管小细胞癌的恶性程度高,进展快,临床较为少见,目前尚未形成治疗共识。术前明确病理学诊断及是否存在淋巴结转移是判断食管小细胞癌预后及决定进一步治疗方案的前提;根治性手术切除联合化疗有助于改善局限期食管小细胞癌患者的预后;对于已发生淋巴结转移的食管小细胞癌患者,根治性手术切除联合化疗可能无法获得满意的预后。
[ 1 ] XU L, LI Y, LIU X, et al.Treatment strategies and prognostic factors of limited-stage primary small cell carcinoma of the esophagus[J].J Thorac Oncol,2017,12(12): 1834-1844.
[ 2 ] CASAS F, FERRER F, FARRU'S B, et al. Primary small cell carcinoma of the esophagus: a review of the literature with emphasis on therapy and prognosis[J]. Cancer, 1997, 80(8): 1366-1372.
[ 3 ] KU G Y, MINSKY B D, RUSCH V W, et al. Small-cell carcinoma of the esophagus and gastroesophageal junction: review of the Memorial Sloan-Kettering experience[J]. Ann Oncol, 2008, 19(3): 533-537.
[ 4 ] 宋 岩, 王绿化, 赫 捷, 等. 151例食管小细胞癌的治疗与预后分析[J]. 癌症, 2009, 28(3): 303-307.
[ 5 ] MCKEOWN F. Oat-cell carcinoma of the oesophagus[J]. J Pathol Bacteriol, 1952, 64(4): 889-891.
[ 6 ] HUNCHAREK M, MUSCAT J.Small cell carcinoma of the esophagus. The Massachusetts General Hospital experience, 1978 to 1993[J].Chest, 1995, 107(1): 179-181.
[ 7 ] PANTVAIDYA G H, PRAMESH C S, DESHPANDE M S, et al.Small cell carcinoma of the esophagus: the Tata Memorial Hospital experience[J]. Ann Thorac Surg, 2002, 74(6): 1924-1927.
[ 8 ] BENNOUNA J, BARDET E, DEGUIRAL P, et al. Small cell carcinoma of the esophagus: analysis of 10 cases and review of the published data[J]. Am J Clin Oncol, 2000, 23(5): 455-459.
[ 9 ] MEDGYESY D C, WOLFF R A, PUTNAM J B JR, et al. Small cell carcinoma of the esophagus: the University of Texas M.D. Anderson Cancer Center experience and literature review[J]. Cancer, 2000, 88(2): 262-267.
[10] CHEN S B, YANG J S, YANG W P, et al. Treatment and prognosis of limited disease primary small cell carcinoma of esophagus[J]. Dis Esophagus, 2011, 24(2): 114-119.
[11] 苗振军, 高 强, 林一丹, 等. 原发性食管小细胞癌的临床病理特点和多学科治疗的疗效分析[J].中国胸心血管外科临床杂志, 2012, 19 (4): 390-394.
[12] LU X J, LUO J D, LING Y, et al. Management of small cell carcinoma of esophagus in China[J]. J Gastrointest Surg, 2013, 17(7): 1181-1187.
[13] NISHIMAKI T,SUZUKI T,NAKAGAWA S,et al. Tumor spread and outcome of treatment in primary esophageal small cell carcinoma[J]. J Surg Oncol, 1997, 64(2): 130-134.
