自制新型内镜多功能圈套器在离体/活体猪胃肠道内镜电切术中的应用评估
2018-05-04田红丽蔡明琰朱胜军周平红
田红丽, 蔡明琰, 诸 炎, 王 蕴, 朱胜军, 周平红*
1. 复旦大学附属中山医院内镜中心,复旦大学内镜诊疗研究所,上海市消化内镜工程技术研究中心,上海 200032 2. 新疆维吾尔自治区巴州人民医院消化内科,库尔勒 841000
近年来,随着医疗器械的发展及操作技术的进步,内镜下胃肠道手术应用越来越广泛,引起了广泛关注[1-2]。但消化内镜下切除胃肠道病变手术难度较大,步骤复杂,手术器械种类繁多,包括各种高频电切开刀、圈套器、氩气刀(APC)、止血钳等,术中需频繁更换器械来完成切开、剥离、电凝等步骤,对术者提出了较高要求,也给患者带来较重的经济负担[3-4]。其中,内镜圈套器是运用时间最早、运用范围最广的内镜电切器械之一,可完成不同部位隆起病变、带蒂病变、平坦病变的切除[5-8]。
复旦大学附属中山医院内镜中心与常州乐奥医疗科技股份有限公司合作设计制作了具有自主知识产权的新型多功能内镜圈套器,集标记、切开、圈套及氩气刀等多种功能于一体,以降低消化内镜手术的操作难度,提高手术疗效,减轻患者经济负担。本研究采用这种新型多功能内镜圈套器进行了离体猪胃肠、活体猪胃肠的模拟病变切除实验,来评价自制新型圈套器的安全性和有效性。
1 材料与方法
1.1 主要器械及仪器 胃镜(GIF-260,Olympus,日本)、肠镜(EC-3890Fi,Pentax,日本)、注射针(埃尔顿,上海)及配套电切机(乐奥,常州)1台、恒温加热仪(科导超声,上海)。自制新型圈套器(乐奥新品,常州)。
1.2 研究标本及实验用动物来源 市售新鲜猪胃、肠组织各3套;实验用雌性白猪6只,体质量(45±5)kg,由复旦大学附属中山医院实验动物中心、能盛(上海)医疗器械科技咨询有限公司提供。离体胃肠实验及活体猪胃实验在复旦大学附属中山医院实验动物中心进行,活体猪肠实验在能盛(上海)医疗器械科技咨询有限公司完成,两家实验动物中心配备完善的内镜设备、动物实验设备及相关兽医。所有实验均经复旦大学附属中山医院动物实验研究伦理委员会批准并符合相关国家规定。
1.3 体外模拟自制新型圈套器猪胃、肠病变切除术 市售离体猪胃、肠各3套,0.9%氯化钠(生理盐水)冲净。将胃、肠剖开,37℃水浴温箱模拟人体正常体温。3套离体猪胃、猪结肠制备离体猪胃息肉模型、离体猪结肠息肉模型后均接受自制新型圈套器电切,凝切功率参数设置分别为20 W、30 W、40 W,氩气气体流量分别为1.0、1.0、1.2 L/min。
具体操作步骤如下,(1)标记:利用自制新型圈套器对黏膜进行标记,标记大小约1 cm×1 cm的模拟病变。(2)黏膜下注射:抽取0.9%氯化钠+靛胭脂混合液(100 mL生理盐水+1 mL靛胭脂),用注射针在标记范围内行黏膜下注射直径约1.0 cm液体垫(图1A)。(3)预切开病灶边缘:回拉自制新型圈套器手柄,留圈套环前端约5 mm作切开刀用途,沿液体垫边缘切开周围黏膜(图1B)。(4)圈套器电切:推出圈套环套住病灶收紧后电切(图1C)。(5)创面处理:保持器械最前端陶瓷头至病灶上方距离0~5 mm,进行氩气喷凝处理创面,每次1~3 s。

图1 自制新型圈套器体外对猪胃肠模拟病变电切术
1.4 体内模拟自制新型圈套器猪胃、肠病变切除术 雌性白猪实验前禁食48 h,肠道实验前1 d喂服泻药行肠道准备,实验前30 min用1 500~2 000 mL生理盐水通过灌肠器灌肠。采用耳后静脉注射麻醉药进行麻醉,监测生命体征。行常规胃镜检查,在活猪胃体上部选取3处部位,采用自制新型圈套器对模拟病变(直径约1 cm圆形范围)进行标记,黏膜下注射生理盐水将模拟病变隆起(图2A),自制新型圈套器在水垫边缘行预切开(图2B),自制新型圈套器圈套切除标记的黏膜(图2C),观察创面并对肉眼可见的出血点进行氩气喷凝(图2D、2E)。
实验猪接受肠镜检查,距肛缘35 cm内5处肠黏膜分别建立1 cm大小的模拟病变,并进行上述操作(图3)。术后猪继续饲养7 d,术后2 d流质并逐步开放饮食,术后第7天,再次进镜观察有无迟发性出血或穿孔,拍照记录。之后立即安乐死实验猪,解剖其胃、肠,大体观察创面愈合情况,并进行病理分析,确定固有肌层是否有灼伤。
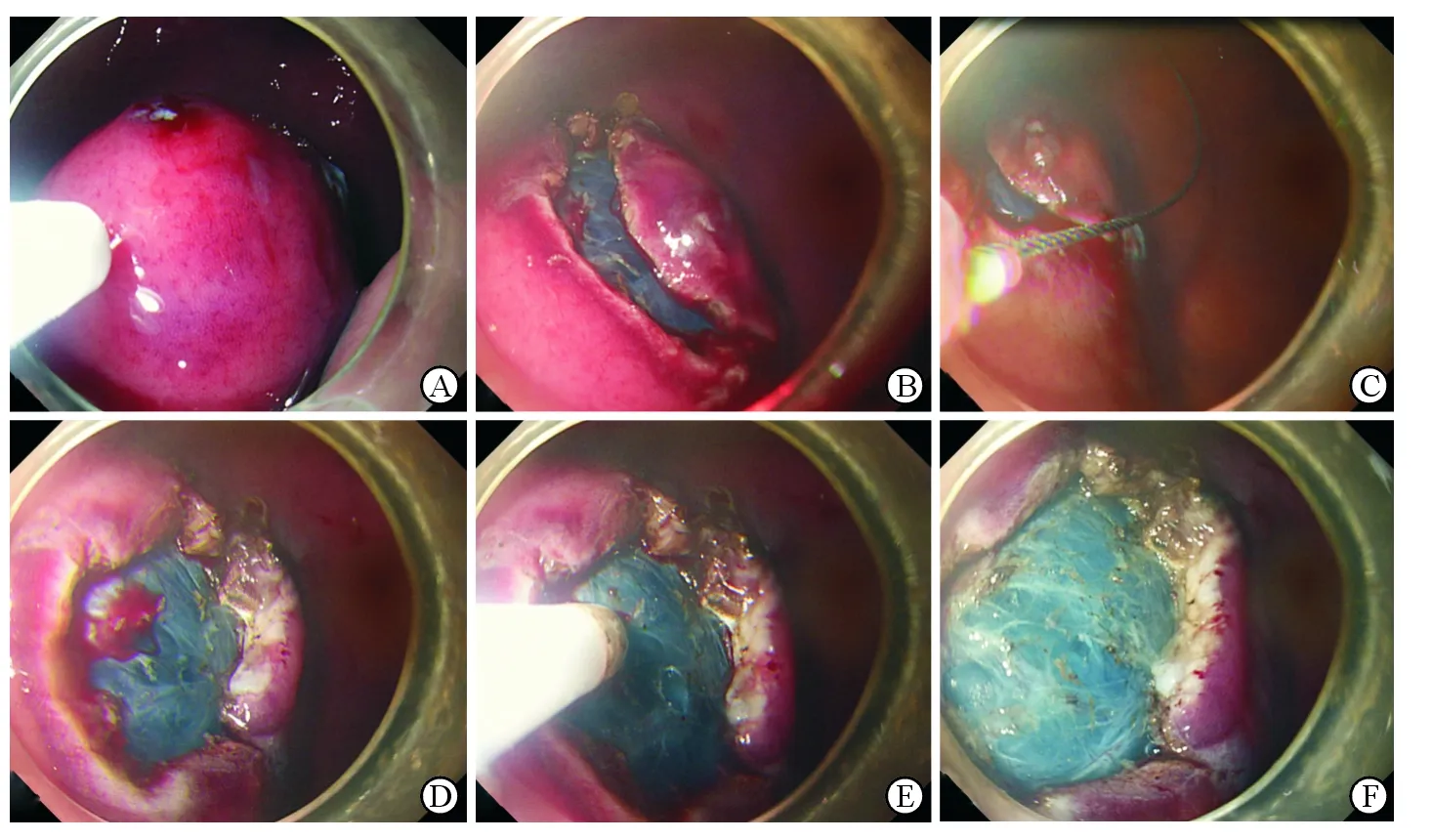
图2 活体猪胃内新型圈套器切除模拟病变黏膜手术过程
A: 对待切除黏膜标记后进行黏膜下注射;B:对待切除黏膜周边进行预切开;C:使用圈套器将黏膜切除;D:观察切除后的创面,可见少量出血;E:对出血点采用氩气喷凝;F:最终术后创面
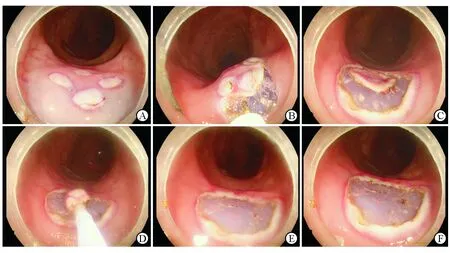
图3 活体猪结肠内新型圈套器切除模拟病变黏膜手术过程
A: 对待切除黏膜周边标记并进行黏膜下注射;B:对待切除黏膜周边进行预切开;C:预切开完成;D:使用圈套器电切除黏膜;E:观察术后创面可见少量渗血;F:对出血点采用氩气喷凝
1.5 观察指标 观察并记录创面完整切除率、有无穿孔、有无固有肌层损伤等。切除病变及创面取样后予4%甲醛固定并送病理评估。
2 结 果
2.1 自制新型圈套器在离体猪胃、肠内镜电切术中的应用
2.1.1 离体猪胃组织 3组参数下(20 W、30 W、40 W)共对9处胃部模拟病变(直径1 cm)进行切除,切除成功率100%,胃组织创面未发现固有肌层损伤或穿孔。
2.1.2 离体猪肠组织 3组参数下(20 W、30 W、40 W)共对9处肠模拟病变(直径1 cm)进行切除,低功率下(20 W)3个病变均完整切除,中高功率(30 W、40 W)下肠黏膜均发生较厚结痂且影响电切效果,中功率和高功率下各有2处模拟病变在切除过程中未能完全切除标记部位,整块切除率为33.3%。创面未发现固有肌层损伤或穿孔。因此,后续活体实验采用低功率(20 W)电切。
2.2 自制新型圈套器在活体猪胃、肠内镜电切术中的应用
2.2.1 活体猪胃组织 3种参数设置下(20 W、30 W、40 W)对活体猪胃体病变进行切除,9处模拟病变均完整切除,手术时间3~6 min,中位时间4 min,术后即时创面肉眼观察未见活动性出血或穿孔(图4A);术后1周9个创面均未见出血及穿孔(图4B),病理检查未见固有肌层损伤。
2.2.2 活体猪肠组织 参照离体结肠病变切除结果,在低功率及氩气设置(20 W,1.0 L/min)下对
活体猪肠病变进行切除,每处间隔约5 cm,以免病变相互影响。15处模拟病变均完整切除,术后即时创面肉眼观察未见活动性出血或穿孔;7 d后14处创面愈合好(图5),1处病变病理切片见固有肌层损伤(6.7%,1/15)。
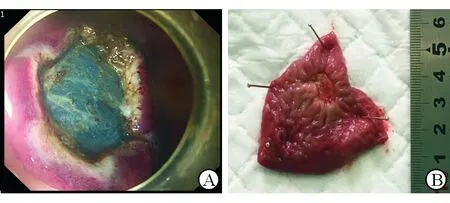
图4 自制新型圈套器在活体猪胃内镜电切术中的应用
A: 术中即时创面;B:术后1周安乐死动物,观察创面愈合好,未见穿孔
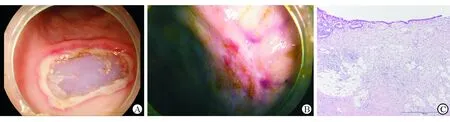
图5 自制新型圈套器电切在活体猪肠内镜电切术中的应用
A: 自制新型圈套器电切活体猪肠模拟病变术后即刻创面;B:术后7 d创面;C:H-E染色见人工溃疡愈合良好,再生黏膜上皮下大量肉芽组织增生. Original magnification:×100(C)
3 讨 论
本研究对集电切、圈套、氩气刀功能于一体的自制新型内镜圈套器进行动物在体和离体安全性评估,利用离体、在体猪胃肠模型,建立直径大小约1 cm的模拟病变,在低、中、高功率3种参数下,对模拟病变进行内镜切除。除离体猪肠中,中、高功率参数下病变未得到有效切除,切除率为33.3%,其余病变均得到有效切除。后续在活体猪肠实验采用了低功率(20 W)的参数设置,所有病变均得到了安全、有效的切除。在活体实验猪胃、猪肠模型中,术后1周胃/肠镜检查创面,内镜电切术后创面愈合良好。创面病理检查结果发现1处活体猪肠模拟病变切除后见固有肌层损伤(6.7%,1/15),但未见肉眼可见的穿孔,其余创面均愈合良好。本研究采用的电切步骤为“标记-黏膜下注射-边缘切开-圈套电切-创面氩气喷凝止血”,简单模拟了内镜黏膜下剥离术(ESD)对病变的切除,而ESD切除肠道病变的医源性穿孔率为2%~12%[9]。因此,本研究结果提示自制新型内镜圈套器能够安全、有效地完成内镜电切手术;建议设置较低的功率进行肠道病变的切除,以免造成穿孔。
目前,内镜电切术(内镜黏膜切除术EMR/内镜黏膜下剥离术ESD)中常用器械除圈套器外,还包括各种高频切开刀,如钩刀、IT刀、海博刀等,各有不同优缺点[10-12]。创面的处理则需要氩气刀、止血钳等。术中可依据手术操作需要及术者使用习惯选择单用或联合使用,但上述器械主流品牌均依靠进口器械,若联合使用,患者将负担高额的手术费用。本研究团队联合常州乐奥团队联合设计的自制新型内镜圈套器集氩气刀、圈套器、针刀等多种功能于一体,可完成标记、预切开、圈套、电切电凝、氩气处理创面的功能,避免手术过程中反复更换器械,简化了手术流程,应用于临床可降低手术费用,减轻患者负担。
综上所述,自制新型多功能圈套器在动物体内、体外实验中安全有效,作为一种内镜下黏膜及黏膜下病变切除手术器械的补充,有望降低患者手术费用、缩短手术时间、降低手术难度,但仍需进一步的临床试验验证其临床应用的安全性和有效性。
[ 1 ] ITOI T, ISHII K, TANAKA R, et al.Current status and perspective of endoscopic ultrasonography-guided gastrojejunostomy: endoscopic ultrasonography-guided double-balloon-occluded gastrojejunostomy (with videos)[J].J Hepatobiliary Pancreat Sci,2015, 22(1):3-11.
[ 2 ] QI Z P,LI B,ZHONG Y S,et al. Endoscopic gastrojejunostomy: a novel NOTES technique[J].Am J Gastroenterol,2017,112(12):1778.
[ 3 ] SCHLACHTERMAN A, YANG D, GODDARD A, et al. Perspectives on endoscopic submucosal dissection training in the United States: a survey analysis[J].Endosc Int Open,2018, 6(4):E399-E409.
[ 4 ] OHATA K, MURAMOTO T, MINATO Y, et al. Usefulness of a multifunctional snare designed for colorectal hybrid endoscopic submucosal dissection (with video)[J].Endosc Int Open,2018,6(2): E249-E253.
[ 5 ] SOEHENDRA N,BINMOELLER K F,BOHNACKER S,et al.Endoscopic snare mucosectomy in the esophagus without any additional equipment: a simple technique for resection of flat early cancer[J]. Endoscopy,1997,29(5):380-383.
[ 7 ] APEL D, JAKOBS R, SPIETHOFF A, et al.Follow-up after endoscopic snare resection of duodenal adenomas[J].Endoscopy,2005,37(5):444-448.
[ 8 ] BINMOELLER K F, BOHNACKER S, SEIFERT H, et al. Endoscopic snare excision of "giant" colorectal polyps[J].Gastrointest Endosc,1996,43(3):183-188.
[ 9 ] PASPATIS G A, DUMONCEAU J M, BARTHET M, et al.Diagnosis and management of iatrogenic endoscopic perforations: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement[J].Endoscopy,2014,46(8):693-711.
[10] KO B M.History and development of accessories for endoscopic submucosal dissection[J]. Clin Endosc,2017,50(3):219-223.
[11] JANG J Y.Future development of endoscopic accessories for endoscopic submucosal dissection[J].Clin Endosc,2017,50(3):242-249.
[12] 徐佳昕, 李全林, 周平红.经自然腔道内镜手术的发展与展望[J].中国临床医学,2018,25(2):161-166.
