低频脉冲超声对小鼠海马区小胶质细胞的影响
2018-05-03,,,,
,, , ,
[陆军军医大学(第三军医大学)第三附属医院野战外科研究所眼科,重庆 400042]
低频脉冲超声是一种使用频率和剂量较低的超声波,其频率范围一般在20 kHz~1 MHz。近来,随着对低强度脉冲研究的深入,其生物学效应已在临床上得到初步应用,比如低频超声的溶栓作用、促进骨折愈合等[1-2]。低频脉冲超声对中枢神经系统的作用也不断被发现[3],其对中枢神经系统的生理学及病理学的影响逐渐受到人们的重视。近期,有实验发现,低频超声能够对因衰老所致的海马神经元退行性变起到保护作用[4]。但低频脉冲超声是否对正常生理状态下海马的神经活动产生直接作用及机制尚需进一步阐明。本研究拟在观察低频脉冲超声对小鼠海马区形态学的改变以及所导致的旷场行为学的变化,进一步探讨这种改变背后的可能机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级C57/BL6小鼠,体质量(21±2)g,6~8周龄,雄性,由陆军军医大学(第三军医大学)大坪医院动物中心提供。
1.1.2 主要试剂 医用超声耦合剂购自天津成信医用辅助材料厂,聚乙二醇辛基苯基醚(Triton X-100)、山羊抗鼠免疫组化试剂盒、山羊抗兔免疫组化试剂盒、DAB显色试剂盒、辣根酶标记山羊抗鼠IgG(H+L)、辣根酶标记山羊抗兔IgG(H+L)购自北京中杉金桥生物技术公司,抗DCX抗体购自英国abcam公司,抗GFAP购自美国Merck Millipore公司,抗Iba1抗体购自美日本wako公司,抗GAPDH抗体购自美国sigma公司。
1.1.3 主要仪器 低频超声治疗仪由重庆医科大学超声影像学研究所设计研发,旷场实验分析系统(OF)购自上海移数科技有限公司,Western blot电泳及湿转设备购自Biorad公司,光学显微镜购自德国徕卡公司。
1.2 实验方法
1.2.1 低频强度脉冲超声处理小鼠大脑的模型建立 选取成年C57小鼠32只,随机分为Sham组(16只)和LIPUS组(16只)。4.3%水合氯醛腹腔注射(0.01 mL/g)麻醉,用刀片剔除小鼠头顶部毛发并在裸露皮肤处均匀涂抹超声耦合剂,将超声探头置于小鼠头顶,注意探头表面需要和皮肤紧密贴合(图1)。Sham组仅放置探头10 min,不给予超声刺激;LIPUS组采用2档低频脉冲超声(平均功率密度为150 mW/cm2)处理10 min后。处理完成后,将小鼠置于温暖环境复苏。按上述方法,每日处置2次,持续7 d后进行下一步实验。整个实验过程,维持小鼠体温在35~37 ℃。

图1 低频脉冲超声处理小鼠大脑
1.2.2 小鼠大脑冰冻切片及免疫组织化学 每组随机取5只小鼠,4.3%水合氯醛腹腔注射麻醉小鼠,开胸经左心室插管,剪开右心耳,0.9%氯化钠注射液快速灌注以冲净血液后,4%多聚甲醛先快后慢灌注固定全身,断头取脑,4%多聚甲醛中4 ℃固定过夜后,将大脑置于30%蔗糖中置换,待标本沉底后,制作冰冻切片。矢状面连续切片以观察海马,切片厚度为25 μm,每只鼠取部位切面相近的两张切片进行免疫组化染色。免疫组化过程按中杉金桥免疫组化试剂盒说明书进行。阴性对照实验:免疫组化过程中以0.02 mol/L PBS代替一抗孵育切片。采用ImageJ软件对40倍目镜视野内的阳性细胞进行计数,同时测算突起末端数目,用突起末端数目/阳性细胞数代表单个细胞平均突起数目。
1.2.3 小鼠海马蛋白提取及蛋白免疫印迹 每组随机取3只小鼠,颈椎脱臼法处死小鼠,立即断头取脑置于冰上,冰上分离海马组织,每只小鼠的海马组织单独置于一离心管中,充分冰上研磨,超声1 min,12 000 r/min 4 ℃离心,取上清置于新的离心管中,按体积加入相应蛋白上样缓冲液,100 ℃水浴加热10 min。每只小鼠蛋白样本单独用一个电泳道,凝胶电泳70 V分离,300 mA湿转膜2 h,5%脱脂奶粉室温封闭1.5 h,加入相应一抗(1∶1 000)4 ℃孵育过夜;滴加相应二抗(1∶5 000),ECL化学发光法曝光。用ImageJ软件进行灰度分析。
1.2.4 旷场行为测定 在实验开始前确认OF装置清洁、无味。每组取8只小鼠,提前运送到行为学实验室内,适应环境3 h。将小鼠从笼内取出,放置在OF装置中央,打开录像系统,记录小鼠在OF内的活动,总时间5 min。每批次实验结束后,以75%乙醇擦拭实验装置,并用纸巾擦干,凉置5 min后再进行下一批次实验。用鼠博士数据分析软件进行运动轨迹分析。

2 结果
2.1 低频脉冲超声刺激后,海马中DCX、GFAP和Iba1蛋白的表达情况
蛋白免疫印迹检测显示,2组DCX、GFAP和Iba1蛋白均呈阳性表达。2组间DCX及GFAP的相对表达量差异无统计学意义(P>0.05),DCX相对表达量分别为(0.94±0.11)、(0.81±0.06),GFAP相对表达量分别为(0.99±0.54)、(1.03±0.01)。但LIPUS组Iba1的相对表达量(0.94±0.05)明显高于Sham组(0.60±0.07),差异有统计学意义(P<0.05),见图2。
2.2 小鼠海马区免疫组织化学改变
2.2.1 DCX免疫组织化学 采用DCX标记海马齿回的神经前体细胞,结果显示镜下可见紧密排列、成簇出现的DCX阳性细胞。这些细胞大多位于颗粒细胞层与门区之间。阳性细胞计数Sham组(33.33±2.40)个/视野与LIPUS组(32.00±2.08)个/视野,差异无统计学意义(P>0.05),见图3a、b。
2.2.2 GFAP免疫组织化学 GFAP用以标记星形胶质细胞阳性结果表现为细胞浆内出现深棕色颗粒。
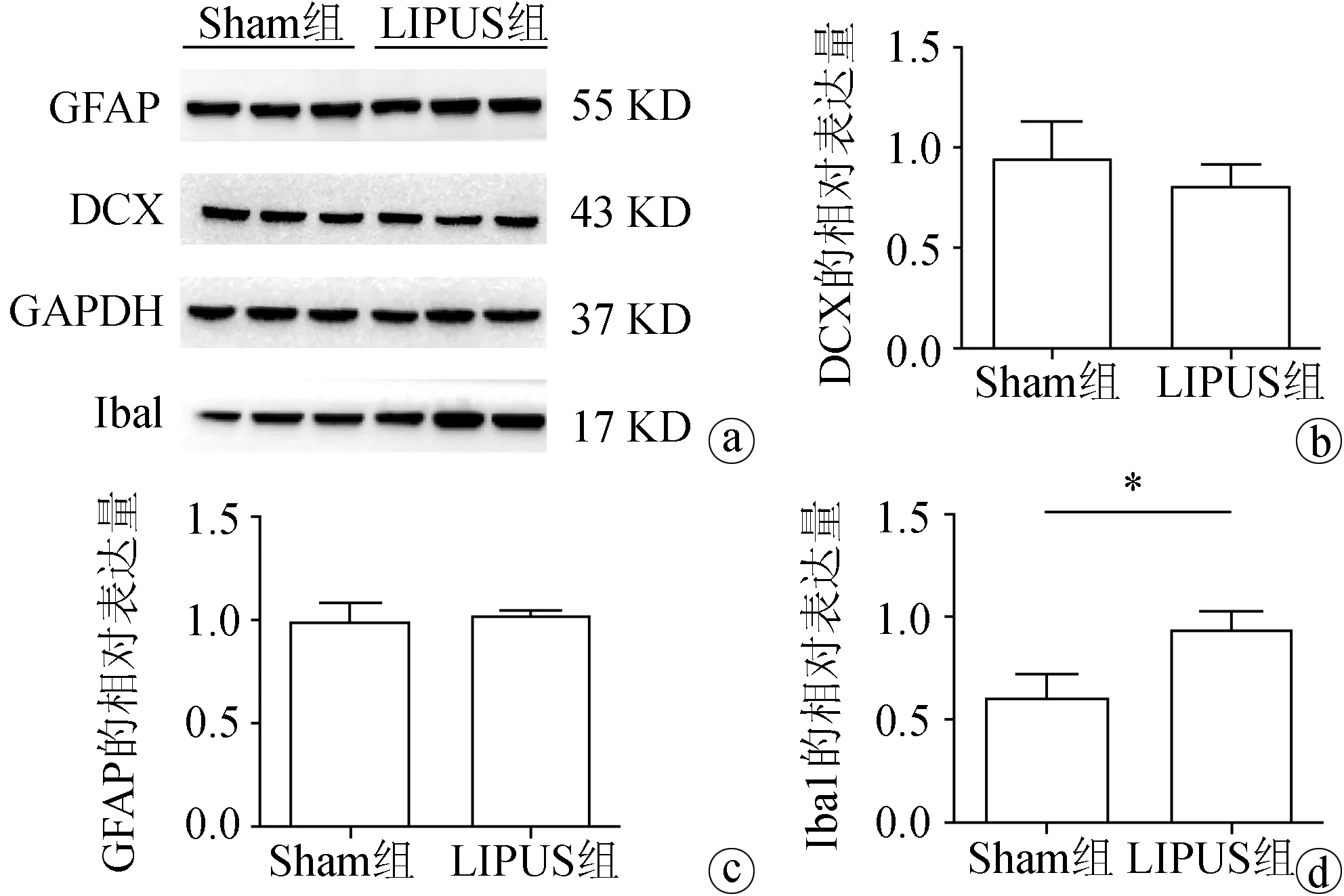
a:蛋白免疫印迹条带;b:DCX的相对表达量;c:GAPD的相对表达量;d:Iba1的相对表达量 *:P<0.05)
图2小鼠海马中目的蛋白表达量
Sham组和LIPUS组中GFAP阳性细胞轮廓清楚,细胞突起呈星形。同时,在200倍视野下,数量上Sham组(67.33±6.00)个/视野和LIPUS组(68.67±2.73)个/视野,差异无统计学意义(P>0.05),见图3c、d。
2.2.3 Iba1免疫组织化学 小胶质细胞标记物Iba1在Sham组中数量为(31.33±2.03)个/视野,胞体较薄,周围有大量树枝状突起,为未活化的小胶质细胞。部分小胶质细胞突起较短,胞体增大。在LIPUS组中,小胶质细胞数量为(53.33±7.21)个/视野,与Sham组比较明显增多,差异有统计学意义(P<0.05),胞体较大,两者在单个细胞突起数目差异无统计学意义(P>0.05),分别为(3.77±0.98)个/细胞,(3.52±0.11)个/细胞(图3e、f,图4)。但LIPUS组平均胞体面积为(139.68±38.12)μm2,明显大于Sham组的(112.79±29.82)μm2,差异有统计学意义(P<0.05),见图4e。

a、c、e:Sham组小鼠海马区免疫组化染色,按顺序依次为DCX、GFAP、Iba1;b、d、f:LIPUS组小鼠海马区免疫组化染色,按顺序依次为DCX、GFAP、Iba1
图3小鼠海马区目的蛋白表达(a、b×400,c、d、e、f×200)

a、b:分别为Sham组、LIPUS组海马区小胶质细胞免疫组化染色(×600);c:Iba1阳性细胞计数;d:单个Iba1阳性细胞平均突起数目;e:单个Iba1阳性细胞平均胞体面积 *:P<0.05
图4小鼠Iba1阳性细胞计数及阳性细胞平均突起数目
2.3 小鼠旷场行为的变化
LIPUS组在OF中5 min活动总路程为(1 602.79±134.77)cm,Sham组总路程为(1 486.15±247.03)cm,两者差异无统计学意义(P>0.05),两者在OF中的平均速度分别为(5.34±0.45)cm/s、(4.95±0.82)cm/s(P>0.05)。而LIPUS组中央区域活动时间(38.01±10.54)s,显著长于Sham组(20.57±5.35)s,差异有统计学意义(P<0.05);2组小鼠的中央区域活动路程分别为LIPUS组(231.90±55.20)cm,Sham组(149.16±13.52)cm,2组比较差异有统计学意义(P<0.05),见图5。

a:Sham组活动路径;b:LIPUS组活动路径;c:活动总路程;d:平均速度;e:中央区域活动时间;f:中央区域活动路程 *:P<0.05
3 讨论
超声波用于临床诊断已有40多年的历史,其安全性和准确性已得到临床验证。随着对超声研究的不断深入,研究者发现低频超声因具有在组织中易穿透、声能吸收少、对组织损伤小的优点,其在疾病治疗方面的优势也日益凸显。以往对低频超声生物学作用的研究主要集中在软组织[5]、骨组织[6]、外周神经[7]和肿瘤细胞[8]上。但实际上,通过动物实验发现,低频超声对中枢神经系统的神经活动也有明确的调控作用[9],比如低频聚焦超声波(LIFU)不仅可以激发或抑制大脑皮层的特定活动,也可以引起血氧水平依赖信号的明显变化[10]。近期,研究人员发现将LIFU直接作用于脑部特定区域能增强人们对触觉的分辨能力。这项发现第一次证明了LIFU能调节人类脑活动[11]。随后,Lin等[12]发现不仅仅是聚焦超声,低频脉冲超声也可通过上调海马区脑源性神经营养因子(BDNF)、胶质细胞源性神经营养因子(GDNF)、血管内皮生长因子(VEGF)的水平从而在大鼠阿尔兹海默模型导致的脑损伤中起到保护作用。在我们的研究中发现,不仅仅是在病理条件下,低频脉冲超声也可以对正常成年小鼠大脑产生刺激作用。在低频脉冲超声处理小鼠大脑7 d后,虽然未见星形胶质细胞和神经前体细胞的明显变化,但免疫组织化学结果显示LIPUS组海马区的小胶质细胞相较于Sham组明显增多,同时,蛋白免疫印迹结果也支持了上述发现。
小胶质细胞的数量占中枢神经胶质细胞总数的5%~10%,广泛分布于各个脑区,是脑内固有的免疫效应细胞,被认为是中枢神经系统内的主要免疫效应器,起免疫监视作用。但现今研究认为,小胶质细胞的作用不仅限于免疫监视作用。动物实验表明,极化后M1型小胶质细胞占主导的实验动物表现出更明显的焦虑情绪[13]。同时,大量研究也证实未激活的小胶质细胞在正常大脑中积极地监视神经元,有选择的进行突触修剪,保持脑内微环境的稳态,维持正常情绪状态[14-16]。而在我们的实验中,LIPUS组在低频脉冲超声的刺激下,通过对小胶质细胞平均突起数目的分析,2组间并无统计学差异。并且免疫组化Iba1阳性的小胶质细胞在形态上也无明显差异,大多数均处于未激活的状态。说明低频脉冲超声虽然刺激了海马区小胶质细胞的增殖,但是并未引起小胶质细胞的明显激活。Parkhurst等[17]报道,小胶质细胞可通过分泌BDNF等神经营养因子促进学习相关突触的形成,进而在突触可塑性的形成和学习能力的产生中起到重要作用。结合本研究实验结果,我们推测低频脉冲超声刺激海马区小胶质细胞增多,从而引发了小鼠旷场行为的改变。Tang等[18]发现,小胶质细胞数目的增加会导致小胶质源性的BDNF增加,这也在一定程度上支持了我们的推测。但他们认为是一种称做神经营养型(neurotrophic)小胶质细胞的增加会促进小胶质源性的BDNF增加,这种类型的小胶质细胞形态上表现为较大的胞体和较短的突起。而在Sham组和LIPUS组中我们都观察到了这种形态的小胶质细胞,通过对小胶质细胞胞体面积的测量发现LIPUS组中小胶质细胞胞体面积显著大于Sham组,我们认为低频脉冲超声刺激导致了小鼠海马区神经营养型小胶质细胞数目的增加。
本研究中,旷场实验测试结果显示表现小鼠自发活动的总路程和平均速度两项指标在2组中未见明显变化,提示小鼠自发活动无明显差异。然而因小鼠畏惧开阔、未知、可能存在潜在危险的场所,故其具有“贴墙”活动的天性[19]。在LIPUS组中,小鼠中央区活动时间及中央区活动路程的得分均明显高于Sham组,提示低频脉冲超声超声处理使得小鼠的趋避性和焦虑水平较Sham组小鼠明显降低,也可以说,LIPUS组的小鼠更具“冒险”倾向。海马是学习记忆的关键部位,参与包含条件性惊恐反应在内的情景学习。现阶段研究认为海马功能与焦虑状态的发生关系密切[20-22]。创伤后应激障碍(PTSD)作为焦虑状态的代表性疾病之一,其患者海马较正常人明显缩小,并伴随着明显的海马功能障碍,比如研究发现在PTSD患者中,海马皮质的代谢就受到了明显抑制[23]。Snyder等[24]发现,成年海马神经发生受限的小鼠焦虑和抑郁样行为明显增加。而Mohammad等[25]则证实促进成年海马神经发生可以有效降低小鼠的焦虑症状,提高小鼠在行为学测试中的表现。与此同时,近期研究发现,运动训练之所以能够缓和焦虑状态也是因为刺激了海马区BDNF的表达上调[26]。因此,我们推测小鼠的旷场行为改变可能是由于海马区增殖的神经营养型小胶质细胞分泌BDNF所致。
综上,我们认为低频脉冲超声可以通过上调海马区小胶质的数目,从而导致小鼠焦虑水平的下降。但低频超声的作用机制复杂,究竟是小胶质细胞分泌BDNF增加还是多种因素共同对小鼠的焦虑状态产生了影响,尚需要进一步深入研究。
[参考文献]
[1] Pacella JJ,Brands J,Schnatz FG,et al.Treatment of microvascular micro-embolization using microbubbles and long tone burst ultrasound:an in vivo study[J].Ultrasound Med Biol,2015,41(2):456-464.doi:10.1016/j.ultrasmedbio.2014.09.033.
[2] Hannemann PF,Mommers EH,Schots JP,et al.The effects of low-intensity pulsed ultrasound and pulsed electromagnetic fields bone growth stimulation in acute fractures:a systematic review and meta-analysis of randomized controlled trials[J].Arch Orthop Trauma Surg,2014,134(8):1093-1106.doi:10.1007/s00402-014-2014-8.
[3] Leinenga G,Götz J.Scanning ultrasound removes amyloid-β and restores memory in an Alzheimer’s disease mouse model[J].Sci Transl Med,2015,7(278):278-333.doi:10.1126/scitranslmed.aaa2512.
[4] Hatch RJ,Leinenga G,Götz J.Scanning ultrasound(SUS) causes no changes to neuronal excitability and prevents age-related reductions in hippocampal CA1 dendritic structure in wild-type mice[J].PloS One,2016,11(10):0164278.doi:10.1371/journal.pone.0164278.eCollection 2016.
[5] Kösters AK,Ganse B,Gueorguiev B,et al.Effects of low-intensity pulsed ultrasound on soft tissue micro-circulation in the foot[J].Int Orthop,2017,41(10):2067-2074.doi:10.1007/s00264-017-3574-3.
[6] Wu S,Xu X,Sun J,et al.Low-intensity pulsed ultrasound accelerates traumatic vertebral fracture healing by coupling proliferation of type H microvessels[J].J Ultrasound Med,2018.doi:10.1002/jum.14525.
[7] Ni XJ,Wang XD,Zhao YH,et al.The effect of low-intensity ultrasound on brain-derived neurotropic factor expression in a rat sciatic nerve crushed injury model[J].Ultrasound Med Biol,2017,43(2):461-468.doi:10.1016/j.ultrasmedbio.2016.09.017.
[8] Jang KW,Seol D,Ding L,et al.Ultrasound-mediated microbubble destruction suppresses melanoma tumor growth[J].Ultrasound Med Biol,2018.doi:10.1016/j.ultrasmedbio.2017.12.011.
[9] Kim H,Taghados SJ,Fischer K,et al.Noninvasive transcranial stimulation of rat abducens nerve by focused ultrasound[J].Ultrasound Med Biol,2012,38(9):1568-1575.doi:10.1016/j.ultrasmedbio.2012.04.023.
[10] Yoo SS,Bystritsky A,Lee JH,et al.Focused ultrasound modulates region-specific brain activity[J].Neuroimage,2011,56(3):1267-1275.doi:10.1016/j.neuroimage.2011.02.058.
[11] Legon W,Sato TF,Opitz A,et al.Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans[J].Nat Neurosci,2014,17(2):322-329.doi:10.1038/nn.3620.
[12] Lin WT,Chen RC,Lu WW,et al.Protective effects of low-intensity pulsed ultrasound on aluminum-induced cerebral damage in Alzheimer’s disease rat model[J].Sci Rep,2015,5:9671.doi:10.1038/srep09671.
[13] Li Z,Ma L,Kulesskaya N.Võikar,et al.Microglia are polarized to M1 type in high-anxiety inbred mice in response to lipopolysaccharide challenge[J].Brain Behav Immun,2014,38:237-248.doi:10.1016/j.bbi.2014.02.008.
[14] Salter MW,Beggs S.Sublime microglia:expanding roles for the guardians of the CNS[J].Cell,2014,158(1):15-24.doi:10.1016/j.cell.2014.06.008.
[15] Schafer DP,Lehrman EK,Kautzman AG,et al.Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner[J].Neuron,2012,74(4):691-705.doi:10.1016/j.neuron.2012.03.026.
[16] Zhan Y,Paolicelli RC,Sforazzini F,et al.Deficient neuron-microglia signaling results in impaired functional brain connectivity and social behavior[J].Nat Neurosci,2014,17(3):400-406.doi:10.1038/nn.3641.
[17] Parkhurst CN,Yang G,Ninan I,et al.Microglia promote learning-dependent synapse formation through brain-derived neurotrophicfactor[J].Cell,2013,155(7):1596-1609.doi:10.1016/j.cell.2013.11.030.
[18] Tang J,Miao H,Jiang B,et al.A selective CB2R agonist(JWH133) restores neuronal circuit after germinal matrix hemorrhage in the preterm via CX3CR1+ microglia[J].Neuropharmacology,2017,119:157-169.doi:10.1016/j.neuropharm.2017.01.027.
[19] Christakis DA,Ramirez JS,Ramirez JM.Overstimulation of newborn mice leads to behavioral differences and deficits in cognitive performance[J].Sci Rep,2012,2:546.doi:10.1038/srep00546.
[20] Hill AS,Sahay A,Hen R.Increasing adult hippocampal neurogenesis is sufficient to reduce anxiety and depression-like behaviors[J].Neuropsychopharmacology,2015,40(10):2368-2378.doi:10.1038/npp.2015.85.
[21] Quaedflieg CWEM,Schwabe L.Memory dynamics under stress[J].Memory,2018,26(3):364-376.doi:10.1080/09658211.2017.1338299.
[22] Zhang Y,Zheng Y,Xu Y,et al.Corticotropin-releasing hormone suppresses synapse formation in the hippocampus of male rats via inhibition of CXCL5 secretion by glia[J].Endocrinology,2018,159(2):622-638.doi:10.1210/en.2017-00336.
[23] Alzoubi KH,Rababa h AM,Al Yacoub ON.Tempol prevents post-traumatic stress disorder induced memory impairment[J].Physiol Behav,2018,184:189-195.doi:10.1016/j.physbeh.2017.12.002.
[24] Snyder JS,Soumier A,Brewer M,et al.Adult hippocampal neurogenesis buffers stress responses and depressive behaviour[J].Nature,2011,476(7361):458-461.doi:10.1038/nature10287.
[25] Mohammad H,Marchisella F,Ortega-Martinez S,et al.JNK1 controls adult hippocampal neurogenesis and imposes cell-autonomous control of anxiety behaviour from the neurogenic niche[J].Mol Psychiatry,2018,23(2):487.doi:10.1038/mp.2017.21.
[26] Lapmanee S,Charoenphandhu J,Teerapornpuntakit J,et al.Agomelatine.venlafaxine.and running exercise effectively prevent anxiety- and depression-like behaviors and memory impairment in restraint stressed rats[J].PloS One,2017,12(11):0187671.doi:10.1371/journal.pone.0187671.eCollection 2017.