TMEM158在乳腺癌的表达及其对乳腺癌细胞迁移侵袭能力的影响
2018-04-28姚娜黄华兴夏添松王水
姚娜, 黄华兴, 夏添松, 王水
乳腺癌是女性最常见的肿瘤之一,在欧美国家居女性恶性肿瘤的首位,在我国也呈逐年上升的趋势[1-2]。乳腺癌细胞的迁移和侵袭是促使乳腺癌发生转移,最终导致患者死亡的主要原因[3]。跨膜蛋白158(TMEM158),因其表达量在Ras蛋白诱导感染RasV12慢病毒二倍体成纤维细胞衰老时升高被识别,被称为RIS-1蛋白 (ras-induced senescence 1)[4]。TMEM158的表达及生物学功能在多种肿瘤研究中已有报道[5-8];但是缺乏TMEM158在乳腺癌中的相关研究报道,因此本研究旨在探讨其在乳腺癌的表达差异及生物学功能。
1 材料与方法
1.1 一般资料
从TCGA数据库(http://tcga-data.nci.Nih.gov/tcga/)下载乳腺癌数据集,包含1 094例乳腺癌组织及120例癌旁乳腺组织样本;收集2017年3月至2017年4月南京医科大学第一附属医院乳腺外科收治的4对乳腺癌患者乳腺癌组织和癌旁非癌乳腺组织(距离乳腺癌原发灶>2 cm)。
1.2 试剂及乳腺癌细胞系
(MCF-7, SUM1315、MDA-MB-231、ZR-75-1、T47D)购自中国科学院上海细胞库;正常乳腺导管细胞MCF-10A购自美国典型菌种保藏中心(ATCC)。杜尔伯科改良伊格尔培养基(DMEM)、胎牛血清(FBS)、0.25%胰蛋白酶试剂购自美国Gibco公司;TRIzol总RNA提取及Lipofectamine 3000转染试剂盒购自香港Invitrogen公司;PrimeScript反转录及SYBR Premix PCR试剂盒购自日本TakaRa公司;GAPDH抗体及兔、鼠二抗、总蛋白提取试剂盒购自南京碧云天生物公司;Si-TMEM158及Si-NC由上海吉码制药有限公司设计、合成、鉴定;TMEM158、E-Cadherin、Vimentin、Snail、N-Cadherin及内参引物均由南京锐真生物公司设计合成;TMEM158抗体购自美国Abcam公司; E-Cadherin、Vimentin、Snail、N-Cadherin抗体购自美国CST公司;Transwell小室购自美国Coring公司;凝胶成像电泳系统购自美国Bio-rad公司。
1.3 方法
1.3.1 细胞培养和Si-RNA转染 人乳腺癌细胞系(MCF-7, SUM1315, MDA-MB-231, ZR-75-1,T47D)和正常乳腺导管细胞(MCF-10A)均培养于含10%胎牛血清,1%青霉素-链霉素的DMEM高糖培养基中,置于37 ℃、5%CO2饱和湿度条件下培养,于对数生长期开始实验。按照说明书,通过Lipofectamine 3000转染Si-TMEM158和Si-NC于乳腺癌细胞SUM1315中。转染前12 h,SUM1315细胞以3×105/孔接种于6孔板中。待细胞贴壁后开始转染,每孔先将50 pmol Si-TMEM158与4 μl Lipofectamine 3000分别加至125 μl DMEM中,5 min后将两者轻轻混合,室温孵育5 min后加入到各个孔中,Si-NC作为阴性对照。在培养箱中培养48 h即可进行下一步实验。qRT-PCR和Western 印迹实验检测SUM1315细胞转染后SUM1315-SiTMEM158及SUM1315-SiNC中TMEM158的表达,验证其干扰效果。SiTMEM158及Si-NC序列如下:SiTMEM158正向引物:5’-GCUGAACCGUAAGCCCAUUTT-3’,反向引物:5’-AAUGGGCUUACGGUUCAGCTT-3’;Si-NC正向引物:5’-UUCUCCGAACGUGUCACGUTT-3’,反向引物:5’-ACGUGACACGUUCGGAGAATT-3’。
1.3.2 实时荧光定量(RT-PCR) Trizol试剂提取细胞总RNA,对A260/A280在1.8~2.0之间的RNA样本进行反转录,PrimeScript反转录试剂将总RNA反转录为cDNA,反应条件为37 ℃ 15 min、85 ℃ 5 s,反应产物保存于4 ℃冰箱中备用。RT-PCR扩增反应在ABI 7500 PCR仪上进行,反应条件:50 ℃ 5 min 、95 ℃ 10 min 、45个循环(95 ℃ 15 s、60 ℃ 2 min)。用2-△△Ct法计算目的基因mRNA表达差异。甘油醛-3-磷酸脱氢(GAPDH)设为内参照,实验重复3次。引物设计序列见表1。

表1 引物序列
1.3.3 Western印迹总蛋白提取试剂盒 提取各组细胞总蛋白,-20 ℃保存备用。SDS-PAGE(10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)分离目的条带,再转移至PVDF(聚偏氟乙烯)膜,5%脱脂奶粉室温封闭2 h,加入相应的一抗后4 ℃孵育过夜。次日TBST洗膜3次,加入二抗后室温孵育2 h。TBST再次洗膜,凝胶图像处理系统进行ECL显影,GAPDH设为内参照,利用Image J图像软件分析各组条带目的蛋白表达量。
1.3.4 Transwell迁移侵袭实验 取转染后SUM1315-SiTMEM158及SUM1315-SiNC细胞,胰酶消化后1 000 r/min离心3 min,无血清DMEM重悬细胞沉淀至密度1×105/ml,取200 μl细胞悬液加入至Transwell小室上室,下室加入700 μl含10% FBS完全培养液,于5%CO2、37 ℃恒温培养箱中培养24 h。取出小室,用棉签轻轻将小室上室表面细胞擦去,晾干,用结晶紫溶液染色30 min,PBS洗涤2次,用显微镜进行观察拍照,随机选取5个视野(×100)进行计数,取均值作为迁移细胞数,每个样本均设置3个复孔。侵袭实验:取50 μl Matrigel基质胶,稀释后铺于Transwell小室上室,4 ℃下风干,其他实验步骤同迁移实验。
1.3.5 划痕实验 取转染后SUM1315-SiTMEM158及SUM1315-SiNC细胞,以1×105/孔接种细胞于6孔板中。待细胞汇合度达到80%~90%后,用200 μl的灭菌枪头轻轻划开一条缝隙,PBS洗涤2次除去划下的细胞,加入无血清DMEM培养基,置于5% CO2、37 ℃恒温培养箱中培养48 h,观察缝隙处细胞融合状态,并拍照记录。
1.4 统计学方法

2 结果
2.1 乳腺癌组织及细胞中TMEM158表达分析
TCGA数据库中下载的1 094例乳腺癌组织和120例癌旁组织的mRNA表达谱数据,结果显示TMEM158在乳腺癌组织中表达水平(6.65±1.76)高于癌旁组织(5.81±1.22),差异有统计学意义(P<0.001)(图1a)。进一步分析120对乳腺癌及其癌旁组织,结果表明TMEM158在乳腺癌组织中表达(6.50±1.76)高于癌旁组织(5.81±1.22),差异有统计学意义(P<0.001)(图1b)。
Western 印迹检测4对人乳腺癌及对应的癌旁组织标本中TMEM158蛋白的表达差异,结果显示,与癌旁乳腺组织比较,乳腺癌组织中TMEM158的表达升高,差异有统计学意义(P<0.05)(图1c)。qRT-PCR分析乳腺癌细胞水平的TMEM158的表达差异,结果显示,相对于正常乳腺导管细胞(MCF-10A),乳腺癌细胞中TMEM158的表达水平升高,差异有统计学意义(P<0.05)(图1d)。

图1 TMEM158在乳腺癌组织及细胞中高表达1a:TCGA数据库中1 094例乳腺癌及120例癌旁非癌组织中TMEM158表达差异,TMEM158在乳腺癌组织中的表达水平高于癌旁组织;1b:TCGA数据库中120对乳腺癌组织及配对癌旁非癌组织中TMEM158表达差异,TMEM158在乳腺癌组织中表达高于癌旁组织;1c:Western 印迹检测4对乳腺癌及配对癌旁非癌组织中TMEM158蛋白水平的表达差异,乳腺癌组织中TMEM158的表达高于癌旁组织;1d: qRT-PCR检测乳腺癌细胞系与正常乳腺导管细胞中TMEM158的表达差异,乳腺癌细胞中TMEM158的表达水平高于乳腺导管细胞。
2.2 沉默TMEM158对乳腺癌细胞迁移侵袭能力的影响
qRT-PCR和Western 印迹结果显示,通过SiRNA技术成功瞬时干扰SUM1315细胞中TMEM158表达,TMEM158较SUM1315-SiNC组下降,差异有统计学意义(P<0.05)(图2a, 2b)。Transwell实验结果显示,相比于SUM1315-SiNC的迁移和侵袭细胞数(346±59; 202±68),沉默TMEM158(SUM1315-SiTMEM158)后细胞的迁移侵袭能力降低(196±33,P<0.05; 202±68,P<0.05)(图2c)。同样,划痕实验结果表明,沉默TMEM158(SUM1315-SiTMEM158)组的细胞划痕愈合速度(25.54±7.64)慢于SUM1315-SiNC组(54.68±10.85),差异有统计学意义(P<0.05)(图2d)。
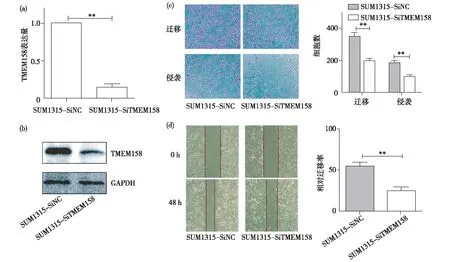
图2 沉默TMEM158明显抑制乳腺癌细胞的迁移侵袭2a:qRT-PCR检测,TMEM158经干扰后,表达下降,干扰成功;2b:Western 印迹检测,TMEM158经干扰后,表达下降,干扰成功;2c:Transwell实验检测,干扰TMEM158后,SUM1315的迁移侵袭能力下降;2d:细胞划痕实验检测,干扰TMEM158后,SUM1315的细胞划痕愈合速度慢于阴性对照组
2.3 沉默TMEM158对乳腺癌细胞EMT相关标志物的影响
qRT-PCR检测TMEM158沉默对EMT相关标志物mRNA表达水平的影响,结果显示,沉默TMEM158后E-Cadherin mRNA的表达量上升,而Vimentin、Snail、N-Cadherin mRNA表达量降低,差异有统计学意义(图3a)。进一步用Western 印迹检测EMT相关标志物蛋白水平变化,结果显示,与SUM1315-SiNC组相比,沉默TMEM158后SUM1315细胞E-Cadherin蛋白水平升高,而Vimentin、Snail、N-Cadherin蛋白表达水平降低,差异有统计学意义(P<0.05)(图3b)。
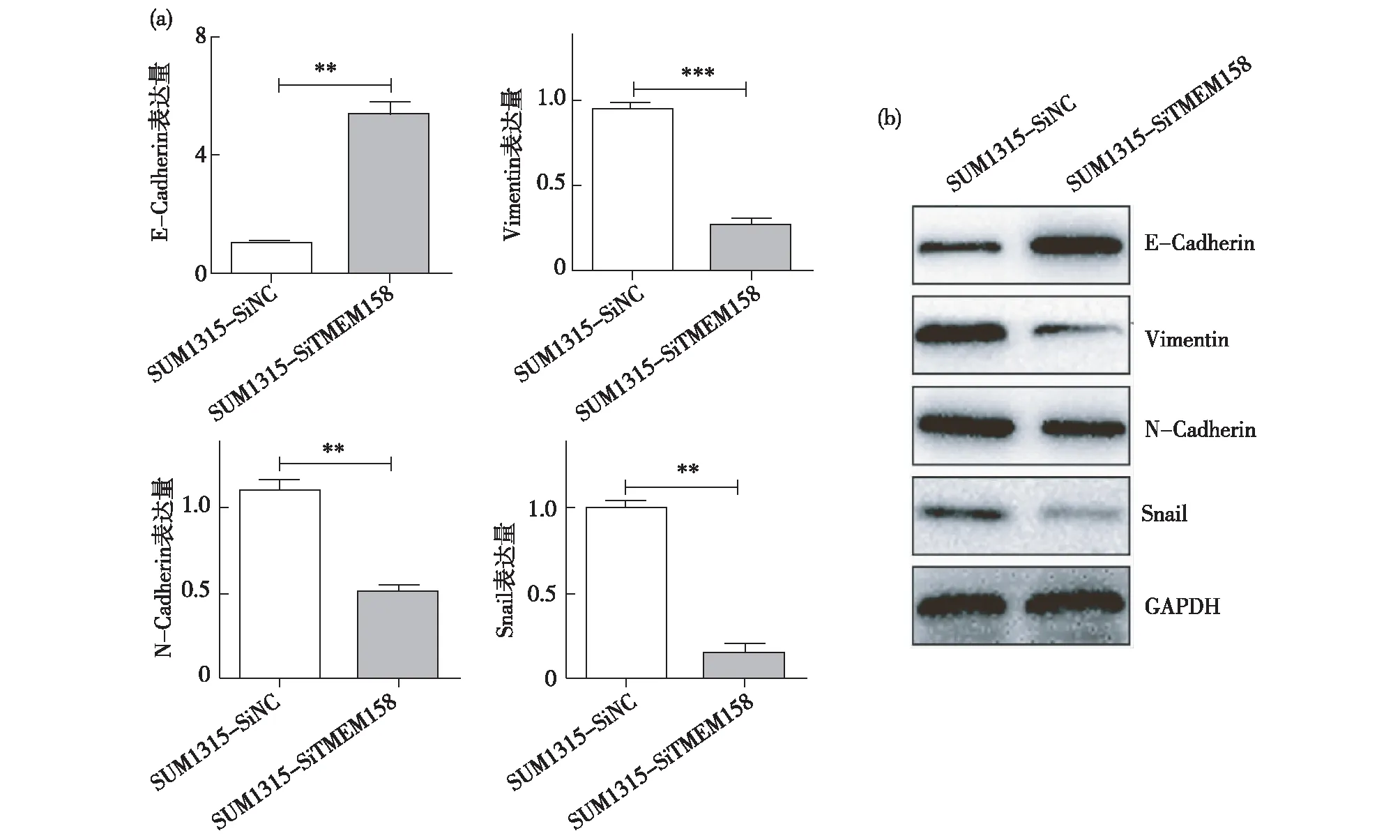
图3 TMEM158通过调控EMT改变促侵袭转移3a:qRT-PCR检测沉默TMEM158后,E-Cadherin mRNA表达量上升,而Vimentin、Snail、N-Cadherin mRNA表达量降低;3b:Western 印迹检测沉默TMEM158后,SUM1315细胞E-Cadherin蛋白水平明显升高,而Vimentin、Snail、N-Cadherin蛋白表达水平降低
3 讨论
乳腺癌是女性常见恶性肿瘤之一,其发病人数和死亡人数均位于女性恶性肿瘤前列[2]。每年我国乳腺癌新发病例占全球新发病例12.2%,死亡数则占到了9.6%,严重威胁女性心身健康[1]。因此,发现新的乳腺癌发生发展相关分子标志物,对提高乳腺癌的诊疗和改善患者预后有着重要的意义。
TMEM158表达及生物学机制在多种肿瘤中被报道,如Iglesias 等[7]研究结果提示在结肠癌的发展中,TMEM158可能起着癌基因的作用。Mohammed 等[8]研究结果证明,干扰TMEM158明显降低顺铂对非小细胞肺癌细胞的毒性作用,提示TMEM158与化疗药物的敏感性有关。Zirn 等[9]研究结果表明,TMEM158在CTNNB1突变的肾母细胞瘤中高表达,可能与Ras及Wnt信号通路有关联。Cheng等[6]研究结果表明,TMEM158在卵巢癌组织中明显高表达,干扰TMEM158明显抑制卵巢癌细胞的增殖及侵袭转移,后续实验提示TMEM158可能通过调控周期及TGF-β通路介导恶性生物学行为,提示TMEM158可能成为卵巢癌的治疗靶点。目前TMEM158在乳腺癌的研究不详,深入探讨其在乳腺癌中的表达差异及其生物学功能是非常有意义的。
本研究中,我们分析了TCGA数据库中1 094例癌组织及120例癌旁组织中TMEM158mRNA表达水平,结果显示TMEM158在乳腺癌组织中的表达量明显高于癌旁组织。通过Western 印迹验证4对乳腺癌及其对应的癌旁组织中TMEM158的表达差异,结果表明癌组织中TMEM158基因的蛋白表达明显升高。进一步用qRT-PCR检测乳腺癌细胞系及正常乳腺导管细胞的表达,结果显示,相比于乳腺正常导管细胞(MCF-10A),乳腺癌细胞中TMEM158表达水平升高,差异有统计学意义。为了进一步发现TMEM158在乳腺癌中的生物学作用,我们通过SiRNA技术瞬时沉默乳腺癌细胞SUM1315中TMEM158表达来研究TMEM158对乳腺癌细胞迁移侵袭能力的影响。Transwell实验显示,沉默TMEM158明显抑制乳腺癌细胞的迁移和侵袭能力,差异有统计学意义。同样,划痕实验也显示,与对照组细胞相比,沉默TMEM158后,细胞划痕愈合能力明显减弱,提示其迁移能力降低。因此,以上结果表明,TMEM158在乳腺癌组织和细胞中高表达,沉默TMEM158可抑制细胞的迁移侵袭,提示其在乳腺癌发生发展中可能起着癌基因的作用。
上皮间质转化是指在特定的生理或病理条件下,上皮细胞失去上皮表型,获得间质细胞表型,转变为间质细胞的过程[10]。上皮间质转化的发生伴随着细胞特性的变化。宏观表现为细胞极性消失,形态有排列紧密的方形或圆形上皮细胞变为排列松散的梭形细胞,伴随着游走迁移能力的增强。微观表现为上皮和间质细胞分子标志物的改变,如上皮细胞分子标志物表达减少,如E-钙黏蛋白(E-Cadherin);间质细胞标志物的表达增加,如波形蛋白(Vimentin)、N-钙黏蛋白(N-Cadherin)及转录因子Snail和Slug等[10]。近年来研究结果发现,上皮间质转化与肿瘤的发生发展密切相关,且在多种恶性肿瘤迁移侵袭和转移过程中发挥重要作用[11-13]。此外,上皮间质转化在乳腺癌中的侵袭和转移过程中也被证明起着重要作用[14-15]。本研究结果显示,沉默乳腺癌细胞SUM1315中TMEM158表达后,E-Cadherin的mRNA及蛋白表达水平升高,Vimentin、N-Cadherin及Snail的mRNA及蛋白水平均明显降低,提示乳腺癌细胞中TMEM158可通过调控EMT介导细胞的迁移和侵袭能力。
综上所述,TMEM158在乳腺癌中高表达,并通过促进乳腺癌细胞的迁移侵袭参与乳腺癌的发生发展。
参考文献:
[1] Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014,15(7):e279-289.
[2] 胡夕春, 赵燕南, 王碧芸. 2017年St.Gallen乳腺癌会议热点[J]. 中国肿瘤外科杂志, 2017, 9(3): 137-140.
[4] Barradas M, Gonos ES, Zebedee Z, et al. Identification of a candidate tumor-suppressor gene specifically activated during Ras-induced senescence[J]. Exp Cell Res, 2002,273(2):127-137.
[5] Sussan TE, Pletcher MT, Murakami Y, et al. Tumor suppressor in lung cancer 1 (TSLC1) alters tumorigenic growth properties and gene expression[J]. Mol Cancer, 2005,4:28.
[6] Cheng Z, Guo J, Chen L, et al. Overexpression of TMEM158 contributes to ovarian carcinogenesis[J]. J ExpClin Cancer Res, 2015,34:75.
[8] Mohammed AS, Eguchi H, Wada S, et al. TMEM158 and FBLP1 as novel marker genes of cisplatin sensitivity in non-small cell lung cancer cells[J]. Exp Lung Res, 2012,38(9-10):463-474.
[9] Zirn B, Samans B, Wittmann S, et al. Target genes of the WNT/beta-catenin pathway in Wilms tumors[J]. Genes Chromosomes Cancer, 2006,45(6):565-574.
[10] Nieto MA, Huang RY, Jackson RA, et al. EMT: 2016[J]. Cell, 2016,166(1):21-45.
[11] Qian Y, Yao W, Yang T, et al. aPKC-ι/P-Sp1/Snail signaling induces epithelial-mesenchymal transition and immunosuppression in cholangiocarcinoma[J]. Hepatology, 2017, 66(4): 1165-1182.
[12] Liu H, Ma Y, He HW, et al. SPHK1 (sphingosine kinase 1) induces epithelial-mesenchymal transition by promoting the autophagy-linked lysosomal degradation of CDH1/E-cadherin in hepatomacells[J]. Autophagy, 2017,13(5):900-913.
[13] Li H, Rokavec M, Jiang L, et al. Antagonistic Effects of p53 and HIF1A on microRNA-34a Regulation of PPP1R11 and STAT3 and Hypoxia-induced Epithelial to Mesenchymal Transition in Colorectal Cancer Cells[J]. Gastroenterology, 2017,153(2):505-520.
[14] Lee JH, Jung SM, Yang KM, et al. A20 promotes metastasis of aggressive basal-like breast cancers through multi-monoubiquitylation of Snail1[J]. Nat Cell Biol, 2017,19(10):1260-1273.
[15] Karlsson MC, Gonzalez SF, Welin J, et al. Epithelial-mesenchymal transition in cancer metastasis through the lymphatic system[J]. Mol Oncol, 2017,11(7):781-791.
