肿瘤标志物PIVKA-Ⅱ在肝细胞癌诊断中的价值
2018-04-28汪源李向农杨军丁亮杨勇韩亚东庄磊
汪源, 李向农, 杨军, 丁亮, 杨勇, 韩亚东, 庄磊
原发性肝癌是我国常见恶性肿瘤,主要包括肝细胞癌、肝内胆管细胞癌以及混合型等病理类型,其中90%以上为肝细胞癌。多数患者就诊时已达中晚期,治疗困难,预后较差[1]。因此寻找到一种特异性好、灵敏度高的血清标志物进行早期诊断尤为重要。PIVKA-Ⅱ (protein induced by Vitamine K antagonist-Ⅱ)是一种维生素K缺乏诱导蛋白,又称为γ-羧基凝血酶原或异常凝血酶原Ⅱ(des-γ-carboxy prothrombin,DCP)。国外学者认为,PIVKA-Ⅱ是一种较好的诊断肝细胞癌的特异性肿瘤标志物[2],但国内这方面的研究相对较少,且实际临床应用有限。本研究收集了肝细胞癌、肝内胆管细胞癌、胃肠道恶性肿瘤、慢性乙型肝炎肝硬化患者及健康对照者共计298例,比较血清PIVKA-Ⅱ和甲胎蛋白(AFP)水平对诊断原发性肝癌的敏感度、特异性,以及与临床病理指标的关系,旨在探讨PIVKA-Ⅱ和AFP联合检测在原发性肝癌诊断中的价值。
1 对象与方法
1.1 研究对象 选择2016年3月至2017年3月徐州医科大学附属医院收治的肝癌等患者。纳入标准:①肝细胞癌、肝内胆管细胞癌符合2011版《原发性肝癌诊疗规范》并经病理(手术/肝穿刺)确诊;②胃肠道恶性肿瘤经病理确诊,排除病毒性肝炎感染病史及肿瘤肝转移者;③慢性乙型肝炎肝硬化患者符合2015版《慢性乙型肝炎防治指南》中的诊断标准; ④以上患者均未服用维生素K及维生素K拮抗剂类药物、NMTT头孢类抗生素,同时排除妊娠、生殖腺胚胎瘤及梗阻性黄疸等疾病。分为以下5组:①肝细胞癌组184例,其中男148例、女36例;年龄57.7±11.0(27~81)岁。按TNM肿瘤分期Ⅰ期33例,Ⅱ期66例,Ⅲ期82例,Ⅳ期3例。肿瘤直径≤2 cm 15例,2 cm<直径≤5 cm 61例,直径>5 cm 108例。肿瘤单发111例,多发73例。病理检查高分化30例,中分化98例,低分化56例。伴或不伴有门静脉主要属支/肝静脉癌栓的分别为42例和142例。②肝内胆管细胞癌组11例,其中男6例,女5例;年龄55.6±11.0(33~68)岁。③胃肠道恶性肿瘤组10例,其中男7例,女3例;年龄61.5±10.4(43~74)岁;胃癌6例,结肠癌4例。④慢性乙型肝炎肝硬化组73例,其中男49例,女24例;年龄53.9±10.1(33~76)岁。⑤健康对照组20例,其中男13例,女7例;年龄56.0±12.2(35~89)岁。上述5组间性别、年龄比较,差异无统计学意义(P>0.05)。
1.2 方法 各组于术前清晨空腹采集静脉血液4 ml,当日送本院检验科检测。PIVKA-Ⅱ和AFP分别采用酶联免疫吸附法和电化学发光法检测,并严格按照说明书进行操作。分别以40 mAU/ml和20 ng/ml作为PIVKA-Ⅱ和AFP诊断肝细胞癌临界值。

2 结果
2.1 各组血清PIVKA-Ⅱ和AFP水平的比较 肝细胞癌组PIVKA-Ⅱ和AFP水平与肝内胆管细胞癌组、胃肠道恶性肿瘤组、慢性乙型肝炎肝硬化组、健康对照组相比,差异有统计学意义(均P<0.05)。慢性乙型肝炎肝硬化组AFP水平与胃肠道恶性肿瘤组、健康对照组相比,差异有统计学意义(均P<0.05)。见表1。
2.2 血清AFP、PIVKA-Ⅱ及AFP联合PIVKA-Ⅱ对肝细胞癌的诊断 分别以AFP≥20 ng/ml和PIVKA-Ⅱ≥40 mAU/ml作为诊断肝细胞癌的临界值, 以实际病理结果为金标准,3种方法的灵敏度、特异度、正确率、阳性预测值、阴性预测值见表2。
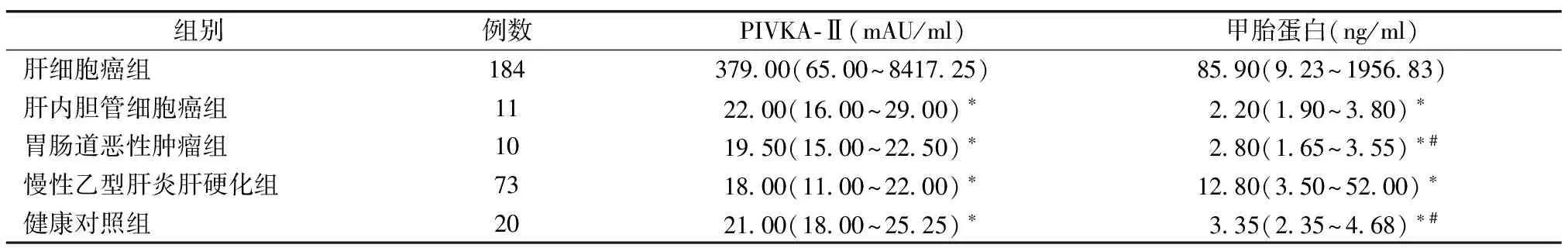
表1 各组血清PIVKA-Ⅱ和甲胎蛋白水平的比较[M(Q25,Q75)]
注:*与肝细胞癌组比较,P<0.05;#与慢性乙型肝炎肝硬化组比较,P<0.05

表2 血清PIVKA-Ⅱ和甲胎蛋白(AFP)诊断肝细胞癌的评价指标比较(%)
注:*与AFP比较,P<0.05;#与PIVKA-Ⅱ比较,P<0.05
两个指标独立及联合检出肝细胞癌的情况见表3。PIVKA-Ⅱ、AFP联合PIVKA-Ⅱ对肝细胞癌检出的灵敏度、特异度、正确率、阳性预测值、阴性预测值均高于AFP,差异有统计学意义(P<0.05)。AFP联合PIVKA-Ⅱ对肝细胞癌检出的特异度、正确率、阳性预测值、阴性预测值均高于PIVKA-Ⅱ,差异有统计学意义(P<0.05)。

表3 血清甲胎蛋白(AFP)、 PIVKA-Ⅱ及AFP联合PIVKA-Ⅱ对肝细胞癌的检出情况(例)
2.3 ROC曲线分析血清PIVKA-Ⅱ和AFP水平对肝细胞癌的诊断 PIVKA-Ⅱ的ROC曲线下面积为0.925(95%CI:0.896~0.954)(P<0.05);AFP的ROC曲线下面积为0.775(95%CI:0.722~0.827)(P<0.05),PIVKA-Ⅱ、AFP对肝细胞癌均有诊断价值,但PIVKA-Ⅱ优于AFP,差异有统计学意义(Z=5.494,P<0.05),见图1。

图1 血清PIVKA-Ⅱ和AFP诊断肝细胞性癌的ROC曲线
2.4 肝细胞癌患者血清PIVKA-Ⅱ和AFP水平的相关性分析 对肝细胞癌患者血清PIVKA-Ⅱ及AFP水平作散点图进行相关性分析,结果显示血清PIVKA-Ⅱ与AFP水平无相关性,见图2。
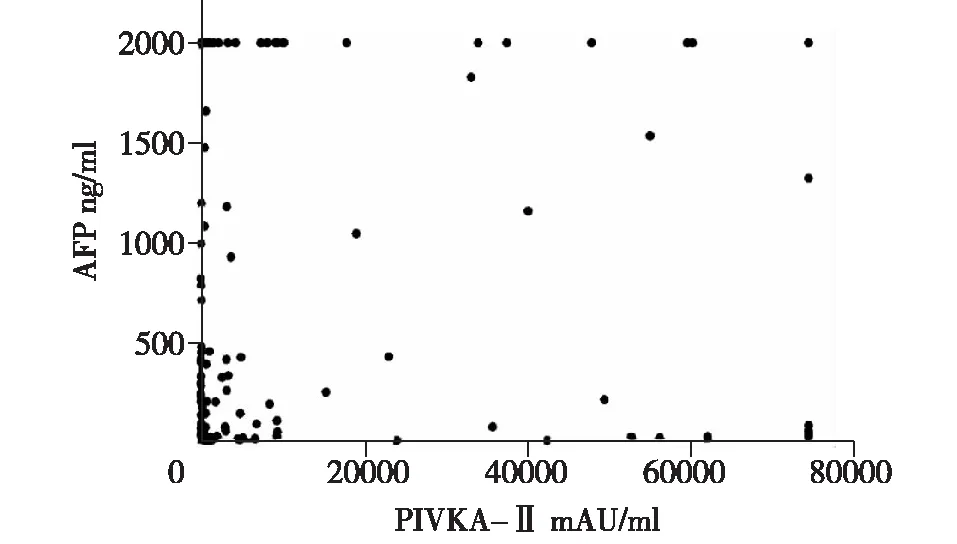
图2 血清AFP水平与PIVKA-Ⅱ及水平的关系
2.5 血清PIVKA-Ⅱ水平与肝细胞癌患者临床病理特征的关系 PIVKA-Ⅱ水平与肿瘤大小、数目、伴或不伴有门静脉/肝静脉癌栓及TNM分期有关,差异有统计学意义(P<0.05),而与年龄和肿瘤细胞分化程度无关,差异无统计学意义(P>0.05)(表4)。
3 讨论
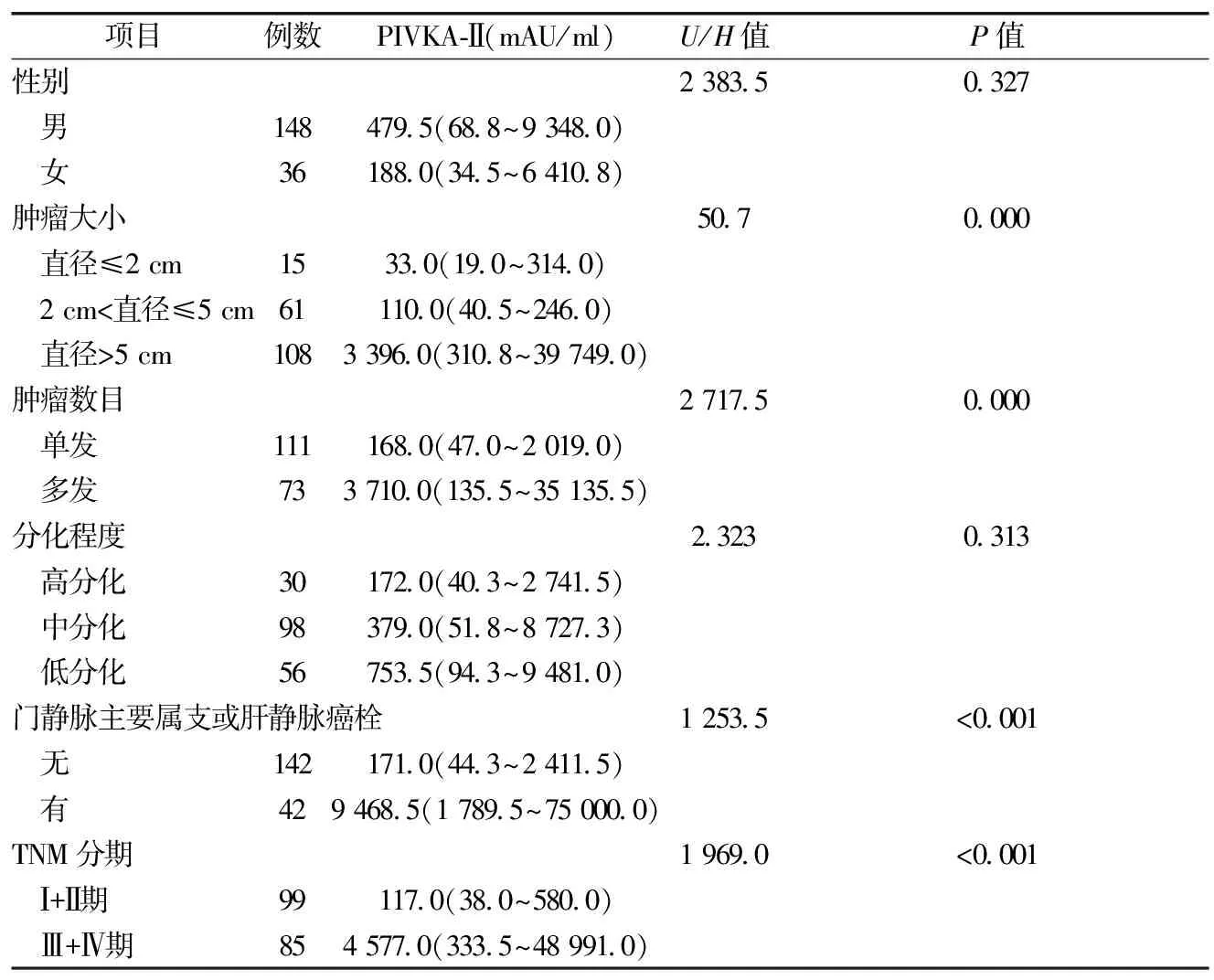
表4 血清PIVKA-Ⅱ水平与肝细胞癌患者临床病理特征之间的关系[M(Q25,Q75)]
我国肝细胞癌患者约占世界肝细胞癌患者总数55%[3],农村地区发病率居恶性肿瘤第1位,城市地区发病率居第2位[4]。肝细胞癌的诊断主要依靠影像学技术、肝穿刺和肿瘤标志物检测。然而,影像学表现不典型的肝细胞癌病例并不少见,且出现肉眼可辨病灶时病情已达中晚期。肝穿刺活检虽然可作为肝细胞癌确诊的重要手段,但是患者依从性较差,且存在癌组织种植转移的风险。临床上最为常用的肝细胞癌诊断的肿瘤标志物为AFP,但其灵敏度和特异度尚不能令人满意[5-6]。
PIVKA-Ⅱ是肝脏合成的无凝血活性的异常凝血酶原,自1984年Liebman等[7]首次报道,逐渐成为研究热点。目前PIVKA-Ⅱ在日本、韩国、欧美等国家已应用于临床[8],但日本、韩国等国家肝细胞癌患者主要由丙型肝炎慢性感染引起[9],而我国肝细胞癌患者中85%为慢性乙型肝炎感染者。因此,PIVKA-Ⅱ在我国的应用仍需进一步研究。
本研究结果显示,肝细胞癌组PIVKA-Ⅱ和AFP水平均高于健康对照组,慢性乙型肝炎肝硬化组AFP水平高于胃肠道恶性肿瘤组、健康对照组。而肝内胆管细胞癌组、胃肠道恶性肿瘤组和慢性乙型肝炎肝硬化组的PIVKA-Ⅱ水平均无升高。这一结果说明,血清PIVKA-Ⅱ可能仅与肝细胞癌有关,可作为肝细胞癌诊断的特异性肿瘤标志物。临床上约有1/3肝细胞癌患者血清AFP检测为阴性[10],PIVKA-Ⅱ对肝细胞癌检出的灵敏度、特异度、正确率、阳性预测值、阴性预测值均高于AFP,且AFP联合PIVKA-Ⅱ对肝细胞癌检出的特异度、正确率、阳性预测值、阴性预测值均高于PIVKA-Ⅱ。此外,ROC曲线显示,PIVKA-Ⅱ的ROC曲线下面积0.925(95%CI:0.896~0.954)高于AFP的ROC曲线下面积0.775(95%CI:0.722~0.827),说明在诊断肝细胞癌方面,PIVKA-Ⅱ优于AFP。因此AFP联合PIVKA-Ⅱ检测有助于提高肝细胞癌诊断的准确率,降低假阳性率和假阴性率,有良好的诊断效果。
本研究发现,血清PIVKA-Ⅱ与AFP两者之间无相关性,这可能是由于PIVKA-Ⅱ和AFP产生的机制不同[11]。然而,PIVKA-Ⅱ与TNM分期、肿瘤大小、肿瘤数目以及是否伴有门静脉主要属支或肝静脉癌栓有关。TNM分期为Ⅲ/Ⅳ期患者PIVKA-Ⅱ水平高于Ⅰ/Ⅱ期患者;肿瘤直径越大,PIVKA-Ⅱ水平越高;多发肿瘤及伴有门静脉主要属支或肝静脉癌栓的患者,PIVKA-Ⅱ水平高于单发肿瘤及不伴有门静脉主要属支或肝静脉癌栓的患者。说明PIVKA-Ⅱ不但有助于肝细胞癌的诊断,也可能有助于临床病理预估。这与Wang和Inagaki等[12-13]结论一致。此外,我们注意到随着肝细胞癌细胞分化程度的降低,PIVKA-Ⅱ有升高趋势,但差异无统计学意义,可能与本研究中病例样本不够大有关,需进一步研究。
参考文献:
[1] Wu Q, Qin SK. Features and treatment options of Chinese hepatocellular carcinoma[J]. Chin Clin Oncol, 2013,2(4):38.
[2] Zinkin NT, Grall F, Bhaskar K, et al. Serum proteomics and biomarkers in hepatocellular carcinoma and chronic liver disease[J]. Clin Cancer Res, 2008,14(2):470-477.
[3] 李楠, 陈斌, 黄勇慧. 乏氧对肝癌TACE治疗影响的分析[J]. 中国肿瘤外科杂志, 2016, 8(5): 338-341.
[4] Zhu RX, Seto WK, Lai CL, et al. Epidemiology of Hepatocellular Carcinoma in the Asia-Pacific Region[J]. Gut Liver, 2016,10(3):332-339.
[5] Jia X, Liu J, Gao Y, et al. Diagnosis accuracy of serum glypican-3 in patients with hepatocellular carcinoma: a systematic review with meta-analysis[J]. Arch Med Res, 2014,45(7):580-588.
[6] Toyoda H, Kumada T, Tada T, et al. Clinical utility of highly sensitive Lens culinaris agglutinin-reactive alpha-fetoprotein in hepatocellular carcinoma patients with alpha-fetoprotein<20 ng/mL[J]. Cancer Sci, 2011,102(5):1025-1031.
[7] Liebman HA, Furie BC, Tong MJ, et al. Des-gamma-carboxy (abnormal) prothrombin as a serum marker of primary hepatocellular carcinoma[J]. N Engl J Med, 1984,310(22):1427-1431.
[8] Kiriyama S, Uchiyama K, Ueno M, et al. Triple positive tumor markers for hepatocellular carcinoma are useful predictors of poor survival[J]. Ann Surg, 2011,254(6):984-991.
[9] El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007,132(7):2557-2576.
[10] Liu C, Xiao GQ, Yan LN, et al. Value of α-fetoprotein in association with clinicopathological features of hepatocellular carcinoma[J].World J Gastroenterol,2013,19(11):1811-1819.
[11] Bertino G, Ardiri A, Malaguarnera M, et al. Hepatocellualar carcinoma serum markers[J]. Semin Oncol, 2012,39(4):410-433.
[12] Wang CS, Lin CL, Lee HC, et al. Usefulness of serum des-gamma-carboxy prothrombin in detection of hepatocellular carcinoma[J]. World J Gastroenterol, 2005,11(39):6115-6119.
[13] Inagaki Y, Xu HL, Hasegawa K, et al. Des-gamma-carboxyprothrombin in patients with hepatocellular carcinoma and liver cirrhosis[J]. J Dig Dis, 2011,12(6):481-488.
