薏苡附子败酱散对糖尿病小鼠炎症因子及肠道菌群的影响
2018-04-24陈玲玲张思为李董平陈伊莉
陈玲玲,张思为,李董平,陈伊莉
广东省深圳市人民医院中医科(深圳518020)
2型糖尿病(Type 2 diabetes mellitus,T2DM)是最常见的代谢疾病之一,严重危害身体的器官尤其是肾脏、眼睛、心脏和神经[1],已成为全球性公共卫生问题。开发T2DM的新的治疗药物具有重大的意义。近年来研究表明糖尿病、肥胖等代谢性疾病的发生发展与肠道菌群特别是双歧杆菌、乳酸杆菌等密切相关,调节肠道菌群的分布能够抑制T2DM患者的炎症表达,降低血糖发挥治疗作用[2-5]。薏苡附子败酱散具有良好的抗炎疗效,临床被广泛用于肠道慢性炎症以及其他炎症相关疾病的治疗[6-9]。炎症不仅能够促进T2DM的发生发展,而且和T2DM的并发症密切相关[10-11],因此推测薏苡附子败酱散可能通过调节炎症因子的分泌治疗T2DM。本研究以肠道菌群研究为基础,结合糖脂代谢紊乱的炎症机制,探讨经方薏苡附子败酱散改善糖脂代谢的作用和机制,也为中医药临床疗效的研究提供新的思路和途径。
材料和方法
1 动物饲养以及模型构建 购买80只雄性SPF级C57BL/6J小鼠,体重在18~22 g之间。在开展实验之前小鼠适应性喂养1周:每5只小鼠养在一个聚丙烯笼子里面,温度为(22±2) ℃,湿度为(55±5) %,12 h的光和 12 h的黑暗交替。1周之后改喂养高脂饲料,喂养4周后均禁食12 h,然后在小鼠左下腹腔注射链脲佐菌素(130 mg/kg)柠檬酸-柠檬酸钠注射溶液,在注射后继续高脂饲料喂养,第5日禁食6 h,小鼠尾静脉取血20 μl,测空腹血糖(Fasting blood sugar,FBG)。如果FBG≥11.1 mmol/L则认为2型糖尿病小鼠模型构建成功。
2 治疗和取样 将2型糖尿病模型构建成功小鼠随机分为3组,分别为高糖高脂饮食+薏苡附子败酱散煎液组(中药组,n=20),高糖高脂饮食+辛伐他汀组(他汀组,n=20);高糖高脂饮食+生理盐水组(对照组,n=20)。中药组给予中药原液0.6 g/kg的剂量灌胃给药,他汀组给予20 mg/(kg·d)的辛伐他汀灌胃给药,对照组给予等体积的生理盐水灌胃。治疗前眼球取血并收集小鼠粪便,分别检测血糖、血脂、炎症因子及肠道双歧杆菌、乳酸杆菌。自药物干预后第28天每只小鼠眼球取血,颈椎脱臼处死后解剖小鼠,采集盲肠内容物,分别检测血糖、血脂、炎症因子及肠道双歧杆菌、乳酸杆菌。小鼠摘眼球取的全血分别静置2 h后,3500 r/min离心 15 min,吸取澄清的血清。所有小鼠血清及盲肠内容物放在-80 ℃冰箱中保存,备用。
薏苡附子败酱煎液:薏苡仁36 g,败酱草15 g,熟附子6 g。将药物浸泡30 min,按照常规中草药煎煮方法,煎煮提取2次,过滤后合并提取液,浓缩为生药浓度为0.6 g/ml的中药原液,4 ℃保存。
3 生化指标和炎症因子检测 血清FPG采用血糖仪测定(罗氏血糖仪,德国Roche公司);甘油三脂(Triglyceride,TG)、总胆固醇(Total cholesterol,TC)、高密度脂蛋白(High-density lipoprotein,HDL)、低密度脂蛋白(Low density lipoprotein,LDL)以及脂多糖(Lipopolysaccharide,LPS)采用全自动生化分析仪(罗氏COBAS INTEGRA800型)进行检测;白介素6(Interleukin 6,IL-6)采用ELISA试剂盒检测(试剂盒购自美国ebioscience公司),操作按照操作说明书进行。
4 肠道菌群检测(实时荧光定量PCR) 粪便标本按细菌DNA提取试剂盒(批号:E.Z.N.A. Stool DNAKit,美国Omega 公司)说明书步骤进行粪便处理和提取粪便DNA。引物委托上海生工合成,双歧杆菌上游引物为5’-GCGTGCTTAACACATGCAAGTC-3’,下游引物为5’-CACCCGTTTCCAGGAGCTATT-3’;乳酸杆菌上游引物为5’-AGCAGTAGGGAATCTTCCA-3’,下游引物为5’-CACCGCTACACATGGAG-3’。双歧杆菌和乳酸杆菌数量的检测方法按照参考文献进行[12]。简而言之,首先构建双歧杆菌和乳酸杆菌标准品质粒,将质粒标准品做10倍系列稀释,使其形成拷贝数为1012~102拷贝/ml,将以上质粒作为阳性模板进行qPCR检测。其次采用实时荧光定量PCR仪(Applied Biosystems公司,型号:7500)检测粪便标本中双歧杆菌和乳酸杆菌数量。反应体系如下:DNA,5.0 μl;上游引物,0.5 μl;下游引物,0.5 μl;2×SYBR Green qPCR SuperMix,10 μl;dd H2O,4.0 μl,总体积,20 μl。反应条件如下:95 ℃预变性30 s;95 ℃变性5s,55 ℃退火30 s,72 ℃延伸30 s,40 循环;每个样重复3次;将每份待测标本所对应的qPCR结果和标准曲线进行比较计算。菌数量采用对数值表示(lgN/g湿便)。
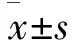
结 果
1 薏苡附子败酱散对糖脂代谢的影响 糖尿病模型构建后采用薏苡附子败酱散治疗28 d,眼球取血,检测血清中FPG、TG、TC、HDL和LDL水平,结果如表1所示。结果表明中药组和他汀组治疗前和治疗后相比FPG、TG、TC和LDL水平都存在显著差异(P<0.05),治疗后的FPG、TG、TC和LDL的表达明显下降,但是HDL水平没有显著差异(P>0.05);该结果还表明和对照组治疗后相比,他汀组治疗后和中药组治疗后FPG、TG、TC和LDL水平明显下降(P<0.05),但是HDL水平没有显著差异(P>0.05);他汀组治疗后TG、TC和LDL下降趋势比中药组治疗后更为显著,FPG和HDL水平没有显著差异(P>0.05)。

表1 治疗组和对照组中糖脂代谢指标比较
注:治疗后和治疗前相比,*P<0.05;中药组和他汀组治疗后同对照组治疗后相比,#P<0.05;表示中药组和他汀组治疗后相比,&P<0.05
2 薏苡附子败酱散对炎症因子和肠道菌群的影响 糖尿病模型构建后采用薏苡附子败酱散治疗28 d,眼球取血检测血清中LPS和IL-6水平,同时采用qPCR检测粪便中乳酸杆菌和双歧杆菌数量,结果如表2所示。该结果表明中药组和他汀组治疗前和治疗后相比LPS、IL-6、乳酸杆菌和双歧杆菌数量都存在显著差异(P<0.05),治疗后LPS和IL-6水平显著下降,而乳酸杆菌和双歧杆菌数量显著增加;该结果还表明和对照组治疗后相比,他汀组治疗后和中药组治疗后LPS和IL-6水平显著下降,而乳酸杆菌和双歧杆菌数量显著增加(P<0.05);和他汀组相比,中药组治疗后LPS和IL-6的下降更为显著(P<0.05);乳酸杆菌和双歧杆菌数量的增加更加显著(P<0.05)。

表2 治疗组和对照组中炎症因子和肠道菌群的比较
注:治疗后和治疗前相比,*P<0.05;中药组和他汀组治疗后同对照组治疗后相比,#P<0.05;表示中药组和他汀组治疗后相比,&P<0.05
讨 论
炎症和T2DM的发生发展以及并发症密切相关[10]。在糖尿病的发生发展过程中LPS和炎症因子的表达显著增加,引发胰岛素抵抗,最终导致糖尿病以及并发症(例如大量白蛋白尿)的出现[11],在某些药物治疗糖尿病的过程中CRP、IL-6和TNF-α的水平的明显降低,间接反映药物的治疗效果[3]。本研究结果表明薏苡附子败酱散在治疗糖尿病的过程中能够显著降低LPS和IL-6的水平,发挥抗炎症作用。
肠道菌群和糖尿病有着密切关系。肠道菌群可以改善葡萄糖耐受,恢复葡萄糖诱导的胰岛素分泌,降低内毒素血症和炎症因子水平,并最终改善糖尿病患者的代谢紊乱。我们通过前期的临床研究表明,黄连素治疗可以增加T2DM患者肠道双歧杆菌的数量并降低患者体内的炎症因子水平[3],而且双歧杆菌的数量和炎症因子水平具有负相关性。本研究结果表明薏苡附子败酱散在治疗糖尿病的过程中能够增加乳酸杆菌和双歧杆菌的数量,调节肠道菌群的分布。
他汀类药物是临床上最常用且疗效确切的一种降血脂药物。本研究表明辛伐他汀能够显著降低糖尿病小鼠血清中FPG、TG、TC、LDL水平。和薏苡附子败酱散组相比,辛伐他汀组治疗后糖尿病小鼠血清中FPG、TG、TC、LDL水平显著降低,但LPS和IL-6的水平显著高于薏苡附子败酱散组,乳酸杆菌和双歧杆菌数量显著低于薏苡附子败酱散组。以上结果说明薏苡附子败酱散可能是通过降低炎症因子表达、调节肠道菌群分布而改善糖脂代谢。
糖尿病属中医“消渴”范畴。《素问·奇病论》:“有病口甘者……名曰脾瘅,此肥美之所发也,其人必数食甘美而多肥,甘者令人中满,肥者令人内热,故其气上溢,转为消渴。”消渴“内热”这一基本病机,与现代医学糖尿病炎症状态的认识基本一致。薏苡附子败酱散出自《金匮要略》:“肠痈之为病,其身甲错,腹皮急,按之濡,如肿状,腹无积聚,身无热,脉数,此为肠内有痈脓,薏苡附子败酱散主之”。薏苡仁十二分,败酱草五分,熟附子二分。方中重用薏苡仁,一可清热利湿除湿热之标,二可健脾益胃除生湿之源,三可排脓消痈治疗局部炎症,为君药。败酱草清热解毒、消痈排脓,活血祛瘀止痛。佐以少量附子,假其辛热以行郁滞之气。薏苡附子败酱散临床上常被用于治疗痢疾、腹腔脓肿、细菌性肝脓肿、克隆氏病、溃疡性结肠炎、慢性盆腔炎等炎症性疾病,疗效确切。
总之,本研究证实薏苡附子败酱散能够增加乳酸杆菌和双歧杆菌的数量,降低炎症因子LPS和IL-6的水平,改善糖尿病小鼠的糖脂代谢,从肠道菌群和炎症方面探讨薏苡附子败酱散对糖尿病小鼠模型的影响,为临床应用薏苡附子败酱散治疗糖尿病提供新的理论依据。
[1] Naqshbandi M,Harris SB,Esler JG,etal. Global complication rates of type 2 diabetes in indigenous peoples:A comprehensive review [J]. Diabetes Res ClinPract,2008,82(1):1-17.
[2] Tai N,Wong FS,Wen L. The role of gut microbiota in the development of type 1,type 2 diabetes mellitus and obesity [J]. Rev EndocrMetabDisord,2015,16(1):55-65.
[3] 陈玲玲,陆文松,廖水玉,等. 黄连素对2型糖尿病患者血清炎症因子水平及肠道双歧杆菌的影响 [J]. 中医杂志,2016,57(23):2028-2031.
[4] 李吉武,唐爱华,赵 伟,等. 温阳益气活血方对肥胖2型糖尿病患者肠道菌群变化及脂质代谢的影响 [J]. 中医杂志,2015,56(5):409-413.
[5] Wang Y,Luo X,Mao X,etal. Gut microbiome analysis of type 2 diabetic patients from the chinese minority ethnic groups the uygurs and kazaks [J]. PLoS One,2017,12(3):256-258.
[6] 孔令青. 大柴胡汤合薏苡附子败酱散改善ⅲ型前列腺炎疼痛症状 [J]. 中国中医基础医学杂志,2016,22(9):1270-1272.
[7] 李 洋,王政医,梁海彬. 薏苡附子败酱散联合西药治疗急性放射性直肠炎36例 [J]. 中医研究,2015,28(6):35-36.
[8] 王碧芬,郑小平,陆海英,等. 薏苡附子败酱散加味汤对慢性盆腔炎患者血液流变学及血清C-反应蛋白的影响 [J]. 浙江中医杂志,2015,50(11):792-793.
[9] 张双喜,史仁杰. 薏苡附子败酱散对TNBS结肠炎模型大鼠Treg/Th17的影响 [J]. 世界华人消化杂志,2014,22(11):1542-1546.
[10] Roman-Pintos LM,Villegas-Rivera G,Rodriguez-Carrizalez AD,etal. Diabetic polyneuropathy in type 2 diabetes mellitus:Inflammation,oxidative stress,and mitochondrial function [J]. J Diabetes Res,2016:3425617.
[11] Fallucca F,Porrata C,Fallucca S,etal. Influence of diet on gut microbiota,inflammation and type 2 diabetes mellitus. First experience with macrobiotic ma-pi 2 diet [J]. Diabetes Metab Res Rev,2014,1:48-54.
