肺岩宁方通过RANK-RANKL途径调节肺癌骨转移中破骨细胞活化机制的研究*
2018-04-24张程程钦敬茹王中奇
张程程,季 青,杨 越,钦敬茹,谢 瑜,王中奇△
1.上海中医药大学附属龙华医院(上海 200032),2.上海中医药大学附属曙光医院(上海 201203)
肺癌是最常见的恶性肿瘤,发病率呈逐年上升趋势[1],骨转移是肺癌常见的转移部位,约30%~40%的进展期肺癌出现骨转移[2],其发生发展与溶骨性骨质破坏有关。中医认为,肺肾两虚,络脉痹阻是肺癌骨转移的主要病机[3]。益气养精,通络解毒的肺岩宁方在临床抗骨转移治疗中取得了较好疗效[4],其作用机制可能与RANK/RANKL途径有关。本文采用人肺腺癌A549细胞悬液骨髓腔注射建立肺癌骨转移模型,检测肺岩宁方干预治疗对肺癌骨转移过程中骨破坏情况及骨组织TRAP阳性细胞的表达情况,探讨肺癌骨转移过程中RANK/RANKL途径与溶骨性骨质破坏的关系。
材料与方法
1 动物和瘤株 BALB/c裸鼠40只,雌性,6周龄,体重(20±2) g,SPF级,购于上海斯莱克实验动物有限责任公司,动物许可证号为:SYXK(沪) 2014-0008。饲养于上海中医药大学动物房,室温(25±2)℃,自由摄食和饮水;人肺腺癌A549细胞株,购自中科院上海细胞库。
2 实验药物 肺岩宁方组成:生黄芪、仙灵脾、黄精、灵芝各30 g,女贞子、七叶一枝花、山萸肉各15 g,白术、蜂房、干蟾皮各9 g,以上药物均由龙华医院中药房提供。水煎浓缩至生药含量为2.0 g/ml,4℃保存备用;唑来膦酸注射液:4 mg/支,国药准字H20041346,正大天晴药业。
3 试剂及耗材 双抗、胎牛血清,美国GIBCO公司;RPMI-1640培养基,美国Hyclone公司;戊巴比妥钠,美国Sigma公司;TRAP染色液,南京森贝伽生物科技有限公司;苏木素染液、中性树胶,南京建成有限公司;二甲苯、切片石蜡,4%多聚甲醛,国药集团化学试剂有限公司; Leica一次性刀片,德国Leica公司。
4 实验仪器 CO2培养箱,台式低速离心机,美国Thermo 公司;荧光倒置显微镜,日本OLMYPUS 公司;垂直流超净工作台,新加坡ESCO公司;高通量组织研磨仪,上海必横生物有限公司;石蜡切片机,湖北徕克医疗仪器有限公司;摊片烤片机、石蜡包埋机,金华市益迪医疗器械有限公司;微量X射线断层扫描仪(Micro-CT),上海钰森生物技术有限公司。
5 实验方法
5.1 A549细胞株培养:人肺腺癌A549细胞株,将其培养于含10%胎牛血清及青霉素、链霉素各100 μg/ml的RPMI-1640培养基中,37 ℃、5%CO2饱和湿度环境条件下连续培养,按1∶3比例传代培养。取对数生长期的A549细胞,经消化并计数细胞数目后,用无血清1640培养液调整细胞浓度至1×108个/ml。
5.2 肺癌骨转移动物模型构建:参照赵凌燕等[5]造模方法,腹腔注射浓度为1%的戊巴比妥钠(60 mg/kg)麻醉小鼠后,将小鼠右腿膝关节弯曲成90度角,手术刀片切开右侧胫骨上部的皮肤和肌肉,行膝内侧纵切口约4 mm,显露胫骨上端;于胫骨结节内上方用26G针头穿刺,延胫骨髓腔纵轴进针约3~4 mm,遇到阻力后即停止进针,改用依次吸有2 μl明胶海绵、1 μl空气和10 μl上述1×108个/ml浓度肿瘤细胞悬液的25 μl微量注射器注入胫骨骨髓腔内并缝合皮肤,上述过程于1 h内完成。
5.3 动物分组及给药:小鼠按体重分层随机分成模型组,唑来膦酸组,肺岩宁组,每组10只。空白组10只,不予造模,其余各组均以前述造模方法予以造模。造模当天开始给药,给药剂量按人鼠体表面积折算法计算[6]。空白组及模型组给予生理盐水灌胃(15 ml/kg),1次/d,连续灌胃28 d;唑来膦酸组于造模后每5日1次尾静脉注射浓度为0.1 g/ml的唑来膦酸(0.6 mg/kg),共5次;肺岩宁组予浓度为2 g/ml的肺岩宁方灌胃(15 ml/kg),1次/d,连续灌胃28 d。
6 观察指标和检测方法
6.1 小鼠体重和生存状态:造模及用药前后,每7 d观察记录小鼠体重及生存状态。
6.2 小鼠骨组织Mirco-CT表现:治疗结束后,分别取各组小鼠右侧胫骨及少许软组织,用4%多聚甲醛液固定,采用Mirco-CT骨骼二维平面扫描及三维重建,对扫描好的样品中局部骨密度(BMD)、骨小梁厚度(Tb.Th)、骨体积分数(BV/TV)、骨表面体积比(BS/BV)等数据进行分析。
6.3 苏木素-伊红(Hematoxylin and eosin,HE)染色:治疗结束后,取各组小鼠右侧胫骨及少许软组织,先用4%多聚甲醛液固定48 h后,清水浸泡,流水洗净,在4 ℃条件下浸入10%EDTA脱钙液中脱钙2周,常规石蜡包埋,取包埋后的小鼠右胫骨组织,进行H&E染色,显微镜下选取合适视野,观察骨组织形态。
6.4 抗酒石酸的酸性磷酸酶(Tartrate-resistant acid phosphatase,TRAP)染色:治疗结束后,取经固定、清洗、脱钙、常规石蜡包埋后的小鼠右胫骨组织,进行TRAP染色,计算TRAP(+)细胞数及体积,观察和鉴定生成的破骨细胞。

结 果
1 肺岩宁方对小鼠体重及生存状态的影响 造模后,与空白组小鼠相比,其余各组小鼠体重均有不同程度的降低,模型组下降较为明显(P<0.05),唑来膦酸组、肺岩宁组体重下降程度明显减轻,但唑来膦酸组、肺岩宁组小鼠体重差异无统计学意义(P>0.05),见图1;第2周时,除空白组外各组小鼠均出现活动度下降;第3周时,唑来膦酸组、肺岩宁组小鼠活动度较前下降明显,但仍高于模型组;第4周时,模型组小鼠出现明显跛行及恶病质,而唑来膦酸组、肺岩宁组小鼠仅见轻微跛行。
2 各组小鼠胫骨Mirco-CT扫描平面表现 模型组存在明显的骨质破坏,骨皮质模糊、变薄,在胫骨平台尤为明显,部分骨小梁消失,呈虫蚀样表现,与临床上肺癌骨转移的表现是一致的;唑来膦酸组可见骨皮质轻度破坏,胫骨上端穿凿状小斑点破坏区,骨小梁厚度减少,平台轻微破坏塌陷;肺岩宁组骨破坏程度明显减轻,原有骨组织结构基本保持,仅在局部有少量的骨质破坏,见图2。
3 各组小鼠胫骨Mirco-CT扫描3D重建表现 空白组小鼠骨密度正常,骨小梁走向一致,粗细均匀,形状规则,排列密集,有一定的厚度;模型组小鼠的骨质特征为骨密度降低,骨量丢失,骨小梁结构发生了改变,骨强度下降,表现为骨质疏松样改变;唑来膦酸组及肺岩宁组较模型组相比,骨密度增高,骨小梁间距变小,网状结构保留,排列相对规则,见图3。
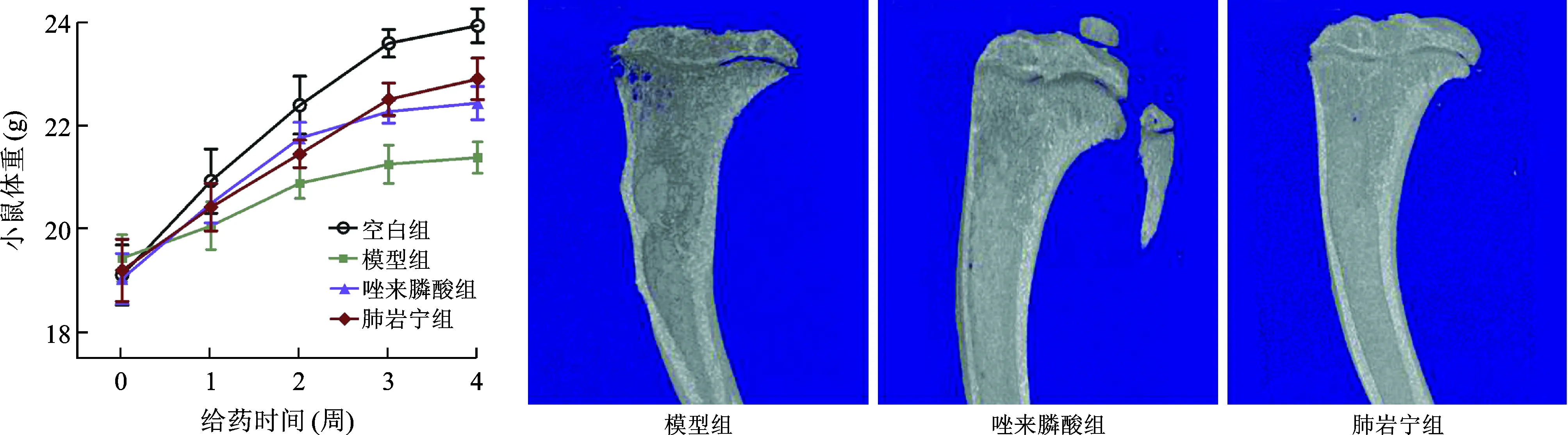
图1 肺岩宁对各组小鼠体重的影响 图2 小鼠右侧胫骨Micro-CT平面结果

图3 小鼠胫骨端Micro-CT 3D重建图像
4 各组小鼠胫骨Mirco-CT扫描数据分析 与空白组相比,模型组小鼠骨密度(BMD)、骨小梁厚度(Tb.Th)、骨体积分数(BV/TV)均降低,骨表面体积比(BS/BV)增高,差异有统计学意义(P<0.01);与模型组相比,唑来膦酸组及肺岩宁组小鼠骨密度、骨小梁厚度、骨体积分数升高(P<0.05),骨表面体积比下降(P<0.01),但唑来膦酸组与肺岩宁组小鼠比较差异无统计学意义(P>0.05),见图4。
5 各组小鼠骨组织HE染色结果 与空白组相比,模型组小鼠有明显的骨肿瘤灶,肿瘤细胞密集,在肿瘤组织与骨组织交界面的位置可见多个“梭形”多核细胞,细胞体积巨大,胞浆颜色相对较深,多个蓝染的胞核分布于胞浆内;唑来膦酸组、肺岩宁组小鼠骨组织肿瘤细胞密度明显降低,见图5。
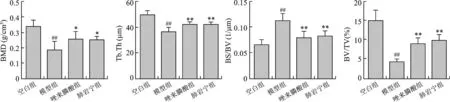
注:与空白组比较,# P<0.05;## P<0.01;与模型组比较,* P<0.05;** P<0.01
6 各组小鼠骨组织TRAP染色结果 模型组TRAP(+)细胞数及体积显著高于空白组,且生成体积巨大的多核破骨细胞(TRAP阳性多核细胞为破骨细胞);唑来膦酸组及肺岩宁组TRAP(+)细胞数及体积显著低于模型组,且未见多核破骨细胞形成,见图6。

注:A为空白组;B为模型组;C为唑来膦酸组;D、E为肺岩宁组

注:A为空白组;B为模型组;C为唑来膦酸组;D、E为肺岩宁组
讨 论
肺癌骨转移是目前临床治疗的难点之一,骨转移的类型包括溶骨性、成骨性和混合性骨转移,大多数表现为溶骨性骨转移[7]。80%骨转移患者以骨质破坏引起的疼痛为首发症状[8]。肿瘤细胞实现局部骨吸收,是通过刺激破骨细胞活化实现的[9]。在溶骨性骨破坏过程中,NF-κB受体激活剂(RANK)/RANK配体(RANKL)的调节起主要作用,RANKL绑定其特异性受体RANK之后可以促进破骨细胞前体成熟,形成破骨细胞,发挥骨质溶解作用[10]。分化成熟的破骨细胞形态上表现为多核聚集,并且分泌TRAP。因此破骨细胞的成熟由骨微环境中的RANK和RANKL调节,决定着局部骨溶解的平衡,RANKL过多可增加骨吸收,RANKL减少则抑制骨吸收。
中医药在治疗肺癌骨转移方面有一定的作用,中医学认为肺癌骨转移的发生是多种因素作用的结果,内因脏腑亏损,肾气不足,筋骨失养,脉络不畅,外因癌毒聚结、痰凝瘀阻筋骨,腐蚀骨骼,聚结成瘤。因此治疗应补肾养精,解毒散结通络[11]。肺岩宁方为来源于临床的经验方药,以补肾抗癌为基本原则,有研究表明补肾抗癌的中药能够抑制骨转移灶生长,缓解患者骨性疼痛,改善患者骨转移相关症状[12];基础研究也显示肺岩宁方具有减少肿瘤微环境血管新生,抑制肺癌侵袭转移的作用[13]。
本实验研究也提示肺岩宁方对改善肺癌骨转移小鼠体重及生存状态有一定作用,本研究通过骨组织HE染色和micro-CT摄片分析,检测各组小鼠骨质破坏程度,发现模型组肿瘤细胞活性强,骨组织破坏严重;而唑来膦酸组、肺岩宁组肿瘤细胞活性较低,骨组织破坏程度亦相应较轻。且唑来膦酸组和肺岩宁组骨组织破坏程度基本一致,提示唑来膦酸与肺岩宁方均有抗肺癌骨转移及减轻骨质破坏作用,其作用机制可能是通过抑制肿瘤细胞增殖,从而抑制溶骨性骨吸收实现的。
此外,骨组织TRAP染色发现,唑来膦酸组、肺岩宁组小鼠骨肿瘤的TRAP(+)细胞数均显著降低,与模型组比较差异均有统计学意义,TRAP染色提示中药复方肺岩宁方有抑制RANKL表达,减少TRAP分泌的作用,通过由骨微环境中的RANKL调节破骨细胞的成熟,促进局部骨溶解的平衡。
综上所述,RANK-RANKL途径是肺癌骨转移过程中介导溶骨性骨质破坏的重要环节。因此,我们推论,肺岩宁方可能通过调控RANK/RANKL信号的表达抑制肺癌骨转移的发生发展,进一步研究肺岩宁与抑制破骨细胞生成及溶骨性骨破坏的关系,有望为临床防治肺癌骨转移提供新的治疗思路及靶点。
[1] Chen WQ,Zheng RS,Zeng HM,etal. Annual report on status of cancer in China[J]. Chin J Cancer Res,2015,27(1):2-12.
[2] McErlean A, Ginsberg M S. Epidemiology of lung cancer[J].Semin Roentgenol,2011,46(3):173-177.
[3] 郑 展.徐振晔治疗肺癌骨转移经验[J].中医杂志,2007,48(1):24-25.
[4] 徐振晔,金长娟,沈德义,等.中医药分阶段结合化疗治疗晚期非小细胞肺癌的临床研究[J].中国中西医结合杂志,2007,27(10):874-878.
[5] 赵凌艳,徐祖红,李 炜,等.补肾散结方对肺癌骨转移小鼠PTHrP及TGF-β1表达的影响[J].上海中医药大学学报,2015,29(4):38-42.
[6] 陈 奇.中药药理研究方法学[M].北京:人民卫生出版社,1994:33-34.
[7] Kosteva J,Langer C. The changing landscape of the medical management of skel et al metastases in nonsmall cell lung cancer[J]. Curr Opin Oncol. 2008,20(2):155-161.
[8] Chiara D’A,Antonio P B. Bone and brain metastasis in lung cancer:recent advances in therapeutic strategies[J]. Ther Adv Med Oncol,2014,6(3) :101-114.
[9] Lewis M,Hendrickson A,Moynihan T. Oncologic emergencies:pathophysiology,presentation,diagnosis,and treatment[J]. CA Cancer J Clin,2011,61:287-314.
[10] Chen YC,Sosnoski DM,Mastro AM. Breast cancer metastasis to the bone:mechanisms of bone loss[J]. Breast Cancer Res,2011,(12):215.
[11] 王中奇,徐振晔. 肺癌从肾论治[J]. 四川中医, 2011, 29(6):28-30.
[12] 张 炜,赵凌艳,徐祖红,等.补肾散结方联合唑来膦酸治疗肺癌骨转移的临床疗效[J]. 世界中西医结合杂志.2015; 10(6):791-794.
[13] 王中奇,邓海滨,吴 继,等.肺岩宁方组分对小鼠肿瘤血管生成与MMP-2、MMP-9关系研究[J]. 中国中西医结合杂志. 2011,31(9):1229-1233.
