不同成分血液保存液对库存血液K+及pH值的影响
2018-04-24李松琳李大鹏李松涛
李松琳,李大鹏,李松涛
库存血液随保存时间延长,其中的电解质和酸 碱平衡会发生改变,库存血液输注后可能发生受血者血K+升高等反应,大量输血可导致电解质紊乱等,减少外界因素对库存血液质量影响成为现阶段临床及输血医学的重要研究课题[1-3]。
笔者在经典血液保存液Ⅲ中按比例添加丙氨酰谷氨酰胺,并以血液保存液Ⅲ为对照,通过监测采集血液储存过程中K+含量及pH值指标变化,探讨不同血液保存液对库存血液电解质及酸碱平衡的影响。
1 资料与方法
1.1 研究对象 选择无偿献血人员10名,均为男性,年龄不限。
1.2 仪器与试剂 测定K+含量仪器包括ST360全自动酶标仪(上海科华,检测波长450 nm)、5810R台式冷冻高速离心机(德国Eppendorf公司)等。测定pH值使用Delta320型酸度计 (梅特勒-托利多仪器有限公司)。K+测定试剂盒购自南京建成生物工程研究所。
1.3 血液保存液配制 根据丙氨酰谷氨酰胺(四川科伦,50 ml∶10 g)使用时其在与载体溶液混合液中最大浓度不能超过3.5%的要求,其稀释液(0.9%氯化钠注射液稀释)与血液保存液Ⅲ按1.8∶1比例混合均匀配成实验组血液保存液。选取一次性使用塑料血袋中血液保存液Ⅲ(四川南格尔公司,生产批号150123,国药准字H20045509)为对照组血液保存液。
1.4 实验方案 选取无菌试管20只均分为实验组A和对照组B。根据测定pH值Delta320型酸度计探头要求及K+检测取样量,2组试管中均应加入全血3ml。按照血液保存液Ⅲ56 ml采集全血400 ml要求,B组1~10管均分别加入血液保存液Ⅲ0.42 ml,A组1~10管均分别相应加入实验组血液保存液1.176 ml。
采集10名献血者未抗凝静脉血,分别对应加入A、B 2组1~10试管中各3 ml,充分摇匀后放置4~6℃冰箱保存。根据K+和pH检测取样对标本无菌、标本量等影响,结合ACD、CPD保存液采血21 d、35 d保存期等因素,样本检测时间为血液采集后10 d、21 d、35 d。
1.5 指标测定 K+含量测定采用微板法,严格按试剂盒操作说明书要求进行实验操作,450 nm波长测各孔吸光度A。Delta320型酸度计测定pH值严格按照说明书。
1.6 统计学方法 检验数据以均数±标准差 (x±s)表示。选择SPSS 13.0统计学软件进行数据处理,P<0.05为差异具有统计学意义。
2 结果
采血后 10 d、21 d、35 d 分别检测 A、B 两组血液 K+含量,10 d、35 d分别检测 A、B 两组 pH 值,数据 按 检 测 时 间 分 组 为 T1、T2、T3, 共 AT1、AT2、AT3、BT1、BT2、BT3六组。
2.1 K+含量测定 K+含量检测各组基本统计量见表1,由相同检测时间同样本A、B两组检测值取得配对样本数据,配对T检验结果见表2,其中AT1、BT1间差异有统计学意义(P<0.05),其余组间差异无统计学意义(P>0.05)。

表1 各组K+含量检测值

表2 配对T检验结果
实验数据资料为重复测量资料(时间和组别因素),对数据进行球型检验,取得ε校正系数进行数据校正,检验结果见表3;对重复效应和交互效应进行方差分析(F检验),结果见表4,表明各检测时间之间差异有统计学意义(P<0.001),检测组间差异无统计学意义(P>0.05),时间与组别因素间存在显著交互作用(P<0.001)。LSD法进行各检测时间之间多重比较,结果见表5,表明K+含量均存在显著性差异(P<0.05)。在α=0.05置信水平下,各检测时间之间K+含量均存在显著性差异,第10天检测K+含量A、B两组间存在显著性差异,A组显著低于B组,其余时间K+含量差异不显著。
2.2 pH值测定 pH测定数据按时间分为T1、T3两组,各组基本统计量见表6,对时间及组别因素数据进行方差齐性检验,检验结果F=1.286,P=0.294;对时间及组别因素数据进行方差分析,检验结果见表4,结合表6分析,表明检测时间之间差异有统计学意义 (F=1060.585,P<0.001),10 d 测定 pH 值显著高于35 d;检测组间pH值差异有统计学意义(F=20.249,P<0.001),A 组显著低于 B 组。 在 α=0.05置信水平下,检测时间之间pH值具有显著性差异,检测组间pH值存在显著性差异。时间因素与组别因素之间无交互作用。

表3 K+球型检验结果

表4 K+和pH值方差分析结果
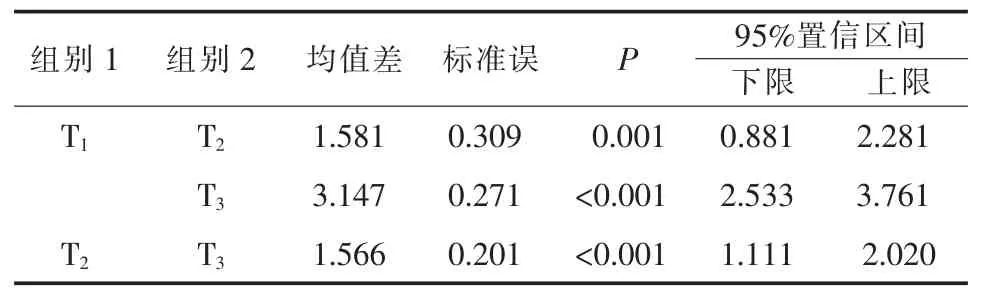
表5 不同检测时间之间LSD多重比较结果

表6 各组pH值
3 讨论
血液储存时间延长可使血液红细胞内Na+含量升高和K+离子含量降低,导致细胞变形能力减低及渗透脆性增加,在保存期延长致红细胞生存条件变化及代谢废物产生、部分保存红细胞寿命缩短及损伤增加等因素影响下发生红细胞破裂溶血[4-6]。
丙氨酰谷氨酰胺在血液中可迅速分解为丙氨酸和谷氨酰胺 (Glutamine,Gln),Gln作为体内天然存在的非必需氨基酸,在机体营养代谢、免疫保护、炎症调节及机体免疫机能增强等方面具有重要作用[7,8],可提高血浆中谷胱甘肽水平及机体抗氧化水平,减少和对抗自由基对机体组织器官的损伤,并可短时间对红细胞膜Na+K+-ATP酶活性产生显著性影响[9,10]。
此次实验数据结果表明,保存期内实验组血液保存液采集血液对储存红细胞具有保护作用,可短时间维持及改善红细胞内外环境,调整细胞内、外K+和Na+平衡,增加红细胞膜流动性及对机械压抗性[9];pH值测定中各检测时间之间pH值差异具有统计学意义(P<0.05),采集后10 d检测pH值显著高于35 d时测量值,表明保存期内因储存红细胞生存条件变化及酸性代谢产物产生,使pH值逐步降低,而检测组间pH值存在显著性差异(P<0.05),表明试验组血液保存液采集血液对储存血液酸碱平衡产生显著影响,可减少和对抗自由基损伤,改善红细胞生存条件及代谢环境。
综上所述,添加丙氨酰谷氨酰胺血液保存液对储存血液电解质及酸碱平衡具有显著性影响,可改善红细胞生存条件及代谢环境,提高储存血液质量及输注效果,具有提高受血者输注后免疫功能和血红蛋白含量、降低危重病患者感染率等作用。
[1]李明辉,林荣路.血液不同时间及温度保存对红细胞功能的影响[J]. 中国误诊学杂志,2011,11(29):7229-7230.
[2]袁志军.大量输血前后血清钾的变化和输血后高钾血症发生的影响因素[J]. 中国实用医药,2014,9(15):79-80.
[3]冯双利,卓海龙,陈民才,等.影响库存血运氧能力的指标分析[J]. 临床输血与检验,2011,13(1):1-4.
[4]刘海波.游离血红蛋白指标在悬浮红细胞质量控制中的应用[J].国际检验医学杂志,2012,33(21):2639,2667.
[5]张驰,张洪为,李代渝.库血红细胞变形性的实验研究[J].中国医学创新,2013,10(25):13-14.
[6]王九兵,王永维.红细胞悬液辐照前后在不同贮存期游离血红蛋白含量的比较[J]. 医学理论与实践,2012,25(14):1756-1758.
[7]陈小贺,孟文格,刘永存,等.丙胺酰谷氨酰胺对外科危重症患者免疫功能的提高作用[J]. 中国药业,2013,22(10):53-54.
[8]曹建伟,耿明飞,朱东山,等.谷氨酰胺联合肠道微生态制剂对食管癌患者术后体液免疫的影响[J].河南医学研究,2015,24(3):31-33.
[9]郭永军,孔媛媛,关永东,等.外源性补充谷氨酰胺对危重病患者的影响[J]. 中华全科医学,2012,10(1):49,97.
[10]李大鹏,李震,王刚,等.添加丙氨酰谷氨酰胺血液保存液对储存血液红细胞膜的影响[J]. 临床输血与检验,2015,17(1):49-51.
[2017-09-22 收稿,2017-10-20 修回]
