特发性肠系膜静脉硬化性肠炎1例
2018-04-20刘学竞侯东明
刘学竞,侯东明,杨 斌
(1.杭州市第一人民医院放射科,浙江 杭州 310006;2.浙江大学医学院附属第二医院放射科,浙江 杭州 310009)
病例男,60岁。20天前出现阵发性下腹部隐痛、腹泻,每天3~4次,量中等,无黏液脓血。9天前出现高热,体温39.4°,伴畏寒寒战,表现为间歇热。既往患者饮酒40余年,五加皮酒、杨梅酒,每日半斤。体格检查:无特殊面容,腹部未见异常。实验室检查:粪常规+隐血:阳性,血常规:红细胞3.91×1012L-1,血红蛋白 116g/L,血小板 209×109L-1,白细胞 5.4×109L-1,中性粒细胞百分比72.3%。
小肠CT检查:平扫示升结肠、肝曲、横结肠肠壁水肿增厚,肠壁周围见点状、线状钙化灶(图1,2)。重建图像示肠系膜静脉末端直小血管聚集增多,并见钙化(图3,4)。增强后肠壁呈分层样强化,肠壁周围系膜增厚(图5,6)。
肠镜检查及活检病理:升结肠、肝曲、横结肠肠壁糜烂、充血,黏膜色泽偏青黑色,静脉网色泽较深。印象:结合病史静脉硬化性结肠炎考虑。升结肠、肝曲、横结肠取活检:黏膜慢性炎,表面黏膜糜烂(图7)。肠壁内见血管壁及周围纤维化,部分钙化。
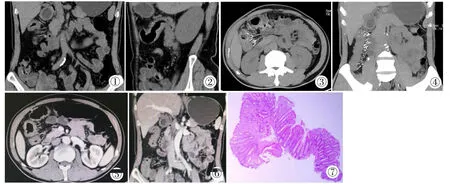
图1 CT平扫冠状位可见结肠肝曲周围肠系膜静脉点状、线状钙化。 图2 CT平扫矢状位可见结肠肠壁增厚,肠系膜静脉点状钙化。 图3,4 CT重建图像可见肠系膜静脉末端直小血管聚集增多,并见钙化。 图5,6 CT增强示肠壁分层样强化,周围系膜增厚。 图7 结肠活检病理:黏膜慢性炎,伴较多淋巴细胞、嗜酸性粒细胞浸润,表面黏膜糜烂。
讨论 特发性肠系膜静脉硬化性肠炎(IMP)是缺血性结肠炎的罕见原因。本病好发于中老年,以往报道女性发病率高,但近期朱碧莲等[1]报道9例病例中有8例男性。本例患者也为男性。近年亚洲报道的IMP例数明显高于欧美国家,多数有中草药服用史,尤其与中草药酒密切相关[2]。本例患者有40余年的中草药酒饮用史。这可能与中草药、乙醇或某些毒素及生化制剂等长期滞留在右半结肠,回流吸收到静脉引起静脉损伤、硬化有关[3]。
IMP临床表现以腹痛、腹泻为主,可伴有恶心呕吐、粪便潜血试验阳性等非特异性症状。部分患者出现不全性肠梗阻征象,因此对本病的早期诊断意义重大,以免患者反复因肠梗阻就诊但未能明确病因。IMP病理改变为结肠壁静脉硬化闭塞,肠系膜长期慢性充血,因此通常受累区域为右半结肠。肠系膜静脉硬化合并钙化是造成本病的主要原因,而CT平扫检查对显示肠壁边缘特征性的点状、线状钙化具有优势。IMP患者受累结肠范围常较广泛,结肠壁出现广泛增厚、水肿,CT增强扫描可见肠壁较均匀强化,并出现肠壁分层状强化,肠壁周围系膜增厚,部分患者可出现肠系膜反应性淋巴结增生。结肠镜检查示黏膜充血水肿、呈暗紫色,有时亦可见不规则小溃疡。内镜下活检有助于临床诊断和治疗方案的制定,组织学表现为静脉壁纤维化增厚伴钙化,黏膜中血管周围胶原沉积。但由于非特异性溃疡的存在,取材受限,因此综合典型影像学表现以及内镜病理结果,有助于临床早期确诊。
IMP的鉴别要点:①主要需与动脉粥样硬化引起的缺血性肠病相鉴别,动脉粥样硬化通常累及肠系膜动脉较大的分支,钙化一般呈斑片状,较粗大;②门脉高压,可结合临床及影像学检查相鉴别;③慢性血吸虫肠病,其常累及直肠及乙状结肠,且多为全结肠钙化,钙化范围较广泛,形态较厚,多呈线状、轨道状,一般不伴肠系膜静脉的钙化。④胶原性结肠炎,IMP不伴有静脉血栓和淀粉样蛋白沉积。而胶原性肠炎病理特点为胶原样颗粒呈带状沉积在结肠上皮细胞下方,且结肠炎症浸润较IMP更显著[4]。
综上所述,IMP发病率低,临床表现不典型,在日常临床工作中易漏诊、误诊。但IMP有特异性的影像学、内镜及病理改变,尤其CT检查具有特征性,应引起重视,可以辅助临床早期确诊。
