CT强化模式在甲状腺微小乳头状癌和微小结节性甲状腺肿鉴别诊断中的价值
2018-04-20韩志江赖旭峰
韩 晶,张 菁,韩志江,赖旭峰
(浙江省杭州市第一人民医院,浙江 杭州 310006)
在甲状腺微小结节的影像学检查中,虽然超声因具有高空间分辨率、高软组织分辨率及经济、无创伤、无辐射等优势而最为常用[1],但仍然有所不足,如对颈部中央组淋巴结转移及瘤体对甲状腺周围结构侵犯的评估受限,另外操作者的依赖性较强也是超声的较大不足[2],因此部分甲状腺微小乳头状癌(Papillary thyroid microcarcinoma,PTMC)的患者需要进行CT检查。目前CT在评价甲状腺微小结节时,多以结节的大小、形态、密度、钙化[3-4]、“咬饼征”、“蟹足征”及“镶嵌征”等参数或征象来评价结节的良、恶性[5-6],而强化模式往往被忽视,或仅为主观判断[7-8]。笔者认为结节的强化模式常能反映其内部组织学结构及血供情况,能在一定程度上对其性质进行判断,故我们对160枚PTMC和167枚微小结节性甲状腺肿(Micronodular goiter,MNG)进行分析研究,比较良、恶性结节平扫与增强后静脉期CT值的比值(Plane scan/enhanced scan,PS/ES)及增强与平扫CT值的差值(ΔCT值)在诊断甲状腺良恶性结节中的价值,为临床医生和影像科医生鉴别PTMC和MNG提供依据。
1 资料与方法
1.1 一般资料
收集杭州市第一人民医院2015年1月—2017年6月有完整临床及CT资料并经手术及病理证实的267例327枚甲状腺结节,包括143例154枚恶性结节(均为PTMC),118例158枚良性结节(均为MNG),6例良恶性结节并存患者,其中恶性结节6枚,良性结节9枚。143例恶性结节患者中,男33例,女 110 例,中位年龄 49(22~76)岁; 118 例良性结节患者中,男25例,女93例,中位年龄51(22~80)岁;6例良恶性结节并存患者中,男1例,女5例,中位年龄50(25~75)岁。所有病例均因颈部不适或体检发现甲状腺结节入院。
1.2 检查方法
扫描采用美国GE公司的lightspeed 16层螺旋CT扫描仪,扫描参数:120 kV,250 mA,准直宽度0.625 mm×8, 螺距 0.875,机架旋转时间 0.5 s,重建厚度3.75 mm。射线剂量报告:射线剂量长度乘积为 473.6~558.0 mGy·cm/人。 患者仰卧位,扫描范围从口咽部至锁骨上缘,对胸骨后甲状腺病例,扫描至气管分叉水平。层厚3.75 mm,层距3.75 mm。对比剂为德国Bayer公司的碘普罗胺注射液80 mL(优维显,300 mgI/mL),高压注射器经肘部静脉团注,速率2~3 mL/s,注射后50 s进行静脉期扫描。CT检查与手术平均间隔 8(0~16)天。
1.3 图像分析方法
由1名工作6年和1名工作15年的放射科医师在PACS工作终端对符合纳入标准的病例共同阅片,确定结节平扫和增强的感兴趣区(Region of interest,ROI)的位置,平扫和增强取相同的层面测量,在病灶最大层面勾画ROI,ROI的大小取决于病变大小且尽量与病灶边缘保持一致,并避开病灶中的囊变、钙化[9-10],排除有锁骨伪影干扰和合并桥本氏甲状腺炎的结节。
1.4 统计学方法
采用SPSS 19.0分析软件,计量资料包括PTMC及MNG的PS/ES、ΔCT值,数据符合正态分布,采用非配对t检验进行组间比较,对结节PS/ES、ΔCT值及两者联合应用在鉴别诊断良、恶性结节中的价值进行分析,P<0.001为差异具有统计学意义。计数资料包括PTMC的结节数量和MNG的结节数量,计算结节PS/ES、ΔCT值及两者联合应用在良、恶性结节诊断中的敏感度和特异度。
2 结果
143例共160枚PTMC中,单发126例126枚,多发17例34枚,左侧77枚,右侧83枚,直径0.5~1.0 cm,平均(0.8±0.2)cm;124例共 167枚 MNG 中,单发98例98枚,多发26例69枚,左侧86枚,右侧81 枚,直径 0.5~1.0 cm,平均(0.8±0.2)cm,两组结节的大小无统计学差异(t=1.732,df=325,P>0.05)。
160枚PTMC及167枚MNG中,结节的PS/ES、ΔCT值及两者联合在良、恶性结节中的分布情况见表1。统计学分析显示,PTMC组和MNG组的数据均符合正态分布,采用非配对t检验对两组数据进行组间比较,两组数据的PS/ES(t=10.35,df=319.346,P<0.001)和 ΔCT 值(t=10.242,df=322.712,P<0.001)均具有统计学差异,即较小的PS/ES值和较大的ΔCT值有助于PTMC的诊断 (图1),较大的PS/ES值和较小的ΔCT值有助于MNG的诊断(图2)。
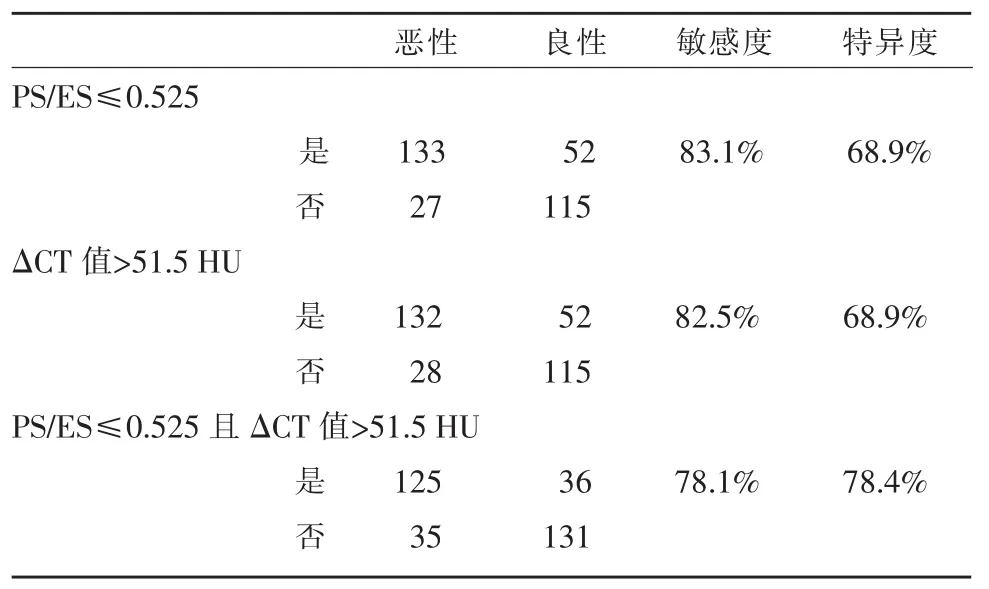
表1 结节的PS/ES、ΔCT值及两者联合在良、恶性结节中的分布
PS/ES和ΔCT值在良、恶性结节鉴别诊断中ROC曲线下面积为分别为0.799和0.808(图3),当PS/ES=0.525和ΔCT值=51.5 HU时,约登指数最大,分别为为0.520和0.514,此时诊断PTMC的敏感度和特异度分别为 83.1%(133/160)和 82.5%(132/160)、68.9%(115/167)和 68.9%(115/167)。当同时具备 PS/ES≤0.525 且 ΔCT 值>51.5 HU 诊断 PTMC 的敏感度和特异度分别为 78.1%(125/160) 和 78.4%(131/167)。

图1 甲状腺左侧叶上极PTMC。 图1a:平扫CT值为33 HU;图1b:增强后CT值为142 HU,PS/ES=0.232,ΔCT值=109 HU。 图2 甲状腺右侧叶上极MNG。 图2a:平扫CT值为83 HU;图2b:增强后 CT值为 99HU,PS/ES=0.838,ΔCT值=16 HU。Figure 1.Left upper pole of thyroid PTMC.Figure 1a:Plane scan CT value is 33 HU.Figure 1b:Enhanced scan CT value is 142 HU,PS/ES=0.232,ΔCT value=109 HU. Figure 2.Right upper pole of thyroid MNG.Figure 2a:Plane scan CT value is 83 HU.Figure 2b:Enhanced scan CT value is 99 HU,PS/ES=0.838,ΔCT value=16 HU.
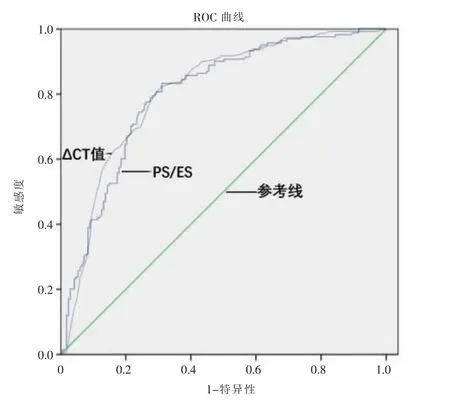
图3 PS/ES和ΔCT值诊断PTMC的ROC曲线。Figure 3. ROC curves of PS/ES and ΔCT values for diagnosis of PTMC.
3 讨论
甲状腺结节的CT强化模式与其内组织学结构存在密切关系:正常甲状腺由中等大小的滤泡构成,滤泡间为毛细血管床,增强后显著强化;MNG以大滤泡、纤维、胶质沉积、坏死、胆固醇结晶沉着及玻璃样变性等成分为主,这些成分占据了大量的毛细血管床,因此强化程度较低;而PTMC内虽含有较多纤维成分,但大滤泡、胶质和坏死等成分较MNG少,所占据的毛细血管床相应较少,强化程度较MNG明显,但仍低于或等于周围正常甲状腺组织[11]。在目前甲状腺结节强化程度的判断方法中,多以主观裸眼判断为主[12-14],可想而知,不同观察者之间会存在较大的判断差异,因此,如何量化PTMC和MNG之间的强化差异是影像科医生面临的重要课题。
在量化PTMC和MNG之间的强化差异上,目前国内外普遍采用的方法是根据ΔCT值的大小来判断结节的强化程度,进而对其病理性质进行判断,但是不同医院注射后扫描增强期的延迟时间不同,如注射后40 s和50 s扫描,ΔCT值显然存在一定差异。本组资料均为注射对比剂后50 s扫描,与国内的《甲状腺结节影像检查流程专家共识》推荐的时间相一致[15],本组数据显示,160枚PTMC和167枚MNG的 ΔCT值具有统计学差异,ΔCT值>51.5 HU 时,提示PTMC的诊断,此时的敏感度和特异度分为82.5%和 68.9%;除了 ΔCT 值外,我们发现结节平扫与增强CT值的比值可能对其性质有一定的提示作用,本组数据也的确支持了我们的观点,两组数据间的PS/ES具有统计学差异,当PS/ES≤0.525时,诊断PTMC的敏感度和特异度分别为83.1%和68.9%。显然,PS/ES≤0.525 与 ΔCT 值>51.5 HU 对 PTMC 的诊断效能相似,二者虽然具有较高的敏感度,但特异度均较低,均不宜单独用于PTMC的诊断。
当 PS/ES≤0.525 与 ΔCT 值>51.5 HU 联合时,即同时具备二者,虽然诊断PTMC的敏感度稍有降低,为78.1%,但特异度得到显著的提高,为 78.4%,显然, 与 PS/ES≤0.525 或 ΔCT 值>51.5 HU 单独应用比较,二者联合后对PTMC的诊断效能更理想。
本文不足之处:桥本氏甲状腺炎多引起甲状腺密度及强化程度减低,从而影响ΔCT值和PS/ES的判断,故本研究方法不适于合并桥本氏甲状腺炎患者;本组资料为回顾性分析,且病例均来自同一医疗单位,可能存在难以避免的选择偏倚。
总之,PS/ES≤0.525 和 ΔCT 值>51.5 HU 均是诊断PTMC的重要参数,二者联合可以进一步提高诊断特异度,从而减少误诊的发生。
