艾滋病痴呆综合征患者HIV-1 Vpr基因多态性及氨基酸序列分析
2018-04-17李昕张维嘉郑文慧曹馨月单晓宇郑雯黄涛温红玲王志玉赵丽
李昕 张维嘉 郑文慧 曹馨月 单晓宇 郑雯 黄涛 温红玲 王志玉 赵丽
250012 济南,山东大学公共卫生学院卫生微生物学检验系(李昕、张维嘉、郑文慧、曹馨月、 单晓宇、郑雯、温红玲、王志玉、赵丽);250014 济南,山东省疾病预防控制中心艾滋病防治所(黄涛)
艾滋病痴呆综合征(AIDS dementia complex,ADC)是HIV-1感染机体后侵犯神经系统引起的神经系统功能障碍,是AIDS严重的并发症之一,以意识、行为及运动异常为主要表现[1],目前其发病机制尚不清楚。随着HIV的有效控制,艾滋病患者的寿命延长,AIDS开始向慢性疾病转变,ADC成为了新的难题[2]。因此,研究ADC的发生及发展,寻找ADC的致病机制可为疾病防治提供新思路。HIV-1是一种高度变异的病毒,Vpr作为HIV-1的辅助蛋白之一,在HIV-1 复制过程中执行着多种生物学功能,如影响疾病进程、诱导细胞G2期阻滞及细胞凋亡、调节HIV-1逆转录过程中的保真性降低碱基错配、促进前整合物入核、影响HIV-1基因表达等[3-6],这对HIV-1的致病性具有重要意义。为了研究HIV-1 Vpr基因在ADC患者中枢神经系统(central nervous system,CNS)及外周的变异及其导致的氨基酸位点的改变,本研究对1例ADC病例尸检标本外周和CNS 8个部位的HIV-1 Vpr基因多态性进行了研究,为探索ADC的发病机理奠定基础。
1 材料与方法
1.1临床标本1例ADC患者,男,31岁,基因组DNA由加州大学旧金山分校Mike教授惠赠,包括外周的脾(spleen, SPL)、淋巴结(lymphnode, LN)、肝(liver, LIV);CNS的脑膜(meninges, MG)、基底核(basal ganglia,BG)、额叶白质(white matter from frontal cortex, WM)、额叶灰质(grey matter from frontal cortex, FC)、颞叶皮质(temporal cortex, TC),患者死亡前曾接受高效抗逆转录病毒治疗(highly active antiretroviral therapy, HAART)。
1.2主要试剂及仪器ExTaq聚合酶、10×ExTaq buffer、dNTP均为宝生物工程(大连)有限公司产品。DNA凝胶回收试剂盒以及质粒小提试剂盒均为OMEGA公司产品。pMD19-T为本室保存。引物由上海生工生物工程有限公司合成,具体序列如下:外侧引物,F: 5’-TCCTCTGGAAAGGTGAAGGGG-3’,R:5’-CTTCCTGCCATAGGAGATGCCTAAG-3’;内侧引物,F:5’-GGATCCCAGAGGATAGATGGAACAAGCCCC-3’,R:5’-CTCGAGGCTGACTTCCCGGATGATTC-3’。
1.3HIV-1vpr基因扩增、克隆及序列测定以基因组DNA为模板,进行第一轮PCR扩增,PCR体系:ExTaq 0.25 μl、10×ExTaq buffer 5.0 μl、dNTP 4.0 μl、模板DNA 1.0 μl、上下游引物各0.8 μl、补水至50 μl。反应条件: 95 ℃ 5 min、95 ℃ 30 s、55 ℃ 30s、72 ℃ 1.5 min(30个循环)、72 ℃ 10 min。以第一轮扩增产物为模板进行第二轮PCR扩增,反应条件: 95 ℃ 5 min,95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s(30个循环)、72 ℃ 10 min。PCR产物经1.2%琼脂糖凝胶电泳分离后回收所需片段,并分别与pMD19-T载体连接,次日将连接产物分别转化DH-5α大肠埃希菌感受态细胞,37 ℃培养12~16 h后,挑取5个白色菌落送博尚生物技术有限公司测序鉴定。
1.4序列分析运用BLAST进行序列比对、MEGA6绘制系统进化树并计算基因距离,使用美国Los Alamos国家实验室HIV核酸序列库在线软件SNAP进行同义/非同义替换值(ds/dn)的计算并对氨基酸关键位点进行分析。
1.5统计学方法所有数据均经SAS 9.1处理。
2 结果
2.1HIV-1Vpr基因扩增、克隆及序列测定PCR扩增可见在分子量约350 bp的附近有一条带,与预计片断大小相符。经测序确定为HIV-1Vpr序列。
2.2HIV-1Vpr系统进化树分析来自HIV-1 ADC脑病患者CNS及外周Vpr基因序列与标准序列HXB2比对结果及系统进化树见图2。该患者体内HIV-1 Vpr序列均属HIV-1 B 亚型,分离自CNS和外周不同部位的HIV-1 Vpr基因序列在系统进化树中交叉在一起,且相同来源不同部位的Vpr基因序列也存在交叉。
2.3HIV-1Vpr基因距离分析ADC患者8组不同来源共40个Vpr基因序列的组间基因距离,见表1。外周不同组织来源的Vpr基因距离为0.015±0.007、CNS不同组织来源的Vpr基因距离为0.044±0.034。外周各部位Vpr与HXB2的基因距离为0.095±0.009、CNS各部位Vpr与HXB2的基因距离为0.079±0.0153,差异无统计学意义(P>0.05)。可见,相同组织来源的Vpr序列基因距离较小,外周和CNS与Vpr基因序列差异无统计学意义。
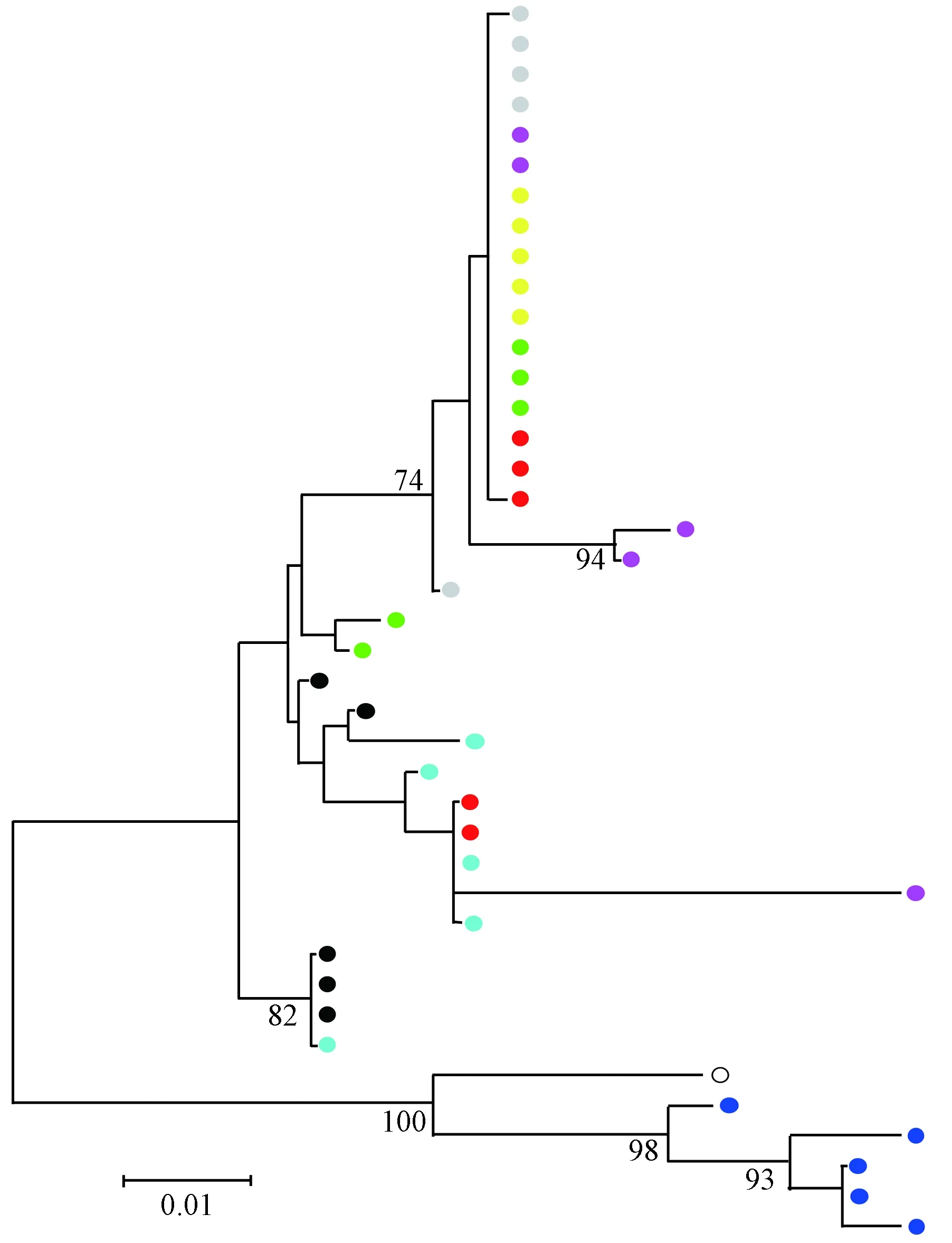
系统进化树成比例绘制,下面的标尺代表每个位置有0.01核苷酸发生替换;树枝上的数值代表bootstrap值,当<70%时,数值不显示。○HXB2;●淋巴结;●脾脏;●额叶灰质;●颞叶皮质;●脑膜;●基底核;●额叶白质;●肝脏图2 ADC患者HIV-1 Vpr序列系统进化树Branch lengths are drawn to scale, with the bar at the bottom indicating 0.01 nucleotide substitution per site. The number along a branch represents bootstrap value and the value is hided if it’s <70%. ○HXB2;●lymph node;●spleen;●grey matter from frontal cortex;●temporal cortex;●meninges;●basal ganglia;●white matter from frontal cortex;●liverFig.2 Phylogenetic tree of HIV-1 Vpr gene of ADC patients
2.4HIV-1Vpr基因序列ds/dn分析所有HIV-1 Vpr基因序列的ds/dn=3.3749,外周的HIV-1 Vpr基因序列的ds/dn=3.3080,CNS的HIV-1 Vpr基因序列的ds/dn=3.7871。ADC HIV-1外周和CNS的Vpr基因序列ds/dn均大于1,表明均受到负向选择压力。
2.5HIV-1Vpr氨基酸位点的分析与标准序列相比,ADC病例Vpr区的氨基酸位点改变见表2。由表2可见,部分氨基酸位点在中枢和外周都发生了变异:D7N、D7E、Q11P、H15Y、T19 A、N28S、I37 V、R36 M、R36I、G41 N、H45Y、A55T、L67 M、R77Q、R77H、V83I、T84I、A89T、A89R;部分氨基酸位点的变异只发生在CNS某些部位:E58Q,R85P;部分变异只发生在外周:G9R、L42S、E48 K、G61 K、G75R。研究表明,ADC患者体内HIV-1Vpr基因序列的变异已经引起了氨基酸位点的改变,并且外周和中枢的氨基酸位点变异有所不同。 HIV-1 Vpr各功能区氨基酸位点分析结果见图3。
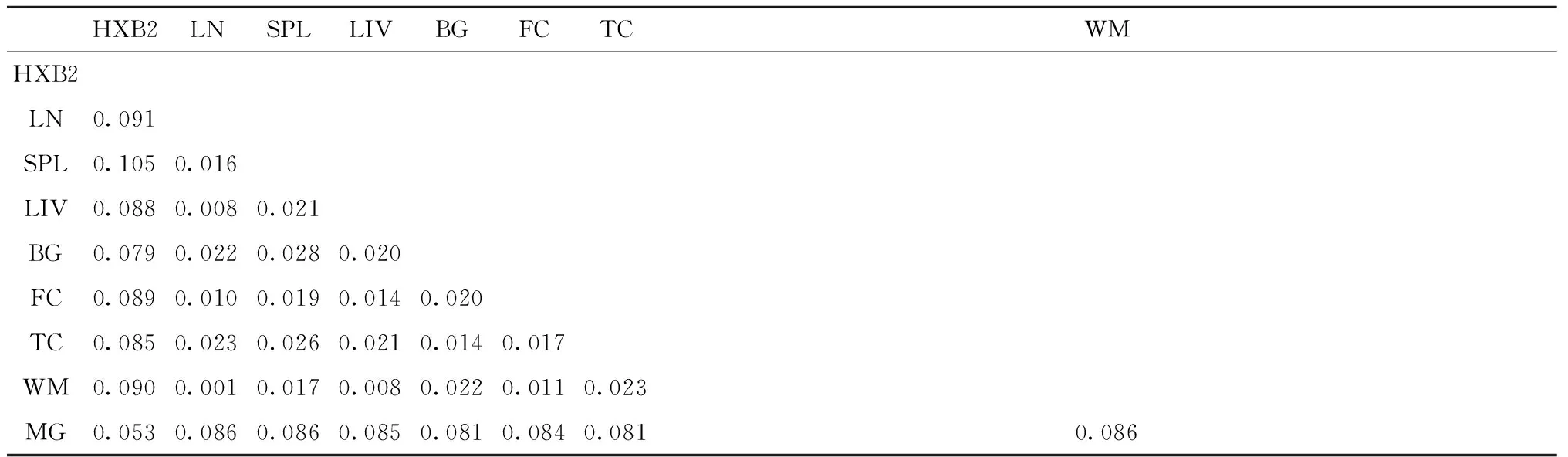
表1 ADC病例8个部位HIV-1Vpr基因的组间距离
注:LN:淋巴结; SPL:脾脏; LIV:肝脏; BG:基底核; FC:额叶灰质; TC:颞叶皮质; WM:额叶白质; MG:脑膜
Note:LN:lymph node; SPL:spleen; LIV:liver; BG:basal ganglia; FC:grey matter from frontal cortex; TC:temporal cortex; WM:white matter from frontal cortex; MG:meninges
3 讨论
HIV-1在感染早期其借助感染的单核细胞跨过血脑屏障进入CNS,并以这些细胞作为储存库复制病毒,由于其逆转录酶缺乏校正活性,RNA不能正确转录,碱基极易发生突变,使HIV-1具有高度变异的特性,此外基因重组也是病毒进化的一种重要机制,是导致其多态性不断增加的重要原因,新的重组病毒以其传播优势成为流行重组形式[7- 8],且随着CNS疾病的发展,HIV-1的基因变异性逐渐提高[9]。为探讨HIV-1 vpr基因在CNS及外周的多样性及这种多样性与ADC之间的关系,本研究克隆了1例ADC患者CNS及外周各部位来源的Vpr基因,并对其序列进行分析。
HIV-1分型呈现一定的地区及人群差异,在非

表2 HIV-1 Vpr氨基酸位点改变频率
注:*代表5个序列中有5个发生了该氨基酸位点的变异,其他数据类推;— 代表氨基酸位点没有发生变异;LN:淋巴结; SPL:脾脏; LIV:肝; BG:基底核; FC:额叶灰质; TC:颞叶皮质; WM:额叶白质; MG:脑膜
Note:*Represents five of the five HIV Tat sequence changed at this site, other data analogize by the same mennings—no change at this site. LN: lymph note; SPL:splean.LIV:liver;BG:basal ganglia;FC:grey matter from frontal cortex;TC:tamporal cortex;WM:white matter from frontal cortex;MG:meninges
洲中部几乎所有HIV-1亚型均有报道,欧洲东部及中亚地区以A、B亚型为主,在北美、加勒比海地区、拉丁美洲、西欧、中欧、澳大利亚以B亚型为主,在中国HIV-1以CRF01_AE、CRFBC、B’为主,其中CRF01_AE亚型感染者疾病进展快,以性传播为主要途径,但不同亚型对抗病毒治疗效果无影响[10-12]。本研究中ADC患者为美国人,CNS及外周共40个Vpr核酸序列均属于HIV-1 B亚型。Salemi等[13]在对1例ADC患者不同组织的gp120基因研究中发现,HIV-1在进化时会受到区室化作用影响,其基因在进化过程中会随解剖学途径或脑脊液流动发生迁移。本研究在对HIV-1 Vpr基因的系统进化树研究中发现,ADC患者CNS和外周的Vpr基因序列在系统进化树中相互交叉,表明HIV-1 Vpr基因在变异过程中受区室化作用影响小,这可能是由于Vpr基因较gp120更为保守,且本研究只对1例ADC患者进行分析研究。此外,CNS及外周不同部位来源的Vpr基因序列也存在交叉,说明不论CNS及外周,不同部位的Vpr基因的变异也不同。
在ADC不同部位Vpr序列间基因距离的分析中发现,虽然基因距离间差异无统计学意义,但是从数值上看,同为外周或同为CNS的Vpr序列间基因距离小,而外周和CNS间基因距离大,且外周比中枢变异更大。可见除病毒自身变异外,CNS及外周的环境对病毒的变异也具有一定的作用。
HIV-1在进化中可受到自身变异及环境选择双重作用,本研究ADC患者ds/dn均大于1,说明在外周HIV-1 Vpr基因进化时受负向选择压力,病毒的自身变异起主要作用,同时机体清除有害的非同义突变,是净化选择的结果。
Vpr含有3 个两亲性的α螺旋(17~33, 38~50, 55~77 aa),这三个α螺旋环绕一个疏水核心,使Vpr 和各种细胞蛋白能相互作用,C端73~96富含精氨酸,这与Vpr 的转导性质及跨细胞膜脂双层的能力有关,72~83 aa为致线粒体毒性区域[14-15],本研究中R77Q,R77H,V83I,T84I,A89T,A89R,R85P位点发生突变,可影响到其转导、跨膜及降低线粒体降低通透性,这可能与ADC的发病相关。17~60 aa 与Vpr 核运输能力有关,本研究中T19 A,N28S,I37 V,R36 M,R36I,G41 N,H45Y,A55T,E58Q,L42S,E48 K的改变可能会影响其核运输能力。84~96 aa 及R77 是Vpr影响细胞G2期阻滞的关键性氨基酸,本研究中R77Q,R77H,A89T,A89R,R85P位点的突变可能会影响到细胞周期的改变。
本文研究了1例ADC患者HIV-1 Vpr基因多态性及其引起的氨基酸位点的改变,这些氨基酸位点的变异对Vpr蛋白的生物活性的影响,以及在ADC的发病过程中的作用仍需进一步研究。
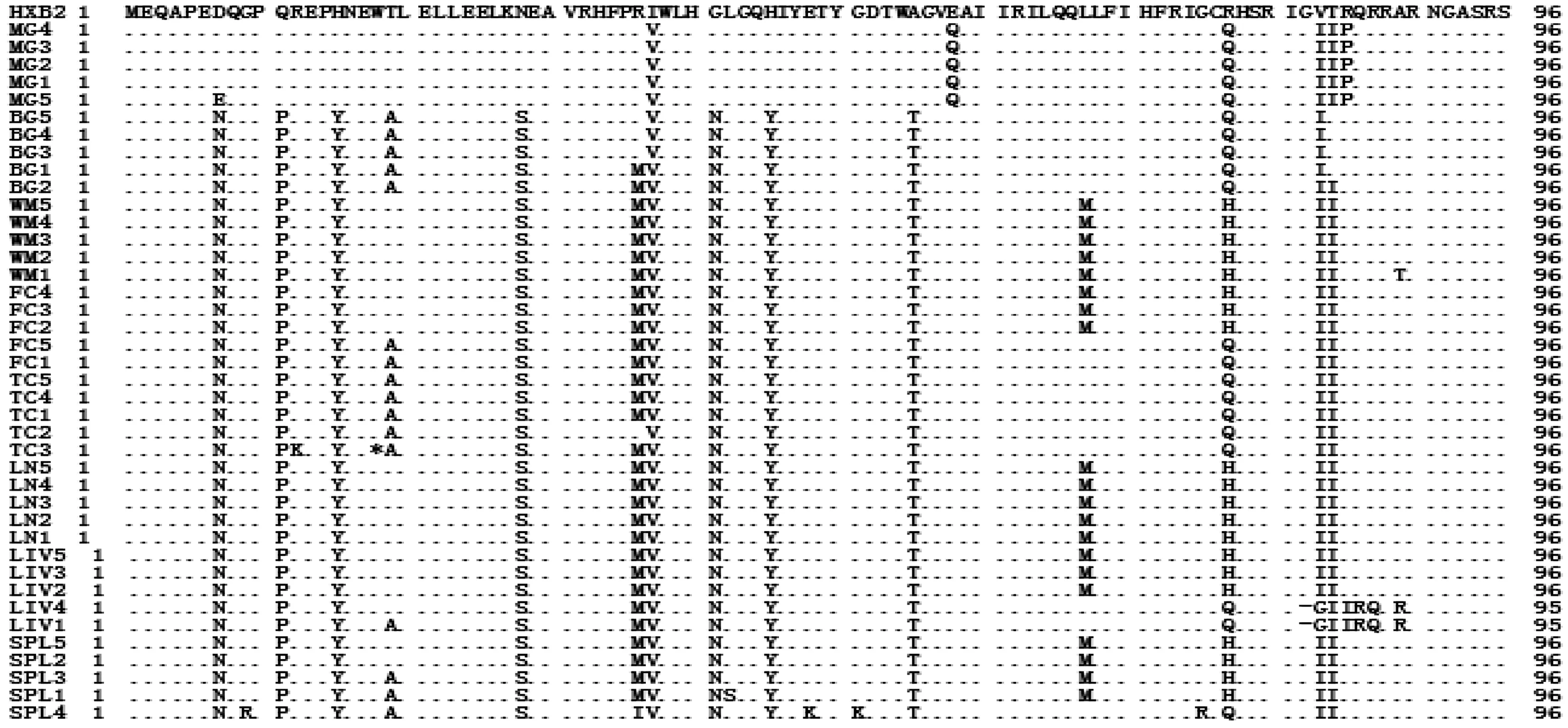
LN:淋巴结; SPL:脾脏; LIV:肝; BG:基底核; FC:额叶灰质; TC:颞叶皮质; WM:额叶白质; MG:脑膜图3 ADC病例8个部位组织的HIV-1 Vpr氨基酸序列比对结果LN:lymph node; SPL:spleen MG:LIV:liver; BG:basal ganglia; FC:grey matter from frontal cortex; TC:temporal cortex; WM:white matter from frontal cortex;MG:meningesFig.3 Amino acid sequence of HIV-1 Vpr extracted from eight different tissues of the ADC patient
利益冲突无
[1]Price RW, Brew B, Sidtis J, et al. The brain in AIDS-central nervous-system HIV-1infection and AIDS dementia complex[J]. Science, 1988, 239(4840): 586-592. DOI: 10.1126/science.3277272.
[2]Shah MR, Cook N, Wong R, et al. Stimulating high impact HIV-related cardiovascular research recommendations from a multidisciplinary NHLBI Working Group on HIV-related heart, lung, and blood disease[J]. J Am Coll Cardiol, 2015, 65(7): 738-744. DOI: 10.1016/j.jacc.2014.12.014.
[3]Hoshino S, Konishi M, Mori M, et al. HIV-1 Vpr induces TLR4/MyD88-mediated IL-6 production and reactivates viral production from latency[J]. J Leukoc Biol Suppl, 2010, 87(6): 1133-1143. DOI: 10.1189/jlb.0809547.
[4]赵建元, 丁寄葳, 米泽云, 等. HIV-1初始传播病毒Vpr基因遗传变异对诱导G_2期阻滞及细胞凋亡的影响[J]. 遗传, 2015, (5): 480-486. DOI:10.16288/j.yczz.15-004.
[5]刘瑞康, 高杨, 林永权, 等. RelB对HIV-1 Vpr转录激活及诱导细胞G2/M期停滞功能影响的初步研究[J]. 病毒学报, 2013,29(1): 44-50. DOI:10.13242/j.cnki.bingduxuebao.002350.
[6]James T, Nonnemacher MR, Wigdahl B, et al. Defining the roles for Vpr in HIV-1-associated neuropathogenesis[J]. J Neurovirol, 2016, 22(4): 403-415. DOI: 10.1007/s13365-016-0436-5.
[7]陶艳琳, 赵雪涛, 汤宇帆, 等. 2000-2012年中国HIV基因亚型时空分布的系统综述[J]. 中华疾病控制杂志, 2013, 17(12): 1073-1082.
[8]赵翠英, 邢辉, 赵宏儒, 等. 河北省HIV-1流行株的env基因序列测定和亚型分析[J]. 中华微生物学和免疫学杂志, 2005, 25(7): 533-535.DOI:10.3760/cma.j.jssn0254-5101.2005.07.003.
[9]van Marle G, Power C. Human immunodeficiency virus type 1 genetic diversity in the nervous system: evolutionary epiphenomenon or disease determinant?[J]. J Neurovirol, 2005, 11(2): 107-128. DOI: 10.1080/13550280590922838.
[10]曹颖. HIV-1感染者Vpr基因多态性及其临床意义研究[D]. 北京协和医学院, 2013.
[11]孙定勇, 刘佳, 许巍, 等. 河南省302例新确证HIV感染者和艾滋病患者中HIV毒株基因亚型分布和原发耐药研究[J].中华预防医学杂志, 2016,50(8):733-737. DOI:10.3760/cma.j.issn.0253-9624.2016.08.012.
[12]王洪, 梁冰玉, 周波, 等.2010-2012年广西壮族自治区HIV-1流行株pol基因亚型的分布情况[J].中华预防医学杂志, 2016,50(1):79-84. DOI:10.3760/cma.j.issn.0253-9624.2016.01.014.
[13]Salemi M, Lamers S L, Yu S, et al. Phylodynamic analysis of human immunodeficiency virus type 1 in distinct brain compartments provides a model for the neuropathogenesis of AIDS[J]. J Virol, 2005, 79(17): 11343-11352. DOI: 10.1128/JVI.79.17.11343-11352.2005.
[14]Guenzel CA, Herate C, Benichou S. HIV-1 Vpr-a still “enigmatic multitasker”[J]. Front Microbiol, 2014, 5: 13. DOI: 10.3389/fmicb.2014.00127.
[15]Lum JJ, Cohen OJ, Nie ZL, et al. Vpr R77Q is associated with long-term nonprogressive HIV infection and impaired induction of apoptosis[J]. J Clin Invest, 2003, 111(10): 1547-1554. DOI: 10.1172/JCI200316233.
