羊瘙痒因子感染小鼠脑组织中MicroRNA-375对PDK1蛋白表达调控研究
2018-04-17石强张丽娜王晶高晨
石强 张丽娜 王晶 高晨
102206 北京,中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验室
朊病毒病(prion disease)是一种具有感染性,能够引起人类和动物中枢神经系统退行性改变的疾病,又被称之为传播性海绵样脑病(transmissible spongiform encephalopathies, TSEs)。它是体内基因编码的正常朊蛋白(PrPC)构象发生改变,形成致病的朊病毒(PrPSc)在神经组织内聚集沉积引起的[1]。
PrPC蛋白具有多种水解方式,其中PrPC的α切割被认为具有保护机体的作用[2-3]。3’磷酸肌醇依赖的激酶1(3’-phosphoinositide-dependent kinase 1, PDK1)是一种丝氨酸/苏氨酸蛋白激酶,PDK1活性增加可以促进肿瘤坏死因子转化酶(TACE)的内吞作用,降低α-切割活性,从而促进疾病的进展[4]。目前在肿瘤学上的一些实验结果表明micro RNA-375(miR-375)能够与PDK1的3’-UTR上的靶点结合,从而调控PDK1在细胞内的表达和活性[5-7],而miR-375在朊病毒病中对PDK1的调节作用尚未见文献报道。本研究对羊瘙痒因子139 A感染的小鼠脑组织中miR-375与PDK1的含量变化进行了测定,并通过pmiR-REPORT报道质粒系统检测了miR-375对PDK1 3’UTR的靶点的调控功能,从而来探究二者在朊病毒病发生发展过程中的关系。
1 材料与方法
1.1材料Trizol购自 Invitrogen 公司; miRcute miRNA cDNA 第一链合成试剂盒为 TIANGEN公司产品; miRcute miRNA荧光定量检测试剂盒(SYBR Green)购自TIANGEN公司。SDS-PAGE 凝胶制备试剂盒购自北京康为世纪生物科技有限公司; 硝酸纤维素膜(NC)0.4 μm购自 Millipore 公司; 脱脂奶粉(Skim Milk Powder) 购自 BD公司; 蛋白酶 K(proteinase K)购自Merck 公司; 吐温-20、甘氨酸、十二烷基硫酸钠(Sodium Dodecyl Sulfate,SDS)、三羟甲基氨基甲烷 (Tris) 均购自Amresco公司; Triton-X100 购自Solarbio公司; PDK1抗体购自 Sigma 公司; 正常山羊血清封闭液、抗体稀释液、DAB 显色液购自武汉博士德生物工程有限公司; 抗淬灭荧光封片剂购自碧云天生物技术公司; 其他试剂为国产分析纯化学试剂。
1.2总RNA的提取及qRT-PCR采用RNeasy mini kit 提取试剂盒(德国Qiagen),提取139 A毒株感染终末期及正常C57小鼠脑组织中的总RNA,具体操作严格按照说明书进行。提取后的总RNA利用miRcute 增强型miRNA cDNA 第一链合成试剂盒,通过两步法特异性的将总RNA中的miRNA 进行转录合成cDNA。利用miRcute miRNA荧光定量检测试剂盒(SYBR Green)检测cDNA中miRNA-375的含量。miR-375特异性引物及内参U48由亚太恒信生物科技有限公司提供,反应体系为20 μl,包括2×miRcute miRNA Premix(SYBR&ROX)10 μl,正向引物 2 μl,反向引物2 μl,miRNA第一链cDNA稀释10倍后加2 μl,RNase-Free ddH2O 4 μl。同时设立三个复孔。实验过程中所用试剂都应置于冰上。PCR反应程序设定:94 ℃变性2 min;94 ℃循环中变性20 s,60 ℃退火、延伸34 s,共45个循环。
1.3二代测序及生物信息学分析构建cDNA文库后借助Solexa/Illumina 平台进行深度测序(华大基因公司)。过程简介如下:5 μg的总RNA样品进行SDS电泳,根据泳动位置的不同,回收miRNA(18-24nt)。然后应用T4 RNA连接酶在miRNA的5′-和3′-端连接接头,并进行反转录。反转录的产物进行PCR,反应条件为:98 ℃ 30 s,98 ℃ 10 s 15个循环,72 ℃ 15 s,72℃10 min,扩增产物进行下一步的测序。具体可参见文献[8]。
1.4免疫印迹法分别取139 A感染的C57小鼠脑组织和正常C57小鼠脑组织,用适量裂解液重悬制备成10%(W/V)脑组织匀浆。取10 μl脑匀浆加入2.5 μl 5×的上样缓冲液,混合均匀后于100 ℃水浴10 min。待样品室温后,离心进行上样。进行常规SDS-PAGE电泳,电泳结束后半干法转膜;10%脱脂奶粉室温封闭2 h, 1×TBST充分洗膜。然后PDK1小鼠一抗(1∶5 000)和β-actin(1∶5 000)抗体4 ℃孵育过夜;次日,1×TBST充分洗膜,辣根过氧化物酶标记兔抗小鼠二抗室温孵育1.5 h,充分洗膜后,暗室中进行ECL显影。
1.5免疫组织化学将正常小鼠及139 A感染小鼠终末期的脑组织进行组织固定、脱水和石蜡包埋并用切片机制成厚度为5 μm连续切片。晾干后进行脱蜡和抗原微波修复,用3% H2O2室温作用10 min,以阻断内源性过氧化物酶。滴加0.3% Triton-X 100室温作用20 min做切片通透,正常山羊血清封闭后,滴加兔抗小鼠PDK1抗体并置于湿盒,4 ℃过夜。次日切片37 ℃复温后加入生物素标记的二抗,室温避光30 min后加入DAB显色,用苏木素复染1 min,常规脱水后加封片剂显微镜观察并用 OLYMPUS DP Controller 软件拍摄照片。
1.6利用荧光报道质粒PmiR-REPORT对miR-375靶点PDK1 3’UTR 的检测

图1 139A感染小鼠脑组织中PDK1蛋白的Western blot检测Fig.1 Detection of PDK1 in 139 A infected mice brain by Western blot
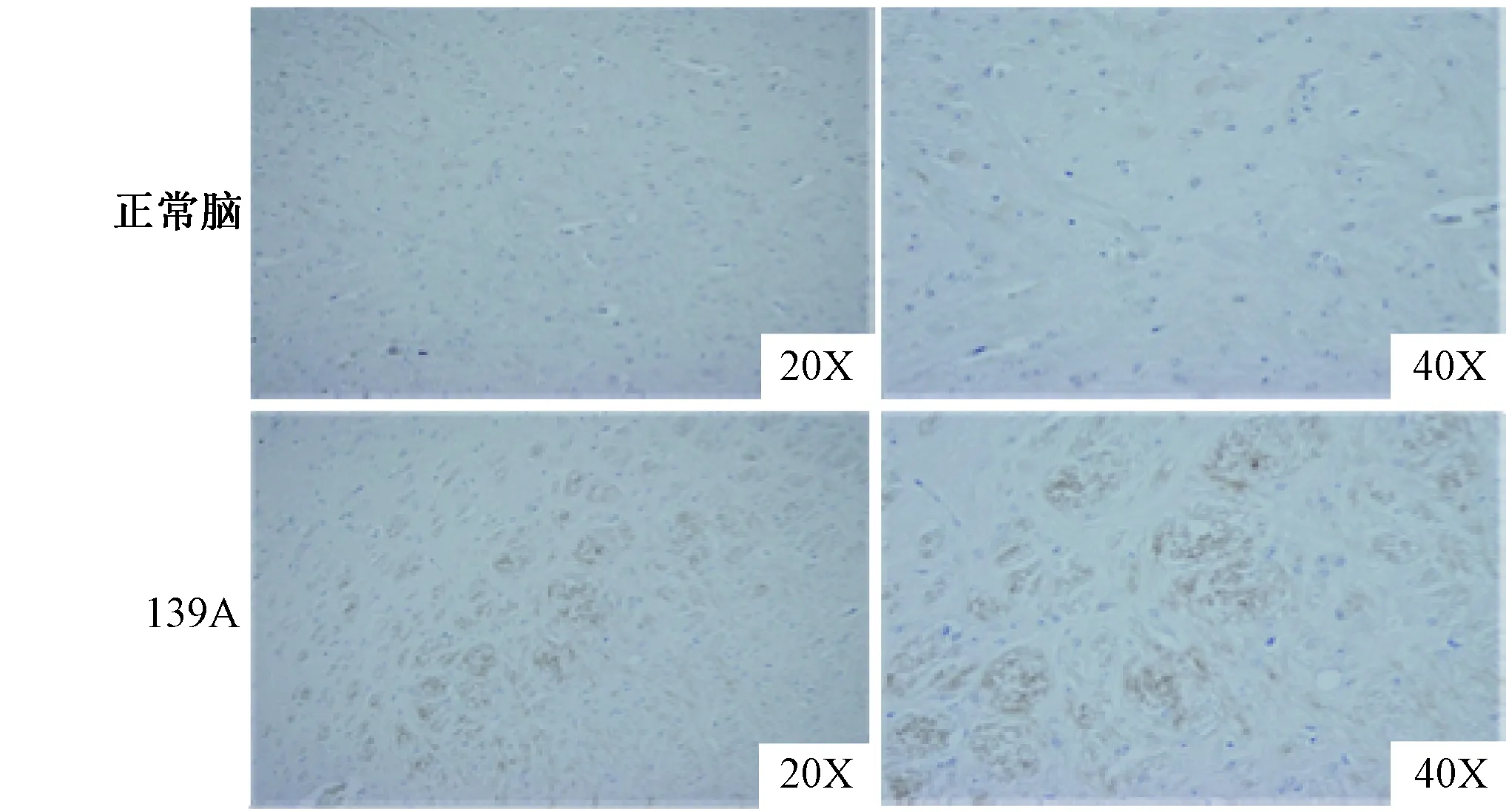
图2 免疫组织化学法检测139 A感染小鼠脑组织中的PDK1蛋白Fig.2 Detection of PDK1 in 139 A infected mice brain by immunohistochemistry
1.6.1质粒的构建报告基因表达载体制备: 根据人PDK1基因序列信息,使用TargetScan 软件预测PDK1基因3’UTR 与miR-375 可能存在的结合位点,结合位点5’-GAACAA-3’ 位于PDK1基因3’UTR 区的第273-279位。设计合成互补碱基序列,5’-ACCCAACCACACAAAGAACAAAA-3’ 和5’-TTTTGTTCTTTGTG TGGTTGGGT-3’。2条单链经退火后形成双链DNA并克隆至荧光素酶报告基因表达载体 pmiR-REPORT (Ambion,美国) 构建成野生型报告基因表达载体pmiR-WT-375。阴性对照序列为5’-ACCCAACCACACCCCTCCTGGGG-3’; 5’-CCCCAGGAGGGGTGTGGT TGGGT-3’。构建含有错义突变结合位点的pmiR-MT-375。重组载体经过序列分析后进行无内毒素质粒DNA制备。
1.6.2细胞培养及转染: 复苏人神经母细胞瘤细胞,用含10%胎牛血清的DMEM 培养基培养,接种适当数量细胞于96孔板, 37 ℃二氧化碳恒温培养箱培养48~72 h,待细胞融合70%后进行转染。阴性对照为空 pmiR-REPORT 真核表达载体。将真核表达质粒pmiR-WT-375和pmiR-MT-375分别和pCMV-β-gal、合成的miR-375 mimic和miR-375 inhibitor共同感染SH-SY5Y细胞系。质粒每孔0.4 μg,RNA mimic 和inhibitor 分别为20pmol。转染过程按照转染试Lipofectamine 2000 说明书进行。每组设置3个复孔。转染后48 h后使用荧光素酶检测仪检测荧光素酶含量。β-gal活性用ONPG试剂进行检测,具体方法见文献[9]。
2 结果
2.1蛋白免疫印迹检测脑组织中的PDK1羊瘙痒因子139 A感染的小鼠脑组织中Western blot显示,感染小鼠脑组织中PDK1的含量相对于正常对照组明显增高(图1)。 将Western blot结果进行灰度值扫描分析,139 A感染组PDK1含量相对于对照组升高6倍左右,具有统计学差异(图1)。结果提示,感染139 A小鼠终末期脑组织中PDK1的含量增加。
2.2免疫组织化学检测脑组织中的PDK1为了进一步探究PDK1在139 A感染小鼠脑组织中的变化情况,制备了139 A感染小鼠终末期脑组织(皮质区)切片。并进行PDK1特异性免疫学组织化学实验。结果显示,与正常的小鼠脑组织切片相比, 139 A感染小鼠脑组织中大量的PDK1特异性棕色斑点散在存在,而在正常脑组织中只存在少量的棕色斑点(图2)。结果提示139 A感染的小鼠脑组织切片中PDK1的含量较对照组明显增高,与免疫印迹结果相吻合。
2.3体外qRT-PCR及二代测序检测脑组织中miR-375含量有研究对scrapie感染的N2a细胞模型进行了miRNA表达谱的比较,发现miR-375在感染细胞中相对于正常细胞明显降低[10]。为了探究miR-375在感染羊瘙痒因子139 A的小鼠脑组织中含量的变化。本研究利用二代测序和体外qRT-PCR的方法分别对脑组织中miR-375的含量进行了检测。如图3所示,二代测序结果发现朊病毒感染模型139 A脑组织中的miR-375的含量明显降低。以U6作为内参进行体外qRT-PCR,结果同样显示139 A脑组织中miR-375的含量降低,且均具有统计学意义。
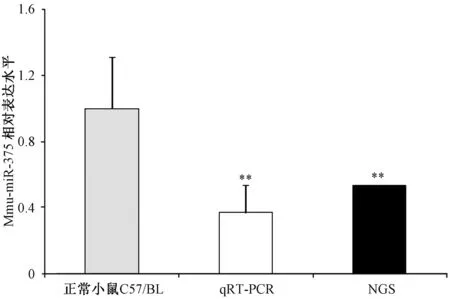
图3 二代测序与体外qRT-PCR检测miR-375的差异表达Fig.3 RT-qPCR and NGS detection of miR-375 in 139 A infected mice brain
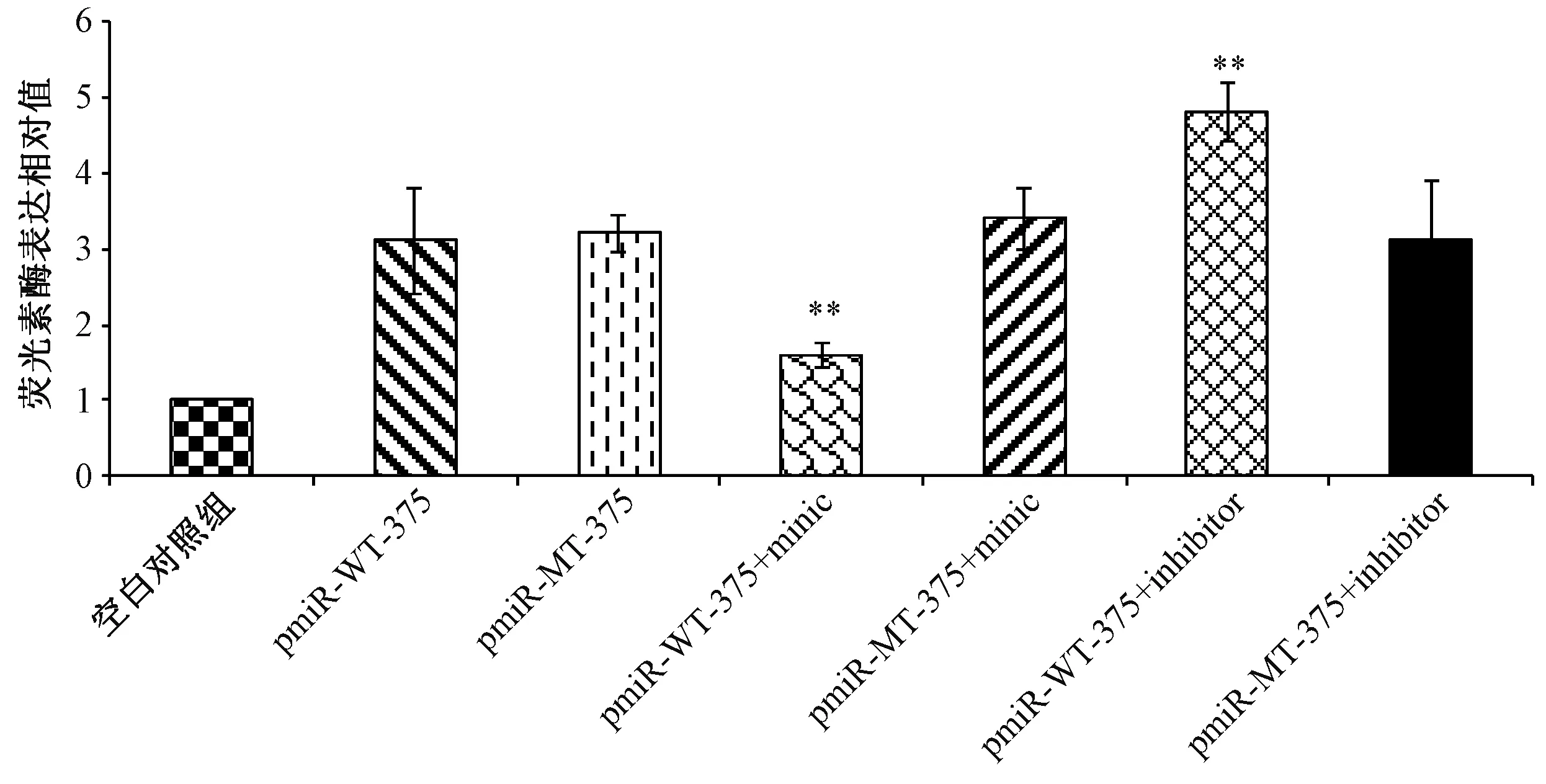
图4 miR-375类似物及抑制物对PDK1 3’UTR的靶点的调控Fig.4 Regulation of miR-375 mimics and inhibitors on targets of PDK1 3’UTR
2.4PmiR-REPORT报道质粒系统检测miR-375对PDK13’UTR的靶点的调控功能有研究表明miR-375能够与PDK1的3’-UTR上的靶点结合,从而调控PDK1在细胞内的表达和活性,在对miR-375的作用靶点蛋白的生物信息学分析中,发现PDK1是其作用靶标之一,而PDK1正是影响着α-内切酶-TACE活性的重要因子之一[4]。为了探究miR-375在朊病毒感染小鼠中与PDK1的关系本研究利用pmiR-report报道质粒系统对miR-375的调控功能进行了检测。
从图4中可以观察到,仅转染带有PDK1的3’-UTR的野生型(pmiR-WT-375)和突变型(pmiR-MT-375)的实验组,荧光素酶的表达量基本相似。当野生型实验组中加入miR-375的类似物时,荧光素酶的含量明显降低,而当加入抑制物时,荧光素酶含量明显增加,与之形成对比的突变型实验组的荧光酶活性不受类似物和抑制物的影响,可推断出PDK1的3’-UTR受到miR-375的调控。
3 讨论
朊病毒病是一种致死率高达100%的神经退行性疾病,严重影响着人类的健康,虽然科学家进行了不懈的努力,但其致病机制并不十分清楚,目前临床上也没有行之有效的治疗方法。因此,克-雅病疾病进展中,针对PrPCα切割及其内切酶变化的一些分子标记物的研究,不仅可以有助于了解朊病毒的致病机制,而且有助于疾病的诊断,甚至是早期诊断。而以提高PrPCα内切酶活性,以促进PrP蛋白α切割为靶点的治疗策略也是一个充满了希望的新的治疗方向[11]。
miRNA作为一种不编码蛋白质,但是在基因的表达调控过程中发挥着非常重要作用的非编码RNA,其在脑组织中高度保守,并且含量十分丰富,提示它在脑组织的生理和病理功能中有重要的调节作用[12-14],近年来关于miRNA和神经退行性疾病之间的关系也越来越成为研究的热点。在AD患者的海马区发现有异常miRNA的增加[15];患者脑组织的芯片分析也显示即使在早期的AD患者中,miR-107也有明显的下调;BACE1酶是切割淀粉样前体蛋白APP产生阿尔茨海默病病理特征Aβ的主要成分,而研究表明,编码BACE1酶的mRNA水平的调控受miR-107影响[16]。同时June[17]研究小组也发现高水平miR-7会导致α-synuclein的增加。亨廷顿病(Huntington disease,HD)中一些miRNA的表达影响着与疾病相关基因的转录和翻译[18]。这些研究结果不断地提示本研究在朊病毒感染的过程中miRNA扮演着非常重要的角色,如果能发现朊病毒感染过程中的异常miRNA,并找出miRNA调节的下游蛋白,这将对朊病毒致病机制的研究起到很大的帮助作用。
本实验通过建立朊病毒139 A感染小鼠的动物模型,发现小鼠感染羊瘙痒因子139 A后脑组织中miR-375表达下调,且脑组织中的PDK1蛋白含量明显增多。通过pmiR-REPORT报道质粒系统检测发现miR-375具有对PDK1 3’UTR靶点的调控功能。本研究结果提示PDK1 3’UTR是miR-375的一个调控靶点。在朊病毒病的发生发展过程中miR-375发生下调,可能对PDK1 3’UTR这一靶点的调控作用下降,使得脑组织中PDK1的含量升高。而PDK1活性的增加可以抑制α-切割活性,从而影响了PrP蛋白的正常水解过程,从而促进了疾病的进展。这为探讨朊病毒病致病机制提供了新的线索,为朊病毒病的治疗甚至是诊断方面可以提供新的理论依据。
利益冲突无
[1]Whitechurch BC, Welton JM, Collins SJ, et al. Prion diseases [J]. Adv Neurobiol. 2017,15:335-364. DOI: 10.1007/978-3-319-57193-5_13.
[2]Saftig P, Lichtenthaler SF. The alpha secretase ADAM10: A metalloprotease with multiple functions in the brain [J]. Prog Neurobiol. 2015,135:1-20. DOI:10.1016/j. pneurobio. 2015.10.003.
[3]Altmeppen HC, Prox J, Krasemann S, et al. The sheddase ADAM10 is a potent modulator of prion disease [J]. Elife. 2015 5;4. DOI: 10.7554/eLife.04260.
[4]Pietri M1, Dakowski C, Hannaoui S, et al. PDK1 decreases TACE-mediated α-secretase activity and promotes disease progression in prion and Alzheimer’s diseases [J]. Nat Med. 2013,19(9):1124-1131. DOI: 10.1038/nm.3302.
[5]Tsukamoto Y, Nakada C, Noguchi T, et al. MicroRNA-375 is downregulated in gastric carcinomas and regulates cell survival by targeting PDK1 and 14-3-3zeta [J]. Cancer Res, 2010,70(6):2339-2349. DOI: 10.1158/0008-5472.CAN-09-2777.
[6]El Ouaamari A, Baroukh N, Martens GA, et al. miR-375 targets 3’-phosphoinositide- dependent protein kinase-1 and regulates glucose-induced biological responses in pancreatic beta-cells [J]. Diabetes, 2008,57(10):2708-2717. DOI: 10.2337/db07-1614.
[7]Zhou J, Song S, He S, et al. MicroRNA-375 targets PDK1 in pancreatic carcinoma and suppresses cell growth through the Akt signaling pathway [J]. Int J Mol Med, 2014,33(4):950-956. DOI: 10.3892/ijmm.2014.1638.
[8]Gao C, Wei J, Zhang BY, et al. MiRNA expression profiles in the brains of mice infected with scrapie agents 139A, ME7 and S15 [J]. Emerg Microbes Infect, 2016, 5(11): e115. DOI:10.1038/emi. 2016.120.
[9]高晨,雷艳君, 姜慧英, 等. 人乳头瘤病毒2(HPV2)E2蛋白不同功能区突变对转录抑制作用影响的研究 [J]. 中华实验和临床病毒学杂志,2011,25(3): 164-166. DOI: 10.3760/cma.j.issn.1003-9279.2011.03.002.
[10]Montag J, Hitt R, Opitz L, et al. Upregulation of miRNA hsa-miR-342-3p in experimental and idiopathic prion disease [J]. Mol Neurodegener, 2009,4:36. DOI: 10.1186/1750-1326-4-36.
[11]Béland M, Roucou X. Taking advantage of physiological proteolytic processing of the prion protein for a therapeutic perspective in prion and Alzheimer’s diseases [J]. Prion, 2014,8(1):106-110. DOI:10.4161/pri.27438.
[12]Schratt G. Fine-tuning neural gene expression with microRNAs [J]. Curr Opin Neurobiol, 2009,19(2):213-219. DOI: 10.1016/j.conb.2009.05.015.
[13]Saugstad JA. MicroRNAs as effectors of brain function with roles in ischemia and injury, neuroprotection, and neurodegeneration [J]. J Cereb Blood Flow MeTab, 2010,30(9):1564-1576. DOI: 10.1038/jcbfm.2010.101.
[14]Provost P. MicroRNAs as a molecular basis for mental retardation, Alzheimer’s and prion diseases [J]. Brain Res, 2010,1338:58-66. DOI:10.1016/j.brainres.2010.03.069.
[15]Lukiw WJ. Micro-RNA speciation in fetal, adult and Alzheimer’s disease hippocampus [J]. Neuroreport, 2007,18(3):297-300. DOI: 10.1097/WNR.0b013e3280148e8b.
[16]Wang WX, Rajeev BW, Stromberg AJ, et al. The expression of microRNA miR-107 decreases early in Alzheimer’s disease and may accelerate disease progression through regulation of beta-site amyloid precursor protein-cleaving enzyme [J]. J Neurosci, 2008,28(5):1213-1223. DOI:10.1523/JNEUROSCI.5065-07.2008.
[17]Junn E, Lee KW, Jeong BS, et al. Repression of alpha-synuclein expression and toxicity by microRNA-7 [J]. Proc Natl Acad Sci USA, 2009,106(31):13052-13057. DOI: 10.1073/pnas. 0906277106.
[18]Johnson R, Zuccato C, Belyaev ND, et al. A microRNA-based gene dysregulation pathway in Huntington’s disease [J]. Neurobiol Dis, 2008,29(3):438-445. DOI:10.1016/j.nbd.2007.11.001.
