发酵食品中氨基甲酸乙酯形成机理和快速检测方法研究进展
2018-04-11唐冰娥徐振林孙远明
周 凯,唐冰娥,徐振林,刘 占,孙远明,陈 穗
(1. 华南农业大学 食品学院 广东省食品质量安全重点实验室,广东 广州 510642;2. 广东美味鲜调味食品有限公司,广东 中山 528000)
氨基甲酸乙酯(EC),又称尿烷,在水和醇类溶剂中溶解性良好,化学工业上有多种用途[1],还曾经用于麻醉[2]和肿瘤治疗[3]。然而,自从1943年EC被发现具有潜在的致癌性开始[4],众多有关其危害的研究陆续展开,在1974年EC被国际癌症研究机构(IARC)列为2B级致癌物(人类可能致癌物)。此后,有证据显示EC能够直接导致人类产生肝癌[5],在2007年,EC致癌等级被提升至2A级。从食品中摄入的EC,除了大部分被水解和少部分直接排出之外,其致癌性主要由EC被线粒体中的细胞色素P450通过N-羟基化和侧链氧化形成N-羟基-氨基甲酸乙酯和乙烯基-氨基甲酸乙酯导致的。2005年,联合国粮农组织和世界卫生组织下的食品添加剂联合专家委员会(JECFA)对EC摄入进行安全评估,认为日常饮食中摄入的EC为15 ng/(kg·bw·d),低于基准摄入量下限0.3 mg/(kg·bw·d),但该评估结果不包括酒精饮料,因此评估风险较低。但Schlatte等[6]认为,假定人一生患癌风险为10-6,摄入EC含量在20~80 ng/(kg·bw·d)是安全的,以此计算,人类暴露EC中风险依然较高,尤其是在饮酒人群中[7-8]。目前,针对食品中EC的研究主要集中在致癌风险、含量检测、形成原因和控制方法4个方面(图1)。
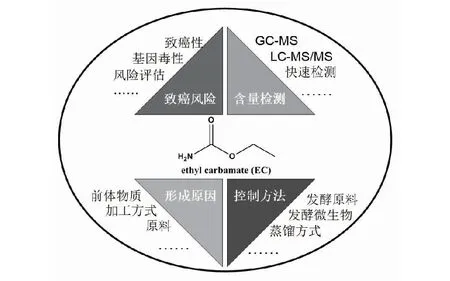
图1 发酵食品中EC的主要研究内容Fig.1 Recent researches on EC in fermentation foods
1 发酵食品中EC含量
EC是发酵食品生产过程中自发产生的一种有害物,在酒类、酱油、豆瓣酱和泡菜等发酵酒类和食品中均有检出[9-11],甚至在一些面包和香烟中也有检出[12]。表1为近年来国内外报道的一些发酵食品中EC的污染情况。从表1中可以看出,除了啤酒以外,酒类中EC含量普遍高于其他发酵食品,国内黄酒和米酒中EC含量要显著高于其他酒类。而在其他国家,蒸馏酒和烈酒中EC含量更高。参考世界各国对酒中EC标准限量的最严格值(葡萄酒15 μg/L,白兰地1 000 μg/L,蒸馏酒150 μg/L,烈酒60 μg/L,清酒200 μg/L),依然有大量酒类中EC含量超标。此外,在非酒类食品中,酱油和红腐乳中EC含量要显著高于其他食品,鉴于部分亚洲国家生产和食用酱油量较大[13],酱油在某些人群中可能成为日常摄入EC的主要食物[14],值得关注。
2 发酵食品中EC主要形成原因和控制方法
目前针对发酵食品中EC的形成已经有了较为确定的描述,主要认为由乙醇和氨甲酰化合物发生醇解反应生成,发酵食品中的氨甲酰化合物主要有尿素、瓜氨酸、氨甲酰磷酸和焦碳酸二乙酯等。此外,氰化物经过发酵转变成氰酸也能与乙醇反应形成EC,而影响EC形成的环境因素主要有温度、催化剂、pH、光照和贮藏时间。由于焦碳酸二乙酯主要由外源添加,已有证据显示其与酒精能反应形成EC[15],目前在葡萄酒酿造过程中已基本不再使用。氨甲酰磷酸主要通过酵母中氨甲酰磷酸合酶和细菌精氨酸脱亚氨基途径产生,一般不被释放到细胞外,因此大多数情况下被忽略。
2.1 前体物质
乙醇是EC形成的主要前体物质之一,所有的氨甲酰化合物只有在乙醇存在下才能转化成EC。在大多数EC含量高的酒类中,酒精度数一般高于8%,有些能够达到60%甚至更高,因此,在这些发酵食品中,乙醇不再是EC形成的制约因素。而另一些发酵食品,如酱油、豆瓣酱和面包等,乙醇只是发酵副产物,一般含量在2%以下,而其他前体物质如瓜氨酸能达到2 000 mg/L、尿素约为50 mg/L,此时乙醇成为EC最重要的前体[15],在高盐稀态发酵酱油中,酒精与EC含量成显著正相关[27]。此外,在氨基甲酸乙酯的合成中也明确发现,乙醇和尿素的配比随着浓度的提高而增大,同时也逐渐变缓[28]。然而在发酵食品中,乙醇要么是酒类饮料的主要成分,要么对发酵食品风味有强烈影响,难以通过降低乙醇含量来达到降低EC的目的。
尿素是大部分发酵酒类中最主要的前体物质[29-30],也是被研究最为深入和透彻的影响因素之一。一定浓度的尿素和发酵产生的乙醇在偏酸性条件下反应生成EC,尿素主要来源于酿酒酵母的尿
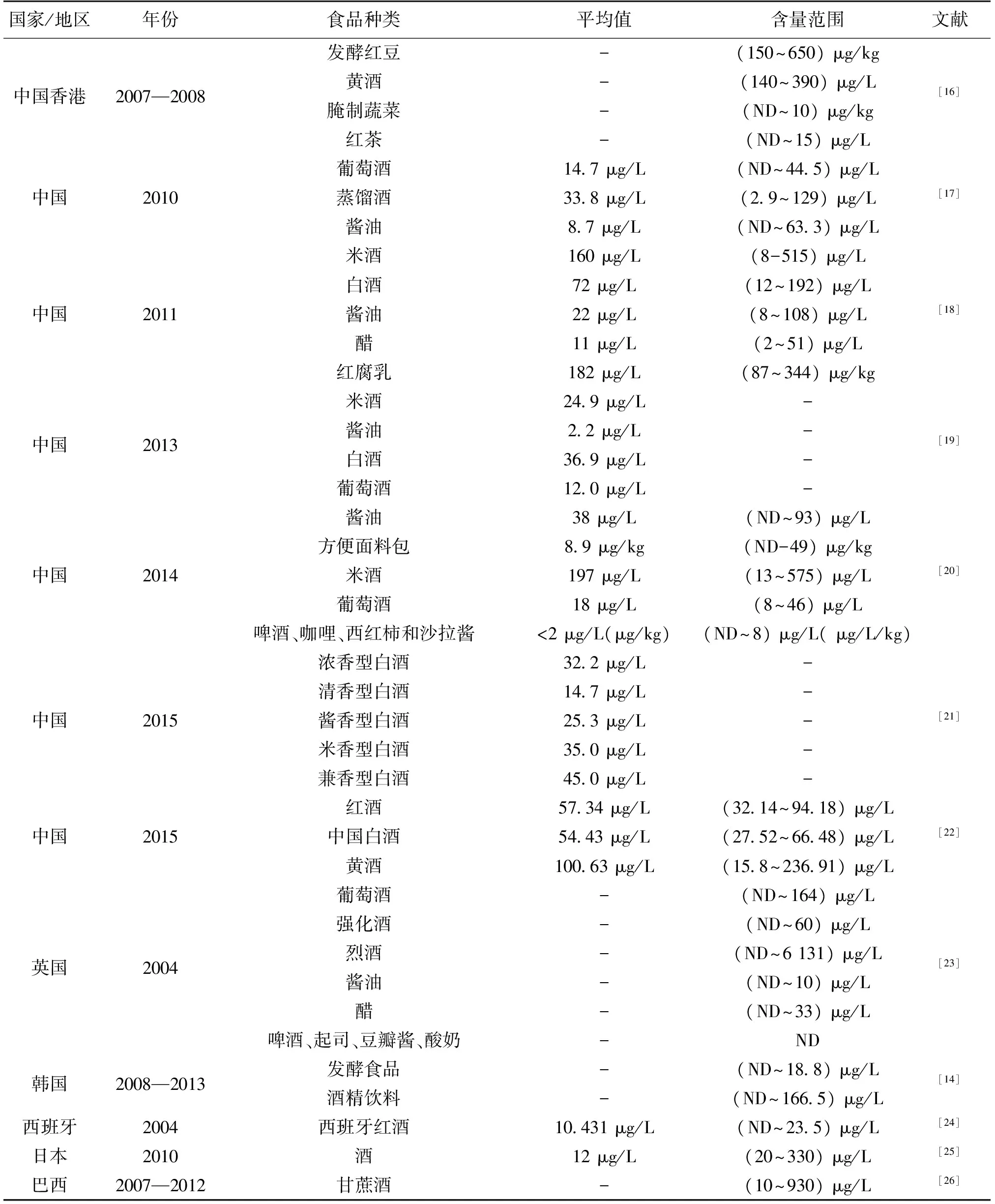
表1 各种发酵食品中氨基甲酸乙酯含量调查
注:“-”表示文献未涉及,“ND”表示含量在检测限以下。
素循环和原料,部分尿素在无偏好型氮源存在下被水解利用,但在氮阻遏效应调控下,尿素水解酶表达受到抑制,从而造成尿素的积累,通过主动运输释放到细胞外。降低尿素含量的方法主要有3种。①通过定向选育、诱变育种或杂交育种等方式筛选低产尿素的酿酒酵母[31-32]。②通过基因工程手段定向改造现有酿酒酵母,主要分为两类:一类是直接通过改造尿素代谢和运输相关基因来实现,如将编码精氨酸酶的CAR1基因敲除,从而切断精氨酸转化成鸟氨酸和尿素[33-35],但该方法容易造成原料精氨酸浪费,又或者过表达尿酰胺酶编码基因DUR1,2[36]和尿素运转蛋白编码基因DUR3[37],从而加速尿素分解或将环境中的尿素吸收,但两者共同实施并未显示协同效果[38](图2(a));另一类是通过代谢调控影响尿素代谢相关基因表达,此类调控因子较多,赵鑫悦[29]将磷酸化调控因子Gln3p和Gat1p共表达的基因工程菌株酿酒酵母N85应用于黄酒发酵,尿素含量降低了63%,且发酵特性变化很小。③直接向发酵液中添加酸性脲酶以降低尿素含量[9,39]。
瓜氨酸被证明是某些酒类[40-41]和酱油[27]的主要前体之一,发酵液中含量可达2 000 mg/L。瓜氨酸是一种非蛋白质氨基酸,发酵液中的乳酸菌能够通过精氨酸脱亚氨基途径(ADI)将精氨酸转变成瓜氨酸,并通过主动运输释放到环境中。有研究证实,环境因素(pH、盐胁迫等)是导致乳酸菌arcA和arcB转录水平不等比例下降、从而导致瓜氨酸积累的主要原因[42](图2(b)),而瓜氨酸的释放与菌株的细胞通透性变化紧密相关[30],然而细胞通透性变化导致的精氨酸和鸟氨酸的变化,这种区别并未给予充分说明。目前,筛选瓜氨酸利用菌株并接种至发酵液中是降低瓜氨酸含量最有效的方法,但对于如何干扰高产瓜氨酸的魏斯氏菌和葡萄球菌等积累瓜氨酸,并未过多探讨。

图2 两种代谢工程技术抑制尿素积累(a) [30] 和盐胁迫对乳酸片球菌ADI途径的调节(b)[15]Fig.2 Schematic diagram of two metabolic engineering technologies for eliminating urea(a) and proposed NaCl effect on ADI pathway regulations(b)
氰化物是果酒[43-44]和蒸馏酒[21]中最主要的前体物质,目前已经证实与酒精反应生成EC的氰化物主要是异氰酸,而且该反应速率常数与乙醇和氰化物浓度无关,随着温度的升高而增加,随着pH的升高而降低[44]。异氰酸主要由发酵原料中的生氰糖苷水解生成的氰酸异构化产生,受环境pH和温度影响最大。由于氰酸和EC沸点差异,在蒸馏过程中可通过“掐头去尾”的方式将大部分氰酸和生成的EC去除。
2.2 环境因素
温度几乎是所有前体物质反应形成EC最重要的影响因素。不同发酵温度[43]、灭菌温度[45]和蒸馏温度[21]均与EC含量成显著正相关,在预测EC生成模型中,需要区分不同的加工贮藏温度[46]。醇解反应需要在偏酸性pH条件下形成,但是由于同类食品中pH变化较小,故对EC形成影响较小,目前研究较少。值得注意的是,前体之一的氰化物形成需要经过水解等步骤转化才能与乙醇反应,这个过程中,氧气和金属离子催化剂对EC含量影响很大[47-48],尤其是Cu2+,与氰酸形成的中间体更容易与乙醇反应形成EC。因此,在氰酸为主要EC前体物质的果酒蒸馏酒中,选择合适的蒸馏器皿是降低EC的有效方法,而在尿素与乙醇反应中,ZnCl2的影响更大[28]。在食品发酵过程中,金属离子浓度变化不大[27],故对EC形成的影响有限。此外,某些抗氧化剂比如焦亚硫酸钾的添加能够降低EC含量,但实际效果有限[47],从化学反应角度来说,多羟基的酚类抗氧化剂能够与乙醇竞争发生醇解反应,从而降低EC含量。总的来说,降低加工温度、O2含量、金属离子催化剂以及适当的pH能够控制发酵食品中EC含量。直接添加EC降解酶[49]或者利用吸附材料[50]除去EC也是可取的方法,但是存在降解酶不耐酸和酒精、吸附材料对风味有影响且效率低等问题。
3 检测方法
由于发酵食品中EC含量较低且基质干扰较多,合适的检测方法对于评估和控制EC的污染水平十分必要。对于检测方法来说,灵敏度、可靠性和精密度需要严格考量,甚至在某些时候检测的经济性和操作的方便性也是选择的重要依据。
3.1 色谱检测
气相色谱质谱联用(GC-MS)是检测EC的主要方法,也是许多组织机构和政府部门设立的检测方法。使用d5-EC作为内标,样品经过处理后通过GC-MS测定在各种食品和不同实验室中均呈现良好的重复性和回收率[19,51],由于不同食品杂质干扰不同,导致前处理各异,不同样品之间检测限差异较大,基本在1~20 μg/L之间,回收率为90%~110%,相对标准偏差(RSD)低于15%(表2),可靠性良好。为了降低检测限,更好地排除基质干扰,分辨特征离子,三重串联四级杆质谱法(GC-MS/MS)能够更好地用于低含量EC的检测[20],液质联用(HPLC-MS/MS)方法能够大幅缩短检测所需时间并避开气相色谱需要严格限制水分的要求,检出限更低的同时,能够保证良好的稳定性,最低检测时间可在6 min之内,但对于不同检测对象,离子化方式(ESI和APCI)上选择不同[12,22]。Deák等[52]选择在检测之前用9-占吨醇将EC衍生,发现电离后更倾向于生成[M+Na]+,更容易定量且稳定性良好,但显著延长了前处理时间和检测时间。虽然基本上所有的色谱质谱联用检测技术都能够很好地分离EC并精确定量,然而对于大部分发酵食品生产的中小企业和基层检测单位来说,即使具备这些大型检测仪器也缺乏相应操作人才。而液相色谱的应用则非常普及,采用高效液相色谱结合荧光检测器(HPLC-FLD)检测EC,进样前在酸性条件下与9-占吨醇衍生,通过优化衍生条件、激发与发射波长、流动相在某些样品中检测限甚至能低于5 μg/kg。然而,这种方法还具有一些缺陷:首先对于酒精含量较高的酒类,乙醇会干扰衍生反应,甚至在衍生时进一步形成EC造成误差,因此需要对样品进行稀释,间接提高了定量限。其次,在一些颜色较深的发酵食品如腐乳和酱油中,衍生前需要添加一步除杂和富集的步骤,直接延长了每个样品的检测时间(目前至少需要60 min)[21]。此外,由于衍生剂9-占吨醇与EC的反应是一个酸性条件的可逆反应,衍生后到检测这段时间也会对结果有影响,衍生产物在230 nm激发波长下有两个显著的发射波长,308和600 nm,不同样品的干扰效应不同,需要确定不同的发射波长[27]。
目前,采用仪器方法检测EC的报道已经屡见不鲜,综述报道也不少[31,53],但是由于EC分子量太低且分子特征不显著,对EC的快速检测方法缺乏系统和深入的分析。目前即将出台的黄酒中EC限量、EC快速筛查方法的推广,前景广阔。
3.2 快速检测
3.2.1酶法
有机磷和一些带苯环或杂环氨基甲酸酯类农药能够抑制乙酰胆碱酯酶的水解作用,因此,目前常用酶抑制法对这一类物质进行快速检测。EC分子也具有氨基甲酸酯结构,但其分子特征不显著,对乙酰胆碱酯酶的抑制作用不明显,通过加入一些增敏试剂,如3%的溴水-NaOH溶液,能够显著提高EC的抑制作用,在缓冲溶液中对EC的检出限可低至41.77 μg/L[54]。酒类中乙醇本身对乙酰胆碱酯酶就具有强烈的抑制作用,采用溶剂萃取等前处理方法对酒中EC提取和净化,乙酸乙酯的残留也会抑制酶活,故不适用于EC的实际样品检测,但为此提供了一个思路:如果采用某种方式对EC分子进行改造,通过衍生的方法使得衍生产物能够增强对乙酰胆碱酯酶的抑制效果,能够大大提高检测灵敏度和精密性。
酶法检测目标分子的另一个思路是:采用水解酶将目标分子水解后,通过检测产物从而定量目标物,在与EC密切相关的精氨酸检测中有应用先例[55]。目前,国内外筛选出来的EC降解酶已经有数十种,部分降解酶对乙醇的耐受度可达20%,仍具有50%以上的酶活力[49],但是只有具备能够水解EC酰胺键生成NH3分子,且需要足够灵敏度的方法检测水解后的氨分子的量才能进行精确定量。卢晓霞[56]通过构建双酶体系的电化学传感器对模拟黄酒中EC进行检测,检测限低至5.26 nmol/L,精密度和稳定性良好(图3)。该方法只需在检测前构建传感器,并不需要对样品进行处理。不过目前电化学传感器还未广泛用于实际样品检测,且酶的特异性(对尿素和氨基甲酸酯的同系物也有部分降解作用)也有待深入探讨。

图3 双酶传感器检测EC的原理[56]Fig.3 Schematic illustration of EC determination
3.2.2薄层色谱法
薄层色谱法是一种不需要借助仪器手段可以对样品进行分离和定性甚至定量的色谱分析技术。主要步骤包括展开剂的选择、点样、展开、显色和分析,通常包括计算比移值(Rf)和确定斑点颜色深浅。目前由于成像系统的改善并引入先进的数字处理技术,对EC的检测限甚至能达到mg/L甚至是μg/L级别。Jaryj等[57]首先采用该方法分离烈酒中的EC,随后在酸性环境下使分离的EC与肉桂醛在高温下反应,测定荧光范围为445~460 nm,该方法定量范围为320 μg/L~8.1 mg/L。王浩[58]采用同样的方法,通过简化成像系统和优化分离条件运用于多种酒类检测中,但是该方法回收率过低、检测限过高,基本只能用于EC含量超过1 mg/L的酒类检测,且通过简单的氮吹浓缩后,由于糖类等黏性物质的存在,该方法不再适用,而通过前处理净化浓缩,也大大延长了检测时间。
3.2.3光谱法

3.2.4免疫检测法


图4 EC间接免疫检测方法示意图(a)[63]和基于荧光硅纳米颗粒的增敏方法原理图(b)[64]Fig.4 Schematic illustration of an indirection ELISA(a) and fluorescent silicon nanoparticles-based ratiometric fluorescence immunoassay(b) for EC sensitive detection
目前,几乎所有的EC快速检测方法均存在干扰因素较多、检测限过高、稳定性较低的特点,尚未应用于实际检测,而仪器分析方法也需要排除各种干扰因素,因此样品前处理在目前的检测条件下依然必不可少。
3.3 色谱仪器分析检测和快速检测的比较
色谱仪器检测方法和快速检测方法对发酵食品中EC含量检测的比较如表2所示。通过对比仪器检测方法和快速检测方法在灵敏度、重复性、易用性以及价格和时间上的花费,以决定在不同的食品种类和检测情形中采用何种检测方法。
一般需要考察以下几个方面:①根据各国对食品中EC的限量标准以及发酵食品中EC的含量,对葡萄酒、酱油、醋和腐乳中EC的分析方法的定量限应该低于10 μg/kg,对黄酒、蒸馏酒和白兰地等酒类来说,方法的定量限应低于100 μg/kg。而GC-MS和HPLC-MS/MS等分析方法的定量限一般在1~10 μg/kg之间,能充分满足各种发酵食品中EC的检测要求,有针对性地优化后的HPLC-FLD也能满足绝大多数的检测场景。对于快速检测方法来说,SERS检测和衍生后的免疫检测能基本满足黄酒和白兰地等限量要求较高的酒类。在
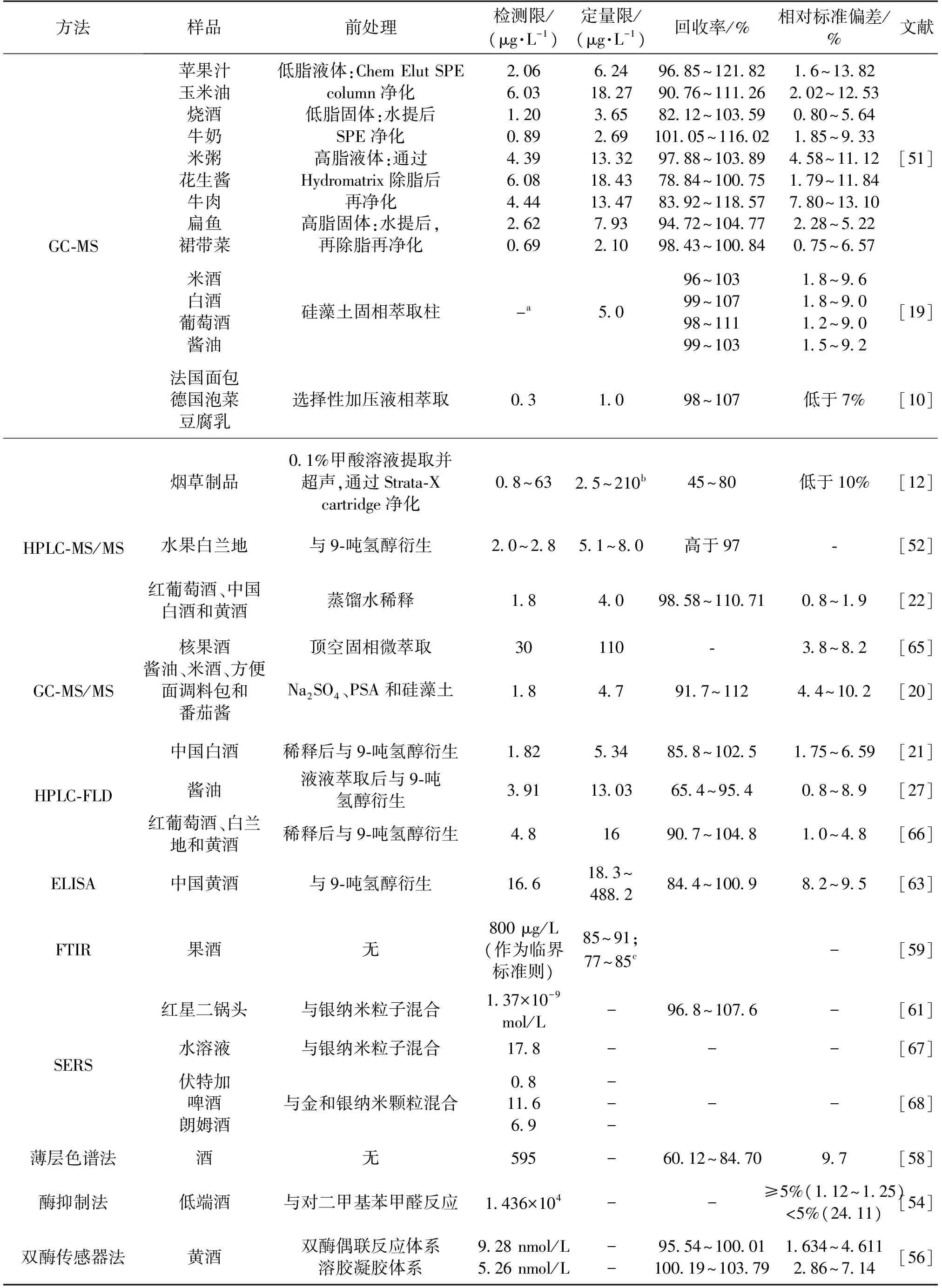
表2 色谱仪器检测方法和快速检测方法对发酵食品中EC含量检测的应用
注:a表示未提及;b表示根据不同的香烟和干湿状态,c表示85%~91%的校正集,而77%~85%为验证集。
没有富集步骤的前提下,直接免疫检测和酶法检测基本不能满足检测要求。这是限制目前快速检测EC方法的最重要因素。②大部分的色谱仪器检测方法能够检测绝大多数发酵食品,适用于绝大多数使用场景,且回收率基本在80%~120%之间,标准偏差低于10%,甚至有些低于5%。而大部分EC快速检测方法缺乏足够的数据,需要进一步评估,免疫检测和薄层色谱法只针对一种酒类的相对标准偏差就接近于10%,这是确保EC检测方法用于实际检测场景急需克服的难题。③一般而言,色谱仪器检测方法需要经过SPE净化后上样检测,或者经过衍生以确保方法的高灵敏性,但是大部分快速检测方法不需要富集和纯化步骤,平均一个样品的检测时间均低于20 min,且花费更少。在目前条件下,很难做到不对样品进行任何处理的实时在线检测。发展EC快速检测方法,对于监测发酵食品中EC含量有重要意义,同时有助于了解生产过程中的EC含量检测,便于更好地控制发酵食品中EC水平。
4 结论与展望
目前,随着对发酵食品中EC形成机理更深入的了解,提出了越来越多的EC含量控制方法,然而能够用于实际生产的措施依然很少,酒中的EC含量高于国际标准的现象时有发生。因此,应该综合考虑不同发酵食品中主要的EC前体物质与环境因素对EC形成的影响,在研究控制EC含量方法时与实际生产过程紧密结合,并进行验证。利用基因工程方法改造初始发酵菌株如敲除酿酒酵母中编码精氨酸酶的CAR1基因需要慎重考虑,而调控酵母的氮代谢途径从而降低尿素积累的方法还应在实际发酵环境中作进一步验证。同时,在发酵食品分离能够大量消耗EC前体物质又不显著改变发酵风味的菌株应用于同种发酵食品中[69],对于降低该发酵食品中EC含量应用前景广阔,调整生产工艺和贮藏环境仍然是目前主要控制措施。
对于EC检测方法,GC-MS作为标准检测方法具有灵敏度高、选择性好和稳定性强等特点,而GC-MS/MS和HPLC-MS/MS能某种程度上降低检测限并具有更好的选择性,甚至能简化前处理过程,面对在线检测的要求以及大量样品需要筛查的情况下,便宜和操作简便的快速EC检测方法更具优势,更能满足企业、监管机构甚至是消费者的要求。然而,目前迫切需要提高快速检测方法的灵敏度和重复性,并简化前处理步骤,针对不同的快速检测方法的缺点,努力方向不同:酶抑制法、薄层色谱法和FTIR法检测限最高;SERS法在增强物的筛选和定量过程上还需要深入研究;由于能够同时检测大量样品,ELISA检测法前景广阔,但衍生步骤延长了检测时间,迫切需要制备出更具EC特异性的抗体并研究EC直接检测的ELISA法。这些快速检测方法和含量控制方法的发展,对于实时监测并降低发酵食品EC水平,降低EC致癌风险具有重要意义。
参考文献:
[1]NOMURA T.Urethan(ethyl carbamate) as a cosolvent of drugs commonly used parenterally in humans[J].Cancer Res,1975,35(10):2895-2899.
[2]JOHNSON R,FOWLER J,ZANELLL G.Changes in mouse blood pressure,tumor blood flow,and core and tumor temperatures following nembutal or urethane anesthesia[J].Radiology,1976,118(3):697-703.
[3]HIRSCHBOECK J S,LINDERT M,CHASE J,et al.Effects of urethane in the treatment of leukemia and metastatic malignant tumors[J].J Am Med Assoc,1948,136(2):90-95.
[4]NETTLESHIP A,HENSHAW P S,MEYER H L.Induction of pulmonary tumors in mice with ethyl carbamate(urethane)[J].Pediatr Int,1943,52(3):290-295.
[5]CADRANEL J,LEGENDRE C,DESAINT B,et al.Liver disease from surreptitious administration of urethane[J].J Clin Gastroenterol,1993,17(1):52-56.
[6]SCHLATTER J,LUTZ W K.The carcinogenic potential of ethyl carbamate(urethane):risk assessment at human dietary exposure levels[J].Food Chem Toxicol,1990,28(3):205-211.
[7]CHEN D,REN Y,ZHONG Q,et al.Ethyl carbamate in alcoholic beverages from China:levels,dietary intake,and risk assessment[J].Food Control,2017,72:283-288.
[8]LACHENMEIER D W,LIMA M C N,BREGA I C,et al.Cancer risk assessment of ethyl carbamate in alcoholic beverages from Brazil with special consideration to the spirits cachaça and tiquira[J].BMC Cancer,2010,10(1):266-281.
[9]KIM Y G,LYU J,KIM M K,et al.Effect of citrulline,urea,ethanol,and urease on the formation of ethyl carbamate in soybean paste model system[J].Food Chem,2015,189:74-79.
[10]LIAO Q G,LUO L G.Fast and selective pressurized liquid extraction with simultaneous in-cell cleanup for the analysis of ethyl carbamate in fermented solid foods[J].Chromatographia,2014,77(13/14):963-967.
[11]LEE K G.Analysis and risk assessment of ethyl carbamate in various fermented foods[J].Eur Food Res Technol,2013,236(5):891-898.
[12]STEPAN H,PANI J,PUMMER S,et al.Sensitive Determination of ethyl carbamate in smokeless tobacco products and cigarette smoke using SPE and HPLC-APCI-MS/MS[J].Chromatographia,2015,78(9/10):675-681.
[13]LEE B Q,KHOR S M.3-Chloropropane-1,2-diol(3-MCPD) in soy sauce:a review on the formation,reduction and detection of this potential carcinogen[J].Compr Rev Food Sci F,2015,14(1):48-66.
[14]CHOI B,RYU D,KIM C,et al.Probabilistic dietary exposure to ethyl carbamate from fermented foods and alcoholic beverages in the Korean population[J].Food Addit Contam,2017,Doi.org/10.1080/19440049.2017.1364433.
[15]ZHANG J,FANG F,CHEN J,et al.The arginine deiminase pathway of koji bacteria is involved in ethyl carbamate precursor production in soy sauce[J].FEMS Microbiol Lett,2014,358(1):91-97.
[16]TANG A S P,CHUNG S W C,KWONG K,et al.Ethyl carbamate in fermented foods and beverages:dietary exposure of the Hong Kong population in 2007-2008[J].Food Addit Contam,2011,4(3):195-204.
[17]LIU Y,DONG B,QIN Z,et al.Ethyl carbamate levels in wine and spirits from markets in Hebei Province,China[J].Food Addit Contam,2011,4(1):1-5.
[18]WU P,PAN X,WANG L,et al.A survey of ethyl carbamate in fermented foods and beverages from Zhejiang,China[J].Food Control,2012,23(1):286-288.
[19]HUANG Z,PAN X D,WU P G et al.Validation(in-house and collaboratory) of the quantification method for ethyl carbamate in alcoholic beverages and soy sauce by GC-MS[J].Food Chem,2013,141(4):4161-4165.
[20]MO W M,HE H L,XU X M,et al.Simultaneous determination of ethyl carbamate,chloropropanols and acrylamide in fermented products,flavoring and related foods by gas chromatography-triple quadrupole mass spectrometry[J].Food Control,2014,43:251-257.
[21]LI G,ZHONG Q,WANG D,et al.Determination and formation of ethyl carbamate in Chinese spirits[J].Food Control,2015,56:169-176.
[22]ZHAO X,JIANG C.Determination of ethyl carbamate in fermented liquids by ultra high performance liquid chromatography coupled with a Q exactive hybrid quadrupole-orbitrap mass spectrometer[J].Food Chem,2015,177:66-71.
[23]HASNIP S,CREWS C,POTTER N,et al.Survey of ethyl carbamate in fermented foods sold in the United Kingdom in 2004[J].J Agric Food Chem,2007,55(7):2755-2759.
[24]UTHURRY C A,VARELA F,COLOMO B,et al.Ethyl carbamate concentrations of typical Spanish red wines[J].Food Chem,2004,88(3):329-336.
[25]HASHIGUCHI T,HORII S,IZU H,et al.The concentration of ethyl carbamate in commercial ume(Prunusmume) liqueur products and a method of reducing it[J].Biosci Biotech Biochem,2010,74(10):2060-2066.
[26]RIACHI L G,SANTOS A,MOREIRA R F,et al.A review of ethyl carbamate and polycyclic aromatic hydrocarbon contamination risk in cachaca and other Brazilian sugarcane spirits[J].Food Chem,2014,149:159-169.
[27]ZHOU K,LIU Y,LI W Q,et al.An improved HPLC-FLD for fast and simple detection of ethyl carbamate in soy sauce and prediction of precursors[J].Food Anal Method,2017,DOI:10.1007/s12161-017-0948-5.
[28]顾青.氨基甲酸乙酯的绿色清洁合成工艺研究[D].上海:华东理工大学,2013.
[29]赵鑫锐.代谢工程改造酿酒酵母降低黄酒中的氨基甲酸乙酯[D].无锡:江南大学,2014.
[30]ZHAO X,DU G,ZOU H,et al.Progress in preventing the accumulation of ethyl carbamate in alcoholic beverages[J].Trends Food Sci Tech,2013,32(2):97-107.
[31]SCHEHL B,SENN T,LACHENMEIER D W,et al.Contribution of the fermenting yeast strain to ethyl carbamate generation in stone fruit spirits[J].Appl Microbiol Biotech,2007,74(4):843-850.
[32]UTHURRY C,LEPE J S,LOMBARDERO J,et al.Ethyl carbamate production by selected yeasts and lactic acid bacteria in red wine[J].Food Chem,2006,94(2):262-270.
[33]GUO X W,LI Y Z,GUO J,et al.Reduced production of ethyl carbamate for wine fermentation by deletingCAR1 inSaccharomycescerevisiae[J].J Ind Microbiol Biotech,2016,43(5):671-679.
[34]WU D,LI X,SHEN C,et al.Decreased ethyl carbamate generation during Chinese rice wine fermentation by disruption ofCAR1 in an industrial yeast strain[J].Int J Food Microbiol,2014,180:19-23.
[35]CHIN Y W,KANG W K,JANG H W,et al.CAR1 deletion by CRISPR/Cas9 reduces formation of ethyl carbamate from ethanol fermentation bySaccharomycescerevisiae[J].J Ind Microbiol Biotech,2016,43(11):1517-1525.
[36]WU D,LI X,LU J,et al.Constitutive expression of theDUR1,2 gene in an industrial yeast strain to minimize ethyl carbamate production during Chinese rice wine fermentation[J].FEMS Microbiol Lett,2016,363(1):1-6.
[37]DAHABIEH M S,HUSNIK J I,VAN VUUREN H J.Functional expression of theDUR3 gene in a wine yeast strain to minimize ethyl carbamate in Chardonnay wine[J].Am J Enol Viticult,2009,60(4):537-541.
[38]DAHABIEH M S,HUSNIK J I,VAN VUUREN H J.Functional enhancement of Sake yeast strains to minimize the production of ethyl carbamate in Sake wine[J].J Appl Microbiol,2010,109(3):963-973.
[39]ZHOU J,KANG Z,LIU Q,et al.Degradation of urea and ethyl carbamate in Chinese rice wine by recombinant acid urease[J].Chin J Biotechnol,2016,32(1):74-83.
[40]AZEVEDO Z,COUTO J,HOGG T.Citrulline as the main precursor of ethyl carbamate in model fortified wines inoculated withLactobacillushilgardii:a marker of the levels in a spoiled fortified wine[J].Lett Appl Microbiol,2002,34(1):32-36.
[41]ROMERO S V,REGUANT C,BORDONS A,et al.Potential formation of ethyl carbamate in simulated wine inoculated withOenococcusoeniandLactobacillusplantarum[J].Int J Food Sci Tech,2009,44(6):1206-1213.
[42]张继冉.酱油中氨基甲酸乙酯的产生机制和消除策略研究[D].无锡:江南大学,2016.
[43]CHOI B,KOH E.Changes of ethyl carbamate and its precursors in maesil(Prunusmume) extract during one-year fermentation[J].Food Chem,2016,209:318-322.
[44]GALINARO C A,OHE T H,DA SILVA A C,et al.Cyanate as an active precursor of ethyl carbamate formation in sugar cane spirit[J].J Agric Food Chem,2015,63(33):7415-7420.
[45]LI X,WANG P,WU D,et al.Effects of sterilization temperature on the concentration of ethyl carbamate and other quality traits in Chinese rice wine[J].J Inst Brewing,2014,120(4):512-515.
[46]XUE J,FU F,LIANG M,et al.Ethyl carbamate production kinetics during wine storage[J].Food Ferment Ind,2015,36(2):277-284.
[47]WEBER J V,SHARYPOV V I.Ethyl carbamate in foods and beverages:a review[J].Environ Chem Lett,2009,7(3):233-247.
[48]ARESTA M,BOSCOLO M,FRANCO D W.Copper(II) catalysis in cyanide conversion into ethyl carbamate in spirits and relevant reactions[J].J Agric Food Chem,2001,49(6):2819-2824.
[49]GU X L,TIAN Y P.Isolation and characterization of urethanase fromPenicilliumvariabileand its application to reduce ethyl carbamate contamination in Chinese rice wine[J].Appl Biochem Biotech,2013,170(3):718-728.
[50]PARK S R,HA S D,YOON J H,et al.Exposure to ethyl carbamate in alcohol-drinking and nondrinking adults and its reduction by simple charcoal filtration[J].Food Control,2009,20(10):946-952.
[51]RYU D,CHOI B,KIM N,et al.Validation of analytical methods for ethyl carbamate in nine food matrices[J].Food Chem,2016,211:770-775.
[53]JIAO Z,DONG Y,CHEN Q.Ethyl carbamate in fermented beverages:presence,analytical chemistry,formation mechanism,and mitigation proposals[J].Compr Rev Food Sci Food Safety,2014,13(4):611-626.
[54]刘丽斌.基于酶抑制法的酒精饮料中氨基甲酸乙酯的快速检测的研究[D].广州:华南理工大学,2014.
[55]STASYUK N Y,GAYDA G,FAYURA L,et al.Novel arginine deiminase-based method to assay l-arginine in beverages[J].Food Chem,2016,201:320-326.
[56]卢晓霞.双酶传感器的构建及氨基甲酸乙酯检测应用初探[D].无锡:江南大学,2015.
[57]JARYJ E,LORENZ K,SPANGENBERG B.A simple method for the quantification of urethane in spirits[J].J Liquid Chrom Relat Technol,2008,31(13):1969-1976.
[58]王浩.薄层数码成像法对酒精饮料中氨基甲酸乙酯快速检测的研究[D].广州:华南理工大学,2015.
[59]LACHENMEIER D W.Rapid screening for ethyl carbamate in stone-fruit spirits using FTIR spectroscopy and chemometrics[J].Anal Bioanal Chem,2005,382(6):1407-1412.
[60]杨丹婷.氨基甲酸乙酯和大肠杆菌的表面增强拉曼光谱检测方法[D].杭州:浙江大学,2013.
[61]LI M,ZHAO Y,CUI M,et al.SERS-active Ag nanostars substrates for sensitive detection of ethyl carbamate in wine[J].Anal Sci,2016,32(7):725-728.
[62]DU J,WANG H,WANG H,et al.Surface-enhanced raman scattering of ethyl carbamate adsorbed on Ag 20 cluster:enhancement mechanism[J].J Mol Struct,2017,1131:212-217.
[63]LUO L,LEI H T,YANG J Y,et al.Development of an indirect ELISA for the determination of ethyl carbamate in Chinese rice wine[J].Anal Chim Acta,2017,950:162-169.
[64]LUO L,SONG Y,ZHU C,et al.Fluorescent silicon nanoparticles-based ratiometric fluorescence immunoassay for sensitive detection of ethyl carbamate in red wine[J].Sensor Actuators B,2017,DOI:10.1016/j.snb.2017.09.088.
[65]LACHENMEIER D W,NERLICH U,KUBALLA T.Automated determination of ethyl carbamate in stone-fruit spirits using headspace solid-phase microextraction and gas chromatography-tandem mass spectrometry[J].J Chromatogr A,2006,1108(1):116-120.
[66]ZHANG J,LIU G,ZHANG Y,et al.Simultaneous determination of ethyl carbamate and urea in alcoholic beverages by high-performance liquid chromatography coupled with fluorescence detection[J].J Agric Food Chem,2014,62(13):2797-2802.
[67]YANG D,MIRCESCU N E,ZHOU H,et al.DFT study and quantitative detection by surface-enhanced Raman scattering(SERS) of ethyl carbamate[J].J Raman Spectrosc,2013,44(11):1491-1496.
[68]YANG D,ZHOU H,YING Y,et al.Surface-enhanced Raman scattering for quantitative detection of ethyl carbamate in alcoholic beverages[J].Anal Bioanal Chem,2013,405(29):9419-9425.
[69]ZHANG J,DU G,CHEN J,et al.Characterization of aBacillusamyloliquefaciensstrain for reduction of citrulline accumulation during soy sauce fermentation[J].Biotechnol Lett,2016,38(10):1723-1731.
