基于纳米材料的生物传感技术在食品安全检测中的应用
2018-04-11潘玉宁颜春荣徐春祥
潘玉宁,颜春荣,张 蕾,徐春祥
(江苏省食品药品监督检验研究院,江苏 南京 210008)
食品供应的全球化及食品微加工的需求让食品安全成为一项巨大的挑战[1-2]。一些潜在的食品化学及生物污染来源包括:农产品中农药化肥及抗生素的使用残留、加工食品中非安全水平的食品添加剂的使用、用低质量或不安全的原料故意掺假、对敏感人群可产生危害的过敏原或其他物质的交叉污染(如,小麦麸质)、不卫生的农业或加工条件导致的微生物生长、包装泄露或消费者使用不当使食品在运输或储藏中发生腐败等。因此,迫切需要研究和开发一些快速、灵敏、经济、方便和可靠的技术用于检测复杂基质中化学污染和微生物及其产生的毒素等,以满足社会和政府的食品安全风险控制需要。
世界各国也积极建立了一系列食品安全标准和通用的危害分析方法,包括免疫分析法、传统生物鉴定法、化学分析法、仪器分析法及活体动物实验等[3-4],这些方法都有其适用范围,虽然相对可靠、稳定,但通常操作时间长、灵敏度不高、仪器昂贵且所占体积较大。近年来,生物传感技术逐渐应用到食品安全分析检测领域,其与电化学、材料科学、免疫学及生物学相结合,在绿色、安全、提高灵敏度、高通量及连续检测等方面显示了优异的性能。
1 生物传感器概况
生物传感器由两个主要部分组成,即固定化的生物识别元件和信号转换元件,其工作原理是待测物质和识别元件发生特异性生化反应,产生的生物学信息通过信号转换元件转化为可以定量处理的电、光等信号,再经仪表二次放大和输出,从而获取待测物质浓度信息。生物传感器中的生物识别元件有抗体(抗原)、酶、细胞、核酸、微生物和动植物组织等生物活性物质,信号转换元件包括电化学电极、光电转换器(如,表面等离子共振SPR、拉曼和傅里叶变换红外光谱)、热敏电阻、压电晶体(如,表面声波SAW)等[5-6](图1)。同时,纳米科技也在逐步渗入到生物传感技术中。纳米材料相对大的比表面积大大提高识别元件的密度,有效提高混合基质中待测物质的分离和预富集效率,纳米材料(如,石墨烯)良好的生物相容性、导电性、催化活性和稳定性大幅提升灵敏度、降低检测限、弱化基质效应。金属纳米材料、磁珠、微流体等技术的融合大大推动了食品安全检测领域的发展[5-15]。
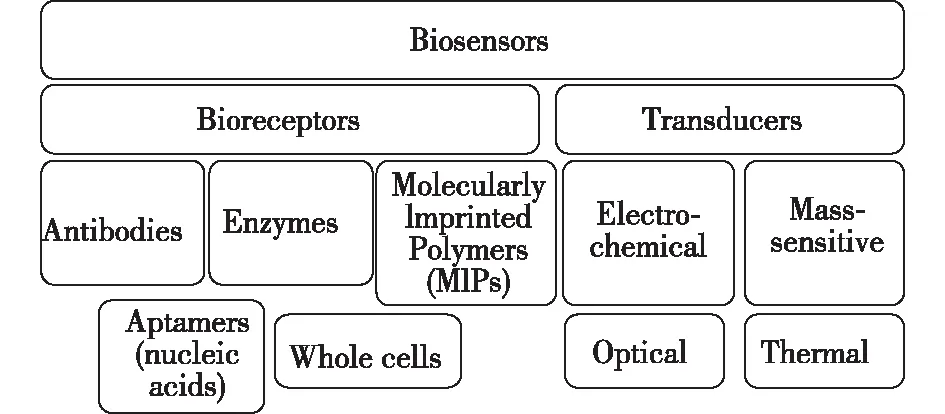
图1 生物传感器分类示意图[6]Fig.1 Different types of biosensors
2 金属和多原子离子的检测
Afkhami等[16]利用二氧化硅的纳米管材料建立了电化学生物传感器,在鱼、虾、大米和烟草等食品基质中同时检测Cd2+、Cu2+和Hg2+,检出限分别是0.3、0.1和0.05 ng/mL。Chaiyo等[17]研制的银纳米片可视化传感器可检测水、番茄、果汁和大米中的铜离子浓度,其通过硫代硫酸盐催化后经过比色系统探测反应后不同颜色强度,研究显示检出限为0.3 ng/mL,检测质量浓度范围为0.5~200 ng/mL。Devaramani等[18]研发了可用于干果、葡萄酒、糖和水的亚硫酸盐检测的伏安型生物传感器,碳电极经过硝普酸钴(CoNP)修饰可有效提高导电性,检测浓度范围可达0.01~8 μmol/L,检出限为0.004 μmol/L,定量限为0.022 9 μmol/L。Saber-Tehrani等[19]将Pt与聚(2-邻氨基苯硫醇)修饰于金电极上,可检测香肠中亚硝酸盐含量(浓度范围3 μmol/L~1 mmol/L),检出限可达1 μmol/L。
3 小分子量有机物的检测
3.1 食品成分检测
生物传感技术可应用于食品中的成分检测,例如食品中的糖类、胆固醇和维生素等。纳米金是目前为止研究较早的一种纳米材料,制备流程简单可控、性能较稳定、生物相容性较好,能与多种生物分子相结合,不影响生物活性,且具有独特光学效应。各类型的碳纳米结构,如石墨烯、单壁碳纳米管和多壁碳纳米管等,因其特定结构和性能而获得广泛关注,不仅具有良好的催化活性、电导率和生物相容性,以提高信号传递速率,且能扩增富集特定的生物信号,从而提高灵敏度。German等[20]将葡萄糖氧化酶固定于石墨棒上设计的纳米金传感器可用于饮料中葡萄糖的分析测定,还能够对食品的生产过程进行监控。将ZnO纳米颗粒覆于碳纳米管表面,并固定胆固醇氧化酶,通过对H2O2的测量可进行胆固醇氧化程度的控制。Hayat等[21]利用此传感器在奶粉中测定胆固醇含量,检出限低至0.2 nmol/L。Liu等[22]利用维生素C激活二氧化锰碳纳米管的荧光信号设计的荧光传感器已成功运用于新鲜果汁、商业化果汁和蔬菜中维生素C的分析检测,检出限低至42 nmol/L,检测范围可达0.18~90 μmol/L。
3.2 食品添加剂检测
量子点纳米颗粒吸收光谱范围宽、发射光谱范围窄,可被单一波长的光激发,荧光产率高、荧光寿命较长,具有较强抗光漂白性能、可有效避免光谱重叠产生的信号干扰等优点,近年来被广泛用于生物标记。Cao等[23]设计了一种高敏感度的荧光生物传感设备,三聚氰胺可与Ag纳米粒子结合,激发ZnSe量子点的荧光信号,经研究发现可在生牛奶和鸡蛋等食品样品中有效检测1.0~36 μg/L的三聚氰胺。2015年,Chen等[24]将金纳米颗粒与氧化石墨烯相结合制备了安培型生物传感器,通过测定玻璃碳电极电流变化可测定三聚氰胺的含量,线性范围是5.0~50 nmol/L。
Chen等[25]利用荧光共振能量转移传感器检测辣椒粉中苏丹红Ⅰ~Ⅳ的含量。他们将聚乙烯亚胺与Ag团簇颗粒相结合,形成的PEI-AgNCs聚合物在375 nm具有强蓝色荧光,当加入苏丹红染料时荧光猝灭,苏丹红染料的浓度与猝灭效率呈正比,分别在0.4~25、0.4~30、0.2~20、0.2~25浓度范围测定苏丹红Ⅰ、Ⅱ、Ⅲ、Ⅳ的含量。
3.3 农药兽药残留检测
Kim等[26]开发了表面增强拉曼光谱传感器用于检测毒死蜱和噻苯咪唑(涕必灵),在苹果中的检出限为7 ng/g。通过化学修饰将直接或间接参与化学发光反应的试剂固定在电极上可构建电化学发光生物传感器。新型的纳米材料具有优良的物理化学性能,结合纳米材料修饰电极可增加传导性,促进电子传递,可提高分析灵敏度、选择性和线性范围,降低成本。南京农业大学的研究人员Miao等[27]研发了电化学发光生物传感器,在测定食品样品中有机磷农药残留方面获得了较好的效果。他们将双金属Pt-Au纳米颗粒电沉积于多层碳纳米管的电极表面,同时将乙酰胆碱酯酶(AchE)和胆碱氧化酶(ChOx)固定于电极上,有机磷农药吸附于电极上,从而导致了光信号减弱。研究显示:甲基对硫磷和毒死蜱在0.1~50 nmol/L浓度范围内与电化学光信号抑制率成正比,毒氟磷的检测范围为50~500 nmol/L。
复合纳米材料将不同性能组分相结合,各组分的相互耦合使得在本身性能的基础上增加其他新颖特性,因此,复合纳米材料在食品安全检测领域具有重要应用潜能。不过总体来看,电化学发光生物传感器研究并不是那么广泛,可能由于化学发光传感器与其较类似,相信今后电化学发光过程会发挥其优势,拓宽电化学发光传感器应用领域。
与电化学发光原理相反,光电化学生物传感器利用光源激发光活性物质,将其产生的光电流作为检测信号,通过光电响应变化建立与分析物浓度的定量关系。由于激发形式和检测信号不同,此传感器的背景信号低于传统的电化学方法。光活性材料是决定光电化学生物传感器性能的关键。优良的材料可加快响应速率,提高检测灵敏度。Okoth等[28]研发出可检测磺胺二甲嘧啶(SDM)残留的光电化学适体传感器,他们将三硫化二铋(Bi2S3)纳米棒与石墨烯结合作为光敏材料,将5′-氨基-终止SDM固定于电极表面,这种适体传感器可用于检测牛奶中1.0~100 nmol/L浓度范围的SDM,远低于安全限定值(中国婴儿奶粉的限定值为1 g/mL)。Ling等[29]设计出基于RNA适体的金纳米颗粒荧光传感器,一条寡核苷酸链修饰于AuNP表面,另一条链标记羧基荧光素,牛奶中新霉素B与片段结合可使荧光猝灭,实验中RNA序列保持稳定,新霉素B检出限可低至0.01 μmol/L。Muhammad等[30]利用基于多层碳纳米管的金纳米颗粒电化学传感器测定牛奶中的阿莫西林,检出限为0.015 μmol/L,检测浓度范围在0.2~30 μmol/L,与聚谷氨酸/戊二醛膜式伏安传感器(检出限0.92 μmol/L)相比具有显著优势[31]。Huang等[32]开发的硅纳米颗粒免疫层析试纸条可用于牛奶中恩诺沙星残留的快速检测。新型纳米材料将提升信号灵敏度,降低生物传感器在食品样品中的检出限,例如聚吡咯/二氧化硅/磁铁矿纳米颗粒,用于牛奶样品中磺胺类药物(磺胺嘧啶和磺胺甲基嘧啶)的提取和预浓缩,实验回收率高达86.7%~99.7%[33]。
3.4 其他
Gao等[34]将牛血清白蛋白与铜纳米团簇结合制备的荧光传感器可用于检测酱油和醋中0.2~50 μmol/L浓度范围的曲酸。Apak等[35]利用纳米二氧化钛的光纤反射传感器检测绿茶、红茶等茶叶中的儿茶素含量并获得良好效果。El-Nour等[36]将金纳米颗粒用于光学传感器中快速检测禽肉组织中的组胺,检测限为0.6 μmol/L,具有高灵敏度。
4 生物毒素的检测
融合纳米技术的生物传感技术可广泛应用于食品中的生物毒素检测[37-41]。生物毒素包括细菌毒素和真菌毒素等。生物毒素对食品生产中的各环节危害巨大,对人体健康带来极大损害,因此加强对其的检测至关重要。
4.1 细菌毒素检测
肉毒毒素是肉毒杆菌在生长过程中产生的嗜神经性外毒素,是目前已知毒性最强烈的生物毒素之一[42]。金纳米粒子可提高电化学活性和稳定性,金掺杂的碳纳米复合物有较大的比表面积,促进电子的转移。Liu等[43]利用电化学免疫传感器检测A型肉毒毒素(BoNT/A),将辣根过氧化物酶标记的抗体附于金纳米颗粒表面,并与碳电极板结合,通过测定电流变化达到定量分析目的,检测范围为4~35 pg/mL。Chai等[44]利用电化学免疫阻抗传感器葡萄球菌肠毒素B(SEB)纳米多孔氧化电镀铝作为电极基体,利用氨丙基三乙氧基硅烷和戊二醛将SEB抗体固定,通过电化学阻抗谱分析法测量SEB与抗体结合后电子转移阻抗的差来实现SEB高灵敏定量分析,检出限为10 pg/mL。霍乱毒素(CT)是由霍乱弧菌所产生的外毒素,可引起霍乱性腹泻,对人体健康危害较大。Viswanathan等[45]研究了一种电化学免疫传感器用于CT的检测方法,将聚(3,4-乙烯二氧噻吩)包覆的抗CT抗体连接在玻璃碳电极的多层碳纳米管表面,毒素与抗CT抗体结合,随后与神经节苷脂功能的脂质体连接,通过方波溶出伏安法分析经亚铁氰化钾释放的电极表面的脂质体来定量检测CT。志贺毒素主要由肠出血性大肠杆菌产生,例如食源性致病菌大肠埃希氏菌O157:H7[46],Chien等[47]利用金纳米颗粒建立了竞争性表面等离子共振传感器来检测志贺毒素。
4.2 真菌毒素检测
真菌毒素为真菌分泌的有毒代谢产物,广泛存在于食品或饲料(如,谷物、饮料、坚果、咖啡和酒类等)里,具有致细胞突变、致畸致癌等作用,对人身健康造成极大危害。食品中常见的真菌毒素主要有:黄曲霉毒素、赭曲霉毒素、脱氧雪腐镰刀菌烯醇、伏马菌素、杂色曲霉素和展青霉素等。
Yola等[48]利用分子印迹聚合物作为识别元件设计的银纳米颗粒伏安传感器在葡萄汁和红酒中检测赭曲霉毒素A(OTA)显示出较高的灵敏度和较好的回收率,检出限为0.016 nmol/L。Castillo团队的Bone等[49-50]建立了直接和间接免疫传感器用于检测OTA,金纳米颗粒修饰的OTA-牛血清蛋白偶联物吸附于碳纳米电极上,待测OTA与其竞争性结合已知浓度抗体。检出限分别为0.2和0.1 ng/mL,比不含纳米颗粒的免疫传感器低。
黄曲霉毒素是目前已知真菌毒素中致癌性和毒性最强的。Singh等[51]将Sm2O3纳米棒和镍纳米颗粒固定于电极表面设计的电化学传感器,识别元件为抗AFB1抗体,可检测食品中10~700 pg/mL的黄曲霉毒素B1(AFB1)。Chauhan等[52]研发出一种可重复使用的电化学石英晶体微天平免疫传感器,也可用于检测食品中的AFB1,单克隆抗AFB1抗体作为捕获抗体固定于金镀膜石英晶体电极表面,同时将兔IgG检测抗体与Au-Fe3O4纳米颗粒结合,可使生物电极再生。实验中谷物样品中的AFB1与捕获抗体反应而被捕获到电极表面上,洗去游离抗原,检测抗体与样品中AFB1继续反应,在电极表面形成夹心式复合物。通过检测复合物上标记物产生的信号大小来计算样品中AFB1的含量,检测范围为0.05~5 ng/mL。
脱氧雪腐镰刀菌烯醇(DON)历史上也称为呕吐毒素,可引起呕吐、腹泻和肠道坏死等急慢性疾病。Sunday等[53]设计的电化学免疫抑制传感器可用于检测玉米和小麦等食品中6~30 ng/mL范围的DON。Romanazzo等[54]将免疫磁珠与丝网印刷电极结合研发了电化学免疫传感器检测谷物中的DON,游离DON和固定于磁珠上的人血清白蛋白(HAS)-DON与带有标记的抗DON抗体竞争性结合,当样品中DON含量越高时,竞争结合到电极表面的标记抗原越少,最终检测的标记物产生的信号大小与样品中DON含量成反比关系,检测范围为0.1~4.5 μg/mL,检出限为63 ng/mL。
5 病原微生物的检测
5.1 致病性大肠埃希氏菌的检测
大肠埃希氏菌通常对人体无害,但部分具有致病性,最常见的肠出血性大肠埃希氏菌O157:H7可引起腹泻,严重者因肾功能衰竭而死亡。Wang等[55]研发出由3种纳米粒子组装的电化学免疫传感器,金纳米颗粒与抗大肠埃希氏菌O157:H7抗体连接,可与具抗体功能的磁性纳米颗粒捕获的靶细胞结合,每个金纳米颗粒又与多个PbS纳米颗粒连接,通过方波溶出伏安法跟踪检测碳电极表面每一次结合反应的信号来检测大肠埃希氏菌O157:H7。可检测10~106CFU/mL范围的大肠埃希氏菌。目前有报道显示有许多传感器可根据检测微生物DNA来对微生物进行分析。Abdalhai领导的团队[56]制备了电化学基因传感器,将互补DNA固定于金电极表面,与样品中DNA特异性结合后后,在玻璃碳电极表面形成DNA-靶DNA-捕获DNA-PbS纳米颗粒三明治结构,电极浸于硝酸溶液中,通过微分脉冲伏安法测得大肠埃希氏菌O157:H7 的DNA含量,检出限为1.97×10-14mol/L。
5.2 沙门氏菌的检测
据统计,我国绝大多数细菌性食物中毒由沙门氏菌引起。肠炎沙门氏菌、鼠伤寒沙门氏菌和猪霍乱沙门氏菌是引起食源性事故最常见的几种沙门氏菌,容易污染动物源性食品,如蛋类、肉类、畜禽类和乳制品等。
发光量子点等纳米材料用作荧光标记物可消除背底荧光干扰。Kim等[57]设计了微流体纳米生物传感设备,将抗沙门氏菌抗体固定于量子点纳米颗粒表面,并用荧光标记,通过检测抗原抗体反应的荧光信号来检测沙门氏菌。Ozalp等[58]成功设计了石英晶体微天平传感器用于检测沙门氏菌。石英晶体谐振器具有压电特性,可将石英晶振电极表面质量变化转化为电信号。将适配体固定于磁珠表面,样品中的沙门氏菌与适配体结合,通过质量变化进而被石英晶体微天平传感器检测到。
5.3 单核细胞增生性李斯特菌的检测
单核细胞增生性李斯特菌是重要的食源性致病菌之一,是一种人畜共患的病原菌。单核细胞增生性李斯特菌可通过牛奶、奶酪、香肠和午餐肉等污染的食品感染人类,可引起脑炎、脑膜炎、败血症以及自发性流产等,患者死亡比例可高达20%~30%。单核细胞增生性李斯特菌感染对象主要是老年人、新生儿、孕妇及免疫功能低下者。
为了检测单核细胞增生性李斯特菌,Grossman等[59]于2004年就建立了超导量子干涉设备,将抗体包裹于超顺磁性纳米颗粒表面,细菌抗原和抗体特异性结合发生磁通量变化,通过这一变化检测菌液浓度。Weidemaier等[60]将表面增强拉曼散射纳米颗粒与超顺磁颗粒都连接了特异性抗体,抗原和抗体结合时与两者形成“三明治”结构,利用表面增强拉曼光谱技术实时检测抗原与抗体结合情况,从而获取菌液浓度信息。
6 展望
具有化学及光电性能的纳米材料在生物传感器中的应用为食品生物安全检测提供了新的途径。近几年来,纳米材料领域的研究不断发展,为新型生物传感器提供了更完美的设计思路,为生物传感器实现不同分析靶标的检测提供了有力平台,在检测及监测化学污染物、营养物质、生物聚合物以及病原微生物等方面提供便利,对食品生产、运输和销售等过程中的质量监控具有重要意义,为公共健康和公共安全保驾护航。今后的发展方向主要是进一步拓宽纳米材料在生物传感器领域的应用,提高生物传感器在食品安全检测中的灵敏度,加快分析速度;评估纳米材料的引用对于增加设备结构复杂的必要性,努力实现操作更简便、成本更低;延长设备使用寿命,同时向商业化、产业化方向发展。
参考文献:
[1]GODFRAY H C J,BEDDINGTON J R,CRUTE I R,et al.Food security:the challenge of feeding 9 billion people[J].Science,2010,327:812-818.
[2]MEYERS R A.Encyclopedia of Analytical Chemistry[M].New York:Wiley,2016.
[3]HARTEL R W,CLARK J P,RODRIGUEZ-LAZARO D,et al.Microarray detection and characterization of bacterial foodborne pathogens[M].Boston:Springer,2012.
[4]SHARMA D,NAGPAL A,PAKADE Y B,et al.Analytical methods for estimation of organophosphorus pesticide residues in fruits and vegetables:a review[J].Talanta,2010,82(4):1077-1080.
[5]BO X,ZHOU M,GUO L.Electrochemical sensors and biosensors based on less aggregated graphene[J].Biosens Bioelectron,2016,89:167-186.
[6]GAUDIN V.Advances in biosensor development for the screening of antibiotic residues in food products of animal origin:a comprehensive review[J].Biosens Bioelectron,2017,90:363-377.
[8]HANDFORD C E,DEAN M,HENCHION M,et al.Implications of nanotechnology for the agri-food industry:opportunities,benefits and risks[J].Trends Food Sci Technol,2014,40(2):226-241.
[10]JUSTINO C,ROCHA-SANTOS T,CARDOSO S,et al.Strategies for enhancing the analytical performance of nanomaterial-based sensors[J].TrAC Trends Anal Chem,2013,47(6):27-36.
[11]MARIN S,MERKOCI A.Nanomaterials based electrochemical sensing applicationsfor safety and security[J].Electroanalysis,2012,24(3):459-469.
[13]DAI Z,JU H.Bioanalysis based on nanoporousmaterials[J].Trends Anal Chem,2012,39:149-162.
[14]MARY E,GEORGIOS P,PHILIP D.Nanotechnology to the rescue:using nano-enabled approaches in microbiological food safety and quality[J].Curr Opin Biotechnol,2017,44:87-93.
[16]AFKHAMI A,SOLTANI-FELEHGARI F,MADRAKIAN T,et al.Fabrication and application of a new modified electrochemical sensor using nano-silica and a newly synthesized Schiff base for simultaneous determination of Cd2+,Cu2+and Hg2+ions in water and some foodstuff samples[J].Anal Chim Acta,2013,771:21-30.
[17]CHAIYO S,SIANGPROH W,APILUX A,et al.Highly selective and sensitive paper-based colorimetric sensor using thiosulfate catalytic etching of silver nanoplates for tracedetermination of copper ions[J].Anal Chim Acta,2015,866:75-83.
[18]DEVARAMANI S,MALINGAPPA P.Synthesis and characterization of cobalt nitroprusside nano particles:application to sulfite sensing in food and water samples[J].Electron Chim Acta,2012,85(4):579-587.
[19]SABER-TEHRANI M,POURHABIB A,HUSAIN S W,et al.A simple and efficient electrochemical sensor for nitrite determination in food samples based on Pt nanoparticles distributed poly(2-aminothiophenol) modified electrode[J].Food Anal Methods,2012,6(5):1300-1307.
[20]GERMAN N,RAMANAVICIENE A,VORONOVIC J,et al.Glucose biosensor based on graphite electrodes modified with glucose oxidase and colloidal gold nanoparticles[J].Microchim Acta,2010,168(3/4):221-229.
[21]HAYAT A,HAIDER W,RAZA Y,et al.Colorimetric cholesterolsensor based on peroxidase like activity of zinc oxide nanoparticles incorporated carbon nanotubes[J].Talanta,2015,143:157-161.
[22]LIU J,CHEN Y,WANG W,et al."Switch-On" fluorescent sensing of ascorbic acid in food samples based on carbon quantum dots-MnO2probe[J].J Agric Food Chem,2015,64(1):371-380.
[23]CAO X,SHEN F,ZHANG M,et al.Rapid and highly-sensitive melamine sensing based on the efficient inner filter effect of Ag nanoparticles on the fluorescence of eco-friendly ZnSe quantumdots[J].Sens Actuat B,2014,202(10):1175-1182.
[24]CHEN N,CHENG Y,LI C,et al.Determination of melamine in food contact materials using an electrode modified with gold nanoparticles and reduced grapheme oxide[J].Microchim Acta,2015,182(11/12):1967-1975.
[25]CHEN N Y,LI H F,GAO Z F,et al.Utilizing polyethyleneimine-capped silver nanoclusters as a new fluorescence probe for Sudan I-IV sensing in ethanol based on fluorescence resonance energy transfer[J].Sens Actuators B,2014,193:730-736.
[26]KIM A,BARCELO S J,LI Z.SERS-based pesticide detection by using nanofinger sensors[J].Nanotechnology,2015,26(1):015502.
[27]MIAO S S,WU M S,MA L Y,et al.Electrochemiluminescence biosensor for determination of organophosphorous pesticides based on bimetallic Pt-Au/multi-walled carbon nanotubes modified electrode[J].Talanta,2016,158:142-151.
[28]OKOTH O K,YAN K,LIU Y,et al.Graphene-doped Bi2S3nanorods as visible-light photoelectrochemical aptasensing platform for sulfadimethoxine detection[J].Biosens Bioelectron,2016,86:636-642.
[29]LING K,JIANG H,ZHANG L,et al.A self-assembling RNA aptamer-based nanoparticle sensor forfluorometric detection of Neomycin B in milk[J].Anal Bioanal Chem,2016,408(13):3593-3600.
[30]MUHAMMAD A,YUSOF N A,HAJIAN R,et al.Construction of an electrochemical sensor based on carbon nanotubes/gold nanoparticles for trace determination of amoxicillin in bovine milk[J].Sensors,2016,16(1):E56.
[31]SANTOS D P,BERGAMINI M F,ZANONI M V B.Voltammetric sensor for amoxicillin determination in human urine using polyglutamic acid/glutaraldehyde film[J].Sens Actuators B,2008,133(2):398-403.

[33]SUKCHUAY T,KANATHARANA P,WANNAPOB R,et al.Bunkoed O polypyrrole/silica/magnetite nanoparticles as a sorbent for the extraction of sulfonamides from water samples[J].J Sep Sci,2015,38(22):3921-3927.
[34]GAO Z,SU R,QI W,et al.Copper nanocluster-based fluorescent sensors for sensitive and selective detection of kojic acid in food stuff[J].Sens Actuators B,2014,195:359-364.
[35]APAK R,DEMIRCI C S,CETINKAYA A,et al.Selective determination of catechin among phenolic antioxidants with the use of a novel optical fiber reflectance sensor based on indophenol dye formation on nano-sized TiO2[J].J Agric Food Chem,2012,60(11):2769-2777.
[36]EL-NOUR K M A,SALAM E T A,Soliman H M,et al.Gold nanoparticles as a direct and rapid sensor for sensitive analytical detection of biogenic amines[J].Nanoscale Res Lett,2017,12(1):231-241.
[37]INGRID B,SCHERRINE A.AKHTAR H,et al.New biorecognition molecules in biosensors for the detection of toxins[J].Biosens Bioelectron,2017,87:285-298.
[38]MALHOTRA B D,SRIVASTAVA S,ALI M A,et al.Nanomaterial-based biosensorsfor food toxin detection[J].Appl Biochem Biotechnol,2014,174(3):880-896.
[39]CAMPAS M,GARIBO D,PRIETO S B.Novel nanobiotechnological concepts in electrochemical biosensors for the analysis of toxins[J].Analyst,2012,137:1055-1067.
[40]EIVAZZADEH-KEIHAN R,PASHAZADEH P,HEJAZI M,et al.Recent advances in nanomaterial-mediated bio and immune sensors for detection of aflatoxin in food products[J].TrAC Trend Anal Chem,2017,87:112-128.
[41]PEDRERO M,CAMPUZANO S,PINGARRON J.Magnetic beads-based electrochemical sensors applied to the detection and quantification of bioterrorism/biohazard agents[J].Electroanalysis,2012,24:470-482.
[42]STEPHEN B I,CHEN B H.Nanomaterial-based sensors for detection of foodborne bacterial pathogens and toxins aswell as pork adulteration in meat products[J].J Food Drug Anal,2016,24(1):15-28.
[43]LIU G,ZHANGY,GUOW.Covalent functionalization of gold nanoparticlesas electronic bridges and signal amplifiers towards an electrochemical immunosensor for botulinum neurotoxin type A[J].Biosens Bioelectron,2014,61(21):547-553.
[44]CHAI C,LOOYOUNG L,PAUL T.Direct detection of the biological toxin in acidic environment by electrochemical impedimetric immunosensor[J].Sensors,2010,10(12):11414-11427.
[45]VISWANATHAN S,WU L C,HUANG M R,et al.Electrochemical immunosensor for cholera toxin using liposomes and poly(3,4-ethylenedioxythiophene)-coated carbon nanotubes[J].Anal Chem,2006,78(4):1115-1121.
[46]KAITTANIS C,SANTRA S,PEREZ J M.Emerging nanotechnology-based strategies for the identification of microbial pathogenesis[J].Adv Drug Deliv Rev,2010,62(5):408-423.
[47]CHIEN Y Y,JAN M D,ADAK A K,et al.Globotriose-functionalized gold nanoparticles as multivalent probes for Shiga-like toxin[J].ChemBioChem,2008,9(7):1100-1109.
[48]YOLA M L,GUPTA V K,Atar N.New molecular imprinted voltammetric sensor for determination of ochratoxin A[J].Mater Sci Eng C,2016,61:368-375.
[49]BONE L,VIDAL J C,DUATO P,et al.Ochratoxin A nanostructured electrochemical immunosensors based on polyclonal antibodies and gold nanoparticles coupled to the antigen[J].Anal Methods,2010,2(4):335-341.
[50]VIDAL J C,BONEL L,DUATO P,et al.Improved electrochemical competitive immunosensor for ochratoxin A with a biotinylated monoclonal antibody capture probe and colloidal gold nanostructuring[J].Anal Methods,2011,3(4):977-984.
[51]SINGH J,ROYCHOUDHURY A,SRIVASTAVA M,et al.A highly efficient rare earth metal oxide nanorods based platform for aflatoxin detection[J].J Mater Chem B,2013,1:4493-4503.
[52]CHAUHAN R,SINGH J,SOLANKI P R,et al.Electrochemical piezoelectric reusable immunosensor for aflatoxin B1 detection[J].Biochem Eng J,2015,103:103-113.
[53]SUNDAY C E,MASIKINI M,WILSON L,et al.Application on gold nanoparticles-dotted 4-nitrophenylazo graphemein a label-free impedimetric deoxynivalenol immunosensor[J].Sensors,2015,15(2):3854-3871.
[54]ROMANAZZO D,RICCI F,VOLPE G,et al.Development of a recombinant Fab-fragment based electrochemical immunosensor for deoxynivalenol detection in food samples[J].Biosens Bioelectron,2010,25(12):2615-2621.
[55]WANG Y,FEWINS P A,ALOCILJA E C.Electrochemical immunosensor using nanoparticle-based signal enhancement forEscherichiacoliO157:H7 detection[J].IEEE Sens J,2015,15(8):4692-4699.
[56]ABDALHAI M H,FERNANDES A M,XIA X,et al.Electrochemical genosensor to detect pathogenic bacteria(Escherichiacoli O157:H7) as applied in real food samples(fresh beef) toimprove food safety and quality control[J].J Agric Food Chem,2015,63(20):5017-5025.
[57]KIM G,MOON J H,MOH C Y,et al.A microfluidic nano-biosensor for the detection of pathogenicSalmonella[J].Biosens Bioelectron,2015,67:243-247.
[58]OZALP V C,BAYRAMOGLU G,ERDEM Z,et al.Pathogen detection in complex samples by quartz crystal microbalance sensor coupled to aptamer functionalized core-shell type magnetic separation[J].Anal Chim Acta,2015,853(1):533-540.
[59]GROSSMAN H L,MYERS W R,VREELAND V J,et al.Detection of bacteria in suspension by using a superconducting quantum interference device[J].Proc Natl Acad Sci USA,2004,101(1):129-134.
[60]WEIDEMAIER K,CARRUTHERS E,CURRY A,et al.Real-time pathogen monitoring during enrichment:a novel nanotechnology-based approach to food safety testing[J].Int J Food Microbiol,2015,198:19-27.
