食源性致病菌耐药机制研究进展
2018-04-11张昭寰刘海泉潘迎捷
赵 勇,李 欢,张昭寰,刘海泉,潘迎捷
(1.上海海洋大学 食品学院,上海 201306;2. 上海水产品加工及贮藏工程技术研究中心,上海 201306;3. 农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
近年来,食品安全已经成为全球社会最为关注的焦点问题,其中,食源性致病菌是危害食品安全与人类健康最重要的风险来源之一[1]。全球范围内常见的食源性致病菌主要包括:沙门氏菌、副溶血性弧菌、大肠杆菌和霍乱弧菌等,这些致病菌对人类健康造成了极大的危害。世界卫生组织(WHO)报告表明,全球每年爆发的食源性疾病中的70%是由致病性微生物污染食品而造成的,每年引起的死亡人数高达180万人[2]。抗生素作为20世纪最重要的医学发现之一,在食源性疾病的治疗中发挥了不可替代的作用,有效地降低了传染性疾病的发病率和致死率。但随着抗生素的过度和不规范使用,导致细菌的耐药性不断增强[3-4]。同时,抗生素的长期滥用还会诱导相关环境中产生抗生素抗性基因(antimicrobial resistance genes,ARGs),从而导致食品中的食源性致病菌产生耐药性甚至多重耐药性,这将导致更大的食品安全与公共卫生问题[5]。耐药性的食源性致病菌不仅加剧了治疗的难度和医疗负担,而且可以在食物链中传播,并可通过水平基因转移(horizontal gene transfer,HGT)机制随食物链进入人体,对人类健康和流行病的防治构成了严重的威胁[5-6]。
对于退行性膝关节骨性关节炎的患者,术前的心理护理是必不可少的,它可以减少患者的心理负担以及提高对本身疾病的认知,使患者更好地配合治疗,术后精心的基础及临床护理可以减少或避免术后并发症的发生,为以后的个体化的康复锻炼提供有力的支持及保障。因此,有效的心理护理、精心的基础和临床护理和个体化康复锻炼是康复的保证,能够使膝关节得到最大限度的功能恢复。
现阶段,食源性致病菌耐药性问题已经成为全球都关注的焦点问题。据估计,在欧洲每年有25 000人死于多重耐药菌感染,在美国每年超过200万人感染耐药性细菌且平均23 000人死亡[7-8]。2016年9月5日,在中国杭州举行的二十国集团(G20)领导人峰会通过的《二十国集团领导人杭州峰会公报》明确指出:“抗生素耐药性严重威胁公共健康、经济增长和全球经济稳定,并认为有必要从体现二十国集团自身优势的角度,采取包容的方式应对抗生素耐药性问题,以实证方法预防和减少抗生素耐药性,同时推动研发新的和现有的抗生素”[9]。 2017年“食品安全关键技术研发”重点专项申报指南中将“重要食源性致病菌耐药机制及传播规律研究”作为首要研究任务。要求针对我国食源性致病菌耐药性不断加重的严峻形势,重点关注水产品、畜禽产品等具有世界性优势的农产品,以食源性致病菌为对象,研究细菌耐药性产生与传播的机制。因此,为了克服日趋严重的食源性致病菌耐药性问题,对食源性致病菌的耐药机制进行系统的研究和阐释,具有十分重要的科研价值和实际意义。
本文中,笔者首先对细菌主要的4种耐药机制进行综述,包括降低细胞膜通透性机制、外排泵机制、药物靶标位点突变机制以及酶解作用机制,然后系统地回顾常见食源性致病菌耐药机制的研究进展,并对食源性致病菌耐药机制的进一步揭示进行了展望,以期为食源性致病菌耐药机制的深入研究提供基础资料,为食源性致病菌耐药性风险的控制提供科学依据。
1 细菌主要的4种耐药机制
在抗生素的刺激作用下,细菌会通过不同的方式与抗生素进行对抗,从而产生各种相应的耐药机制。本文中,笔者通过对国内外相关文献进行总结,绘制了细菌主要耐药机制的图谱(图1),如图1所示,细菌的耐药机制主要分为4类:降低细胞膜通透性机制、外排泵机制、药物靶标位点突变机制以及酶解作用机制[10-11]。现分述如下:
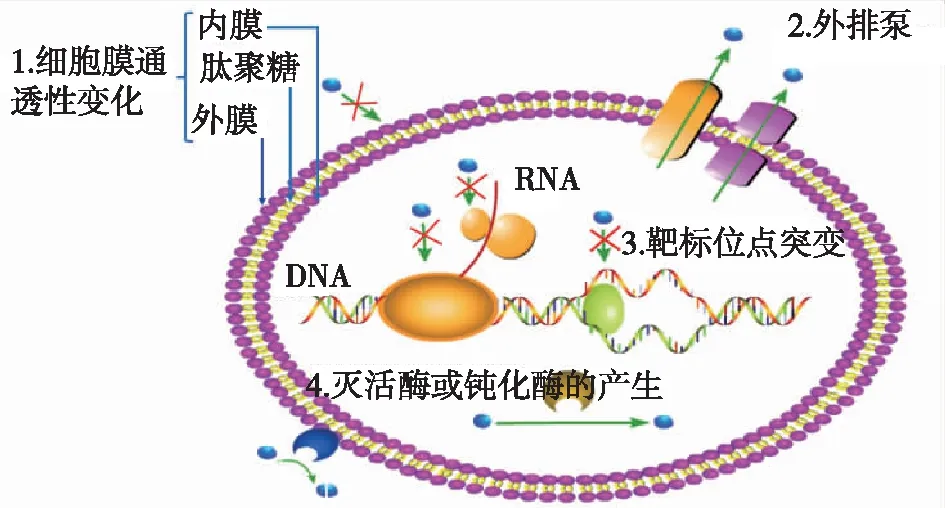
图1 细菌主要耐药机制[11]Fig.1 Mechanisms of antimicrobial resistance in bacterium
1.1 降低细胞膜通透性机制
抗生素进入细菌菌体必须通过菌体的外膜,因此,细菌菌体外膜的通透性直接影响着抗生素的作用效果。细菌可以通过选择性地减少外膜孔蛋白的数量、改变外膜孔蛋白的大小、增加细胞壁的厚度,来降低自身细胞膜的通透性,使得抗生素无法通过菌体的外膜,从而导致细菌对某些抗生素产生抗性[10-11]。例如,细菌的外膜孔蛋白OmpF是保证外膜正常通透性的重要因子,同时也是β-内酰胺类、四环素类、氟喹诺酮类和氯霉素类等抗生素进入细菌体内的主要通道。细菌在抗生素的刺激下,容易导致OmpF蛋白突变,造成OmpF蛋白的缺失,使细胞膜对上述抗生素的通透性下降,从而使抗生素失去相应的杀菌作用。这种通过降低细胞膜通透性而产生抗生素抗性的方式,是细菌最为常见的耐药机制之一,广泛存在于各类食源性致病菌之中[10]。
1.2 外排泵机制
外排泵是细菌的一种主动外排系统,是一类位于细菌细胞膜上具有特殊结构的膜转运蛋白。当菌体细胞内的抗生素达到一定浓度时,会刺激其外排泵的相关mRNA表达量增加,从而启动外排泵的主动外排功能,将抗生素排出菌体细胞之外。这种由细菌主动外排系统而导致的耐药机制,不具备抗生素的特异性,广泛针对多种抗生素,是细菌产生多重耐药性的主要机制。沙门氏菌、大肠杆菌及副溶血性弧菌等致病菌均具备抗生素主动外排系统[12],同一种细菌可存在多种主动外排系统。
与细菌耐药性有关的主动外排系统主要归于以下5类[12-14]:ATP结合盒转运体类(ATP-binding cassette,ABC)、主要易化超家族(major facilitator superfamily,MFS)、药物与代谢物转运体家族(drug metabolite transporter superfamily,DMT)中的小多重耐药家族(small multidrug resistance family,SMR)、多重药物与毒物外排家族(multidrug and toxic compound extrusion family,MATE)、耐受-生节-分裂家族(resistance-nodulation division family,RND)。
1.3 靶标位点突变机制
细菌体内存在许多与抗生素结合的靶标位点,不同种类抗生素的作用靶点不同,细菌可以通过改变相应的作用靶点,使抗生素与细菌不易结合而产生耐药性。如喹诺酮类抗生素最主要的作用靶点是DNA旋转酶和拓扑异构酶Ⅳ,其位点的改变可降低细菌与喹诺酮类抗生素的结合能力,使得细菌产生相应耐药性[11]。β-内酰胺类抗生素的作用靶标为青霉素结合蛋白PBP,细菌可促使PBP蛋白发生突变而产生耐药性[10]。氨基糖苷类、大环内酯类及四环素类等抗生素主要作用靶点为细菌的核糖体,细菌通过其核糖体亚基中mRNA及蛋白质的突变,可对上述几种抗生素产生相应的耐药性。
生物量是衡量微藻产业化的重要条件之一。而叶绿素是海洋微藻光合作用的基础,是描述海洋微藻将无机物质转变为有机物质能力的一个重要指标,可以作为衡量生物量积累的参考[14]。6株微藻的生长情况如图5所示。
1.4 酶解作用机制
细菌针对不同的抗生素可产生相应的灭活酶或钝化酶,这些酶类通过酶切或化学修饰致使抗生素失活,这种细菌耐药机制称为“酶解作用机制”。目前,细菌产生的抗生素灭活酶或钝化酶主要包括:β-内酰胺酶、氯霉素乙酰转移酶、氨基糖苷类钝化酶和糖肽类钝化酶[10]。现阶段对于β-内酰胺酶研究最为深入,β-内酰胺酶是细菌对β-内酰胺类抗生素耐药的主要原因。β-内酰胺酶包括染色体介导酶和耐药质粒介导酶两大类,以其水解对象划分可分为青霉素酶、头孢菌素酶、广谱酶和超广谱酶4种[10]。不同的β-内酰胺酶基因还可以通过质粒、转座子等发生转移,在细菌之间相互传播,造成更严重的细菌耐药性。
2 常见食源性致病菌耐药机制研究进展
在全球范围内,最为常见食源性致病菌主要有沙门氏菌、副溶血性弧菌、大肠杆菌和霍乱弧菌等,这些致病菌是导致食源性疾病的重要因素,严重影响着食品安全,对人类健康造成了极大的风险隐患;而具有耐药性甚至多重耐药性食源性致病菌的出现,更加剧了其治疗的困难性和经济成本,为食源性疾病的有效控制带来了更艰巨的挑战。因此,本文选择常见的4种食源性致病菌作为研究对象,对其耐药机制的研究现状进行总结及综述,为食源性致病菌耐药性风险的控制提供科学的理论基础。
2.1 沙门氏菌耐药机制研究进展
[28]RENSCH U,NISHINO K,KLEIN G,et al.Salmonellaenterica serovar Typhimurium multidrug efflux pumps EmrAB and AcrEF support the major efflux system AcrAB in decreased susceptibility to triclosan[J].Int J Antimicrob Agents,2014,44(2):179-180.
2.1.1沙门氏菌耐药现状
沙门氏菌的耐药性问题已经引起了世界范围内研究者的高度重视,自20世纪70年代开始,研究人员就开始对沙门氏菌的耐药性进行调查。2003年,White等[19]对158株美国零售肉类狗粮中分离的沙门氏菌进行耐药性研究,发现大部分菌株都具有耐药性。2007年,Aarestrup等[20]分析了来自于丹麦、泰国和美国食品中的581株沙门氏菌,发现其中大部分存在多重耐药现象。2011年,Brichta-Harhay等[21]从牛体内分离了16 218株沙门氏菌,发现不同血清型的沙门氏菌存在不同比例的多重耐药现象。2014年,Lai等[22]从中国鸡、鸭和猪等动物中分离了465株沙门氏菌,发现沙门氏菌对不同种类的抗生素均有不同程度的耐药现象,且有近29%的菌株耐10种以上抗生素。综合分析国内外沙门氏菌耐药性的研究现状,可以发现沙门氏菌对不同种类的抗生素均具有不同程度的耐药性,且耐药现象日趋严重。
2.1.2沙门氏菌的耐药机制
研究沙门氏菌的耐药机制是控制沙门氏菌耐药性及多重耐药性产生的必要途径。本文中,笔者针对细菌常见的4种耐药机制:降低细胞膜通透性机制、靶标位点突变机制、外排泵机制和酶解作用机制,对沙门氏菌耐药机制的研究现状进行了详细的分析,并将相关研究总结于表1。
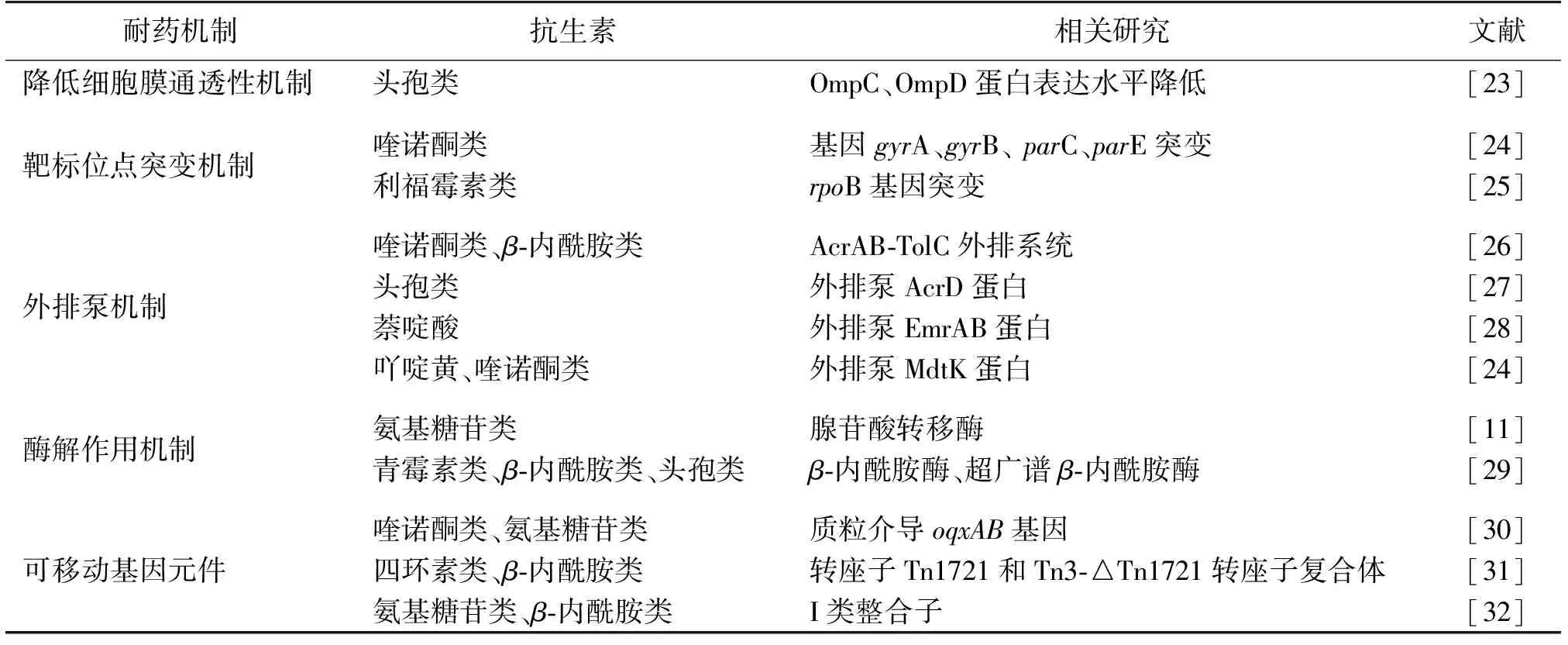
表1 沙门氏菌耐药机制的研究进展
由表1可知:降低细胞膜通透性是沙门氏菌产生耐药性的原因之一。2011年,Hu等[23]对鼠伤寒沙门氏菌进行了研究,发现细胞外膜孔道蛋白OmpC和OmpD表达水平的降低,可减少对头孢曲松钠抗生素的亲和力,使得抗生素无法进入沙门氏菌细胞内,从而产生了耐药性。
沙门氏菌可通过改变抗生素作用靶标位点,使抗生素无法识别,从而产生耐药性,这是沙门氏菌产生耐药性的一个重要原因。目前对该机制的研究主要是喹诺酮类药物的耐药机制。喹诺酮类药物对沙门氏菌最主要的作用靶位是DNA旋转酶和拓扑异构酶IV[24]。基因gyrA、gyrB、parC和parE的突变均可导致沙门氏菌对喹诺酮类药物抗性的产生,且gyrA和parC基因的突变起主导作用[24]。此外,编码沙门氏菌RNA聚合酶β-亚基的rpoB基因发生突变时,会使利福平失去结合位点,因其无法结合而导致菌株产生抗性[25]。因此,深入研究抗生素作用靶标基因的变化,对抗生素靶标的选择和新抗生素的开发都十分重要。
AcrAB-TolC系统是与沙门氏菌耐药相关的主动外排系统[26]。沙门氏菌中acrB基因的过度表达,会导致其对喹诺酮等类抗生素外排作用增强。与此同时,转录激活子marA和soxS的过度表达对外膜孔蛋白OmpF具有负调控作用,使得抗生素无法进入细胞。因此,AcrAB-TolC主动外排系统过度表达会使得沙门氏菌耐药性明显增强[26]。此外,AcrD、EmrAB和MdtK等外排泵系统的过度表达均会使得沙门氏菌对头孢类、萘啶酸、吖啶黄和喹诺酮类等不同种类抗生素的抗性增强[24,27-28]。
腺苷酸转移酶、磷酸转移酶和乙酰转移酶均是沙门氏菌对氨基糖苷类抗生素耐药的相关酶[10]。研究发现,aadA和aadB基因分别编码的3-羟基和2-羟基腺苷酸转移酶,导致沙门氏菌对链霉素等氨基糖苷类抗生素产生耐药性[11];沙门氏菌中blaTEM-1和blaSHV-1基因编码产生的β-内酰胺酶,可有效水解青霉素和非广谱头孢菌素类抗生素[10-11,29];而产生的超广谱β-内酰胺酶(extended spectrumβ-lactamases,ESBLs)对头孢菌素等类抗生素水解,这使得临床上对沙门氏菌的治疗越来越困难。
根据稻曲病毒素容易附着在稻种表面的特性,在稻谷播种前,一定要对稻种进行适度紫外线高温或太阳紫外线杀菌处理,或者是用药剂消毒浸种,药剂可以选用强氯精消毒浸种,也可以选用石灰和多菌灵,或用50%甲基托布津可湿性粉剂500倍液浸种24 h,然后捞出催芽、播种。
除以上4种常见耐药机制之外,与沙门氏菌耐药性有关的可移动基因元件包括质粒、转座子和整合子等。这些可移动基因元件携带的耐药基因,可以在沙门氏菌间以基因水平转移的方式进行传播,从而导致沙门氏菌耐药性不断增强。Kao等[30]研究发现,沙门氏菌中携带由质粒介导的oqxAB多重耐药基因,该基因的过度表达会使沙门氏菌对环丙沙星等喹诺酮类抗生素产生抗性。携带耐药基因的可自由移动的转座子也可导致沙门氏菌耐药性不断增强。Pezzella等[31]研究发现,含有四环素抗性基因tetA的转座子Tn1721和含有β-内酰胺类抗生素抗性基因blaTEM-1的Tn3-△Tn1721转座子复合体已经在不同来源的沙门氏菌中检出。整合子作为一种基因捕获和表达的遗传基因单位,可定位于转座子或质粒上,通过转座子或质粒将多种耐药基因在细菌中水平传播。在沙门氏菌中Ⅰ类整合子最为普遍,可同时携带多个耐药基因,从而产生对氨基糖苷类和β-内酰胺类等抗生素的抗性[32]。
2.2 副溶血性弧菌耐药机制研究进展
副溶血性弧菌(Vibrioparahaemolyticus)属于弧菌科弧菌属,是一种常见的食源性致病菌[33]。食用被副溶血性弧菌污染的水产品极易导致严重的急性肠胃炎,临床上主要表现为恶心、腹泻、腹痛和呕吐等症状。副溶血性弧菌引起的食物中毒事件在世界各地频繁发生,尤其以沿海城市为主,被视为全球范围内腹泻类疾病暴发的主要原因之一[33-34]。
2.2.1副溶血性弧菌耐药现状
综合分析国内外副溶血性弧菌耐药性的研究可知,水产品及相关水环境中副溶血性弧菌的耐药现象相对较为普遍。Xie等[35]通过对即食食品中分离的副溶血性弧菌进行研究,发现该菌对链霉素、氨苄西林和头孢唑啉等不同种类抗生素具有不同程度耐药性,其中对链霉素和氨苄西林耐药性较强。Lou等[36]研究海产品中分离的副溶血性弧菌,发现其对氨苄西林等β-内酰胺类抗生素高度耐受,对较早使用的抗生素如头孢类也具有抗性。抗生素过度使用可能是导致菌株产生耐药性的主导因素,Boinapally等[37]研究养殖虾与野生海捕虾中分离的致病菌耐药状况,发现养殖虾中分离的致病菌耐药程度要比野生海捕虾严重。Xie等[38]对分离自水产品与临床的副溶血性弧菌进行研究,发现不同来源的菌株均有较高的耐药性,且临床菌株的耐药程度较高。Li等[39]对分离自上海腹泻病人的副溶血性弧菌进行耐药性监测,发现副溶血性弧菌对氨苄西林和链霉素等多种抗生素的耐药性明显较高,且92.9%的菌株耐5种以上的抗生素。
现存问题中班期不稳定及运价不透明主要是由于约束力不强、运量不确定,进而使得货主无法确定深圳港水上“巴士”的经济性,降低了客户订舱的信心;航线覆盖不周主要是由于未覆盖码头历年运量不足,但随着经济的发展,部分港口已具备开通航线的条件,而相关部门未能及时了解该部分码头开通水上“巴士”的经济性;对港口影响力不足主要是由于相关部门对深圳港水上“巴士”的宣传力度小,其经济性未能得到广大客户的熟知与认可.因此,本文从深圳港水上“巴士”经济性角度深入分析深圳港水上“巴士”的优劣势,以提出科学合理的改善对策,解决深圳港水上“巴士”的现存问题.
《论领导力》这本大师级别的经典智慧,刚好可以献给那些愿意沉下心来,为中国梦认真部署下一代中国长寿企业的领导者。
2.2.2副溶血性弧菌的耐药机制
目前对副溶血性弧菌耐药机制主要有靶标位点突变机制、外排泵机制及可移动基因元件等方面(表2)。其中,靶标位点突变机制是副溶血性弧菌产生耐药性的一个重要原因。副溶血性弧菌与沙门氏菌相似,喹诺酮类药物作用靶位也是DNA旋转酶和拓扑异构酶Ⅳ,且gyrA和parC基因的突变在其耐药性的产生中起主导作用[24]。
夏日的夜晚,明净的月亮挂在天空,皎洁的月光洒在荷塘里,池面平静得如明镜一般,满塘月色。朵朵荷花挺立在水中央,池塘边传来阵阵虫鸣,蟋蟀愉快地叫着,蝈蝈欢快地开着“演唱会”,青蛙也随着美妙的乐曲声在水面荷叶上一蹦一跳,展现出优美的舞姿,打破了水面的平静。

表2 副溶血性弧菌耐药机制的研究进展
外排泵机制是副溶血性弧菌产生多重耐药性的主要机制。Piddock等[13]研究发现副溶血性弧菌的MATE外排泵中NorM蛋白过度表达,使其对诺氟沙星和环丙沙星等抗生素产生抗性。VmrA是副溶血性弧菌另一个外排泵蛋白,主要介导副溶血性弧菌对吖啶黄等抗生素的耐药作用[40]。据报道,副溶血性弧菌具有多种RND家族外排泵[12]。如,RND家族中的VmeAB-VpoC蛋白,若菌株中缺少编码该蛋白的基因,则会使其对大环内酯类抗生素的耐药性显著降低[41]。从基因组序列获得的数据估计,副溶血性弧菌中含有约50种耐药外排泵,这也表明在副溶血性弧菌耐药的外排泵机制方面还有很多研究空间[12],外排泵在细菌耐药性方面发挥了重要作用。
可移动基因元件是副溶血性弧菌获得耐药性的重要因素,与副溶血性弧菌耐药有关的可移动基因元件包括质粒和整合子等。Taketoshi等[42]对副溶血性弧菌携带的耐药质粒PSA55进行了研究,发现该质粒介导的菌株对四环素类、氨基糖苷类等抗生素具有抗性。Spagnoletti等[43]研究发现,耐药的副溶血性弧菌中携带了SXT元件。Ceccaralli等[44]从耐甲氧苄氨嘧啶的临床副溶血弧菌中发现了含dfrA15基因盒的整合子。
2.3 大肠杆菌耐药机制研究进展
大肠杆菌(Escherichiacoli),又被称为大肠埃希氏菌,是肠杆菌科埃希氏菌属的代表菌。大肠杆菌是临床上最常见的食源性致病菌之一,也是近年来食品卫生及流行病学领域重要的研究对象之一[45-46]。
2.3.1大肠杆菌耐药现状
目前,由于抗生素的过度和不规则使用,导致大量耐药菌株不断出现,并且呈现出高水平耐药、多重耐药和交叉耐药的严重发展态势。2012年,Tadesse等[47]对来源于临床病人和家畜中的1 729株大肠杆菌进行了耐药性研究,发现其多重耐药率由20世纪50年代的7.2%上升到了63.6%。2012年,Su等[48]研究了我国南部分离的3 456株大肠杆菌,发现其中89.1%大肠杆菌具有耐药性,且87.5%菌株耐3种以上的抗生素。同时发现,临床分离的大肠杆菌的耐药情况更为严重[50]。我国卫生部全国细菌耐药监测网的2010年度报告显示[50],分离的4 241株大肠杆菌对头孢菌素类和喹诺酮类抗生素耐药率均超过50.0%,其中对环丙沙星、左氧氟沙星和复方新诺明的耐药率为60%左右。大肠杆菌耐药性的出现,一方面会给临床治疗带来巨大的困难;另一方面,耐药菌株可通过食物链转移到人体,从而对人类的健康和公共卫生安全构成潜在的威胁。因此,进一步研究大肠杆菌的耐药机制,可为降低治疗成本、增强临床治疗效果提供一定保障。
2.3.2大肠杆菌耐药机制
大肠杆菌的获得性耐药包括细胞膜通透性改变、靶标位点突变、外排泵机制以及酶解作用等四类。喹诺酮类抗生素是治疗大肠杆菌引发疾病的主要药物之一。随着学者们深入的研究,发现此类药物的耐药性具有多重机制。如,靶位蛋白的突变、主动外排系统表达的增强和外膜孔蛋白的缺失等均是大肠杆菌对喹诺酮类抗生素产生抗性的重要因素[10]。研究表明,β-内酰胺类、四环素类、氯霉素、氨基糖苷类和喹诺酮类抗生素等均主要通过大肠杆菌外膜孔蛋白(OmpF和OmpC,主要是OmpF)进入细胞内发挥作用[23-24]。然而,膜通透性的降低仅能引起大肠杆菌低程度的耐药,多重耐药主要与主动外排系统有关。目前,大肠杆菌主动外排系统主要包括RND类7种、MFS类4种、SMR类4种、MATE类3种及ABC类7种[12,26,51-52]。超广谱β-内酰胺酶、NDM-碳青霉烯酶等对β-内酰胺类抗生素的酶解作用也是大肠杆菌产生耐药性的途径之一[53-54]。近年来,研究者发现了由质粒介导的喹诺酮耐药机制,且已在临床菌株中得到了证实。2015年,Liu等[55]发现由质粒所携带的mcr-1基因,该基因能够在不同菌株间进行水平转移,从而导致其产生“获得性耐药”。大肠杆菌耐药机制研究进展如表3所示。

表3 大肠杆菌耐药机制的研究进展
2.4 霍乱弧菌耐药机制研究进展
霍乱弧菌(Vibriocholera)是一种革兰氏阴性细菌,根据O抗原的不同可分为210多个血清群,其中O1群和O139群产毒株是引起霍乱大流行的主要血清型菌株。霍乱弧菌是导致急性霍乱性腹泻的病原体,主要经过污染的食物和水源传播[56-57]。
2.4.1霍乱弧菌耐药现状
霍乱弧菌主要由两种外排泵介导对多种抗生素产生耐药性。其中,一类以ATP水解供能,一类依靠质子泵供能。前者包括ABC外排泵,如ABC外排泵-VcaM蛋白,主要介导对四环素和诺氟沙星等的耐药性[61];后者主要包括有MATE、MFS和RND外排泵[12,62]。MFS家族外排蛋白EmrD-3能够介导对利奈唑胺、利福平、红霉素和氯霉素的耐药性[63]。RND泵出系统主要由vexRAB、vexCD、vexEF、vexGH、vexIJK和vexLM等6种操纵子进行编码,对多种代谢底物具有特异性,介导对多粘菌素B、红霉素和青霉素的耐药性[64]。
配合画展的《谭建丞山水册页精品集》收录了谭老山水画册页126件,是1968年到1972年期间所创作,由思澂斋出版。■
2.4.2霍乱弧菌耐药机制
目前对霍乱弧菌耐药机制的研究主要有靶标位点突变机制、外排泵机制及可移动基因元件等方面。Kim等[59]研究发现,仅具有gyrA基因突变的霍乱弧菌在用喹诺酮类抗菌药物治疗的过程中,逐渐发生parC基因突变,并随之对喹诺酮类药物产生耐药性。Kitaoka等[60]研究进一步证实,编码DNA旋转酶和拓扑异构酶Ⅳ的gyrA和parC基因同时发生突变时,霍乱弧菌对喹诺酮类抗生素具有抗性。
Yu等[58]研究了1993—2009年于患者中分离的O139群霍乱弧菌,发现最初的O139群霍乱弧菌产毒株对链霉素、复方磺胺甲恶唑和多粘菌素B等均有耐药性,且自1998年开始便出现了普遍的多重耐药现象。然而,同时期的O1群霍乱弧菌和环境来源的霍乱弧菌均未发现明显的多重耐药现象。因此,在霍乱防治工作中,应进一步加强对O139群霍乱弧菌的耐药性监测,掌握O139群霍乱弧菌的耐药谱变化。
在治疗霍乱弧菌感染的过程中,携带耐药基因的可移动基因元件同样会介导霍乱弧菌对多种抗生素产生耐药性[65]。如,SXT元件,能够在不同细菌间通过基因片段的结合来改变耐药性状。Spagnoletti等[43]对霍乱弧菌进行耐药性研究,发现多重耐药的霍乱弧菌携带了SXT元件和整合子,且SXT元件在霍乱弧菌的耐药性传递中起重要作用。Kitaoka等[60]发现霍乱弧菌的多重耐药质粒中也携带了可移动的Ⅰ、Ⅱ类整合子。同样,由Marin等[56]报道可知,质粒因同时携带了耐药基因dfrA1(对甲氧苄氨嘧啶耐药)、sulII(对磺胺耐药)和strA/B(对链霉素耐药),而导致对上述抗生素多重耐药性。对霍乱弧菌耐药机制的研究进展总结见表4。

表4 霍乱弧菌耐药机制的研究进展
3 总结与展望
综上所述,食源性致病菌主要的耐药机制包括:降低细胞膜通透性机制、外排泵机制、药物靶标位点突变机制、酶解作用以及可移动基因元件在种间传播等。现阶段,科研人员针对食源性致病菌耐药性和耐药机制,已经开展了一系列较为深入系统的研究,但是还有一大部分细菌耐药性现象尚属于未解之谜,亟待于进一步的探索与挖掘。深入地研究食源性致病菌新的耐药机理,有助于新型抗生素类药物的开发与生产、细菌耐药性预防与控制,这是未来科学研究的热点问题。基于日趋严重的食源性致病菌耐药性问题,笔者建议今后关于食源性致病菌耐药机制的探索研究应集中在以下几个方面:
3.1 针对食源性致病菌耐药异质性展开研究
食源性致病菌对抗生素的耐药性存在“异质性”的现象,指的是同种食源性致病菌的菌株之间存在耐药性差异[35-36,47-48]。造成这一现象的原因可能是:在不同抗生素种类或浓度的压力下,细菌自身的基因或蛋白发生随机突变,从而产生不同的耐药性。食源性致病菌存在耐药异质性,是临床环节中抗生素治疗失败的主要因素之一。应当针对这一现象,开展大规模的食源性致病菌耐药性普查,构建食源性致病菌耐药信息数据库,寻找食源性致病菌产生耐药异质性的规律,从而揭示其潜在的耐药机制。
(55)三瓣苔 Tritomaria exsecta(Schmid.)Schiffn.刘胜祥等(1999)
3.2 进一步针对食源性致病菌耐药基因转移机制进行研究
风险评估是风险分析的核心组成部分,是评估、管理和控制细菌耐药性的一个重要技术手段。许多发达国家(如美国、丹麦、英国和澳大利亚等),已经开展并完成了一系列的动物源细菌耐药性风险评估工作,并取得了一定的成果,然而现阶段对于食源性致病菌耐药性风险评估的研究还相对较少。通过对食源性致病菌的耐药表型和耐药基因型进行分析,并采用数学模型研究耐药基因的转移规律,开展食源性致病菌耐药性风险评估,有助于从“风险”的角度解释其耐药性形成的机制,从而有效控制耐药性食源性致病菌对人类健康带来的风险。
3.3 食源性致病菌生物被膜中耐药产生与进化的研究
细菌能够形成复杂三维结构的生物被膜,增强其对外界压力的抵抗性,能够有效地阻止抗生素向生物被膜内部渗透,从而导致细菌耐药性的产生[67]。大部分食源性致病菌都能够形成生物被膜,这不仅增大了食品清洗和消毒的难度,而且提升了食源性致病菌产生耐药性的风险。但是,现阶段对于食源性致病菌耐药性与生物被膜之间的相关性研究还十分匮乏,尤其是对于食源性致病菌生物被膜中耐药性的产生、传播及进化规律的研究尚属于空白。因此,应该从食源性致病菌生物被膜微观结构、形成能力及表达调控等方面出发,深入地探究其与食源性致病菌耐药性形成的关系,为食源性致病菌耐药机制的揭示提供新的理论依据。
3.4 建立食源性致病菌耐药性风险评估体系
食源性致病菌的耐药基因转移机制包括垂直基因转移和水平基因转移,所谓垂直基因转移指的是亲代的耐药基因通过染色体垂直传递给子代,即一代的细胞分裂成下一代的细胞,遗传物质直接向下一代转移的现象;而水平基因转移是相对于基因垂直转移而提出的,指的是细菌通过质粒或转座子水平转移而获得外源耐药基因的过程[66]。耐药基因转移是食源性致病菌形成耐药性的重要原因,探究抗生素胁迫下食源性致病菌耐药基因动态转移过程及耐药性微进化趋势,是阐明自然条件下食源性致病菌获得性耐药性机制的关键,不仅可以为我们合理使用抗生素药物提供理论基础,还可为防控食源性致病菌耐药性提供良好的分子靶标。
3.5 综合运用多组学技术并结合系统生物学理论揭示食源性致病菌的耐药机制
现阶段,基因组学、转录组学、蛋白质组学和代谢组学等组学技术蓬勃发展,已经形成了多组学联合使用的系统生物学研究模式,这必将成为探究食源性致病菌耐药新机制的重要手段。研究表明,细菌对抗生素产生抗性通常是由于两种或两种以上的耐药机制相互作用而形成的,所以应当综合运用系统生物学中多组学的方法,探究食源性致病菌由抗生素敏感状态转变为耐药过程中基因、转录、蛋白及代谢层面的变化,从而揭示更深层次的食源性致病菌耐药机制。
参考文献:
[1]VELUSAMY V,ARSHAK K,KOROSTYNSKA O,et al.An overview of foodborne pathogen detection:in the perspective of biosensors[J].Biotechnol Adv,2010,28(2):232-254.
[2]WHO.Second formal meeting of the Foodborne Disease Burden Epidemiology Reference Group(FERG):appraising the evidence and reviewing initial results[EB/OL].[2017-06-05].http:∥www.who.int/foodsafety/publications/fergz/en/(2009).
[3]DAVIES J,DAVIES D.Origins and evolution of antimicrobial resistance[J].Microbiol Mol Biol Rev,2010,74(3):417-433.
[4]JEAN S S,HSUEH P R.High burden of antimicrobial resistance in Asia[J].Int J Antimicrob Agents,2011,37(4):291-295.
[10]BLAIR J M A,WEBBER M A,BAYLAY A J,et al.Molecular mechanisms of antimicrobial resistance[J].Nat Rev Microbiol,2015,13(1):42-51.
[6]World Economic Forum.Global Risks 2014 Report[EB/OL].[2017-05-29].http://www3.weforum.org/docs/WEF Global Risks Report_2014.pdf.
[7]World Health Organization.Antimicrobial resistance:global report on surveillance 2014[EB/OL].[2017-05-29].http://www.who.int/drugresistance/documents/surveillancereport/en/(2014).
从试验结果可以看出,两组沥青混合料均表现出良好的水稳定性。加入MY沥青砂添加剂后,沥青混合料的劈裂强度比增大,表明加入MY沥青砂添加剂的沥青混合料的抗水损害能力比未添加MY沥青砂的沥青混合料抗水损害能力高,进一步说明MY沥青砂添加剂的掺入改善了沥青路面的水稳定性能。
[8]HAMPTON T.Report reveals scope of US antibiotic resistance threat[J].JAMA,2013,310(16):1661-1663.
[9]张天宇,谢建平,王明贵.抗生素耐药研究领域的机遇和挑战[J].遗传,2016,38(10):857-858.
在深圳,半日闲。十五年前,利用休假的机会在这个城市住了十几天,接触了不少在这里打拼的人士,听闻过他们别样的酸甜苦辣。一晃这么多年过去,除了有一年从这里转过一次飞机,再没踏上这块土地。这一次,同样是来去匆匆,这难得的半天,不能浪费了。
[5]娄阳,张昭寰,肖莉莉,等.食品源抗生素抗性基因的来源与分布状况研究进展[J].食品工业科技,2015,36(12):368-374.
[11]ALLEN H K,DONATO J,WANG H H,et al.Call of the wild:antimicrobial resistance genes in natural environments[J].Nat Rev Microbiol,2010,8(4):251-259.
[12]LI X Z,ELKINS C A,ZGURSKAYA H I.Efflux-mediated antimicrobial resistance in bacteria:mechanisms,regulation and clinical implications[J].Springer International Publishing,2016,56(1):20-51.
[13]PIDDOCK L J V.Multidrug-resistance efflux pumps:not just for resistance[J].Nat Rev Microbiol,2006,4(8):629-636.
[14]FLETCHER J I,HABER M,HENDERSON M J,et al.ABC transporters in cancer:more than just drug efflux pumps[J].Nat Rev Cancer,2010,10(2):147-156.
[15]HSIAO A,TOY T,SEO H J,et al.Interaction betweenSalmonellaand Schistosomiasis:a review[J].PLoS Pathog,2016,12(12):e1005928.
[16]PARRY C M.Antimicrobial drug resistance inSalmonellaenterica[J].Curr Opin Infect Dis,2003,16(5):467-472.
[17]HUANG D B,DUPONT H L.Problem pathogens:extra-intestinal complications ofSalmonellaentericaserotype Typhi infection[J].Lancet Infect Dis,2005,5(6):341-348.
[18]FRESNO M,BARRETO M,GUTIERREZ S,et al.Serotype-associated polymorphisms in a partialrpoB gene sequence ofSalmonellaenterica[J].Can J Microbiol,2014,60(3):177-181.
[19]WHITE D G,DATTA A,MCDERMOTT P,et al.Antimicrobial susceptibility and genetic relatedness ofSalmonellaserovars isolated from animal-derived dog treats in the USA[J].J Antimicrobiol Chemoth,2003,52(5):860-863.
第一,安全层面。一是国防安全,南海诸岛是中国国土的最南端也是南大门,其与海南岛之间的海域构成了中国的南部防御纵深,一旦失去,海南岛将成为防御前沿。二是经济安全。中国从中东、非洲等地进口原油的80%都要从南海海域和其南端的马六甲海峡通过,数据显示每日经过该区域的船只中有60%属于中国,因此可谓中国最重要的海运通道。[27]因此南海区域攸关中国的能源供应与对外贸易安全。
[20]AARESTRUP F M,HENDRIKSEN R S,LOCKETT J,et al.International spread of multidrug-resistantSalmonellaSchwarzengrund in food products[J].Emerg Infect Dis,2007,13(5):726-731.
[21]BRICHTA-HARHAY D M,ARTHUR T M,BOSILEVAC J M,et al.Diversity of multidrug-resistantSalmonellaentericastrains associated with cattle at harvest in the United States[J].Appl Environ Microbiol,2011,77(5):1783-1796.
[22]LAI J,WU C,WU C,et al.Serotype distribution and antimicrobial resistance ofSalmonellain food-producing animals in Shandong province of China,2009 and 2012[J].Int J Food Microbiol,2014,180:30-38.
[25]KEYS C,KEMPER S,KEIM P.Highly diverse variable number tandem repeat loci in theE.coliO157:H7 and O55:H7 genomes for high-resolution molecular typing[J].J Appl Microbiol,2005,98(4):928-940.
[24]LI X Z,PLÉSIAT P,NIKAIDO H.The challenge of efflux-mediated antimicrobial resistance in gram-negative bacteria[J].Clin Microbiol Rev,2015,28(2):337-418.
[23]HU W S,CHEN H W,ZHANG R Y,et al.The expression levels of outer membrane proteins STM1530 and OmpD,which are influenced by the CpxAR and BaeSR two-component systems,play important roles in the ceftriaxone resistance ofSalmonellaentericaserovar Typhimurium[J].Antimicrob Agents Chemoth,2011,55(8):3829-3837.
综合组:男11例,女8例;年龄20-66岁,平均(41.53±3.30)岁;病程1个月-6年,均值(3.64±0.67)年。
[26]BLAIR J M A,BAVRO V N,RICCI V,et al.AcrB drug-binding pocket substitution confers clinically relevant resistance and altered substrate specificity[J].Proc Natl Acad Sci USA,2015,112(11):3511-3516.
[27]HORIYAMA T,YAMAGUCHI A,NISHINO K.TolC dependency of multidrug efflux systems inSalmonellaentericaserovar Typhimurium[J].J Antimicrob Chemoth,2010,65(7):1372-1376.
沙门氏菌(Salmonella)是一百多年前发现的一种病原体,它不仅可以引起急性胃肠炎,还能引起伤寒、败血症等多种疾病。在世界各地的食物中毒的病例中,由沙门氏菌引起的中毒病例占首位或第二,由此可见,沙门氏菌是一种常见的重要的食源性致病菌[15-16]。该菌广泛分布于各类食品之中,如禽蛋类、乳制品和水产品等,还能寄居在人和动物的肠道中,并随排泄物再次污染食品和环境,给人类健康造成了极大的威胁[17-18]。
模型使用FlowDroid[6]进行实现污点传播路径的寻找。FlowDroid是基于流分析技术的隐私泄露分析工具,它对Android应用程序的生命周期做了完整建模,并构建了一个虚拟dummyMainMethod方法来模拟生命周期,在对应用内的Sources点及Sinks点做了标记后,使用过程间数据流分析技术寻找这些点间的传播路径。
[29]GEBREYES W A,THAKUR S.Multidrug-resistantSalmonellaentericaserovar Muenchen from pigs and humans and potential interserovar transfer of antimicrobial resistance[J].Antimicrob Agents Chemoth,2005,49(2):503-511.
[30]KAO C Y,CHEN C A,LIU Y F,et al.Molecular characterization of antimicrobial susceptibility ofSalmonellaisolates:first identification of a plasmid carryingqnrD oroqxAB in Taiwan[J].J Microbiol Immunol Infect,2015,50(2):214-223.
[31]PEZZELLA C,RICCI A,DIGIANNATALE E,et al.Tetracycline and streptomycin resistance genes,transposons,and plasmids inSalmonellaentericaisolates from animals in Italy[J].Antimicrob Agents Chemoth,2004,48(3):903-908.
[32]GILLINGS M R.Class 1 integrons as invasive species[J].Curr Opin Microbiol,2017,38:10-15.
[33]LETCHUMANAN V,CHAN K G,LEE L H.Vibrioparahaemolyticus:a review on the pathogenesis,prevalence,and advance molecular identification techniques[J].Front Microbiol,2014,5:705.
[34]HUBBARD T P,CHAO M C,ABEL S,et al.Genetic analysis ofVibrioparahaemolyticusintestinal colonization[J].Proc Natl Acad Sci USA,2016,113(22):6283-6288.
[35]XIE T,XU X,WU Q,et al.Prevalence,molecular characterization,and antimicrobial susceptibility ofVibrioparahaemolyticusfrom ready-to-eat foods in China[J].Front Microbiol,2016,7:549.
[36]LOU Y,LIU H,ZHANG Z,et al.Mismatch between antimicrobial resistance phenotype and genotype of pathogenicVibrioparahaemolyticusisolated from seafood[J].Food Control,2016,59:207-211.
[37]BOINAPALLY K,JIANG X.Comparing antimicrobial resistance in commensal and pathogenic bacteria isolated from wild-caught South Carolina shrimps vs.farm-raised imported shrimps[J].Can J Microbiol,2007,53(7):919-924.
[38]XIE T,WU Q,ZHANG J,et al.Comparison ofVibrioparahaemolyticusisolates from aquatic products and clinical by antimicrobial susceptibility,virulence,and molecular characterization[J].Food Control,2017,71:315-321.
[39]LI H,TANG R,LOU Y,et al.A comprehensive epidemiological research for clinicalVibrioparahaemolyticusin Shanghai[J].Front Microbiol,2017,8:1043.
[40]CHEN J,MORITA Y,HUDA M N,et al.VmrA,a member of a novel class of Na+-coupled multidrug efflux pumps fromVibrioparahaemolyticus[J].J Bacteriol,2002,184(2):572-576.
[41]MATSUO T,NAKAMURA K,KODAMA T,et al.Characterization of all RND-type multidrug efflux transporters inVibrioparahaemolyticus[J].MicrobiologyOpen,2013,2(5):725-742.
[42]TAKETOSHI A,HAMASHIMA H,HASEGAWA H.Isolation of a new drug-resistance plasmid from a strain ofVibrioparahaemolyticus[J].Microbiol Immunol,1985,29(2):103-112.
[43]SPAGNOLETTI M,CECCARELLI D,RIEUX A,et al.Acquisition and evolution of SXT-R391 integrative conjugative elements in the seventh-pandemicVibriocholeraelineage[J].mBio,2014,5(4):e01356-14.
[44]CECCARELLI D,SALVIA A M,SAMI J,et al.New cluster of plasmid-located class 1 integrons inVibriocholeraeO1 and a dfrA15 cassette-containing integron inVibrioparahaemolyticusisolated in Angola[J].Antimicrob Agents Chemoth,2006,50(7):2493-2499.
[45]RILEY L W.Pandemic lineages of extraintestinal pathogenicEscherichiacoli[J].Clin Microbiol Infect,2014,20(5):380-390.
[46]JENSEN B H,OLSEN K E P,STRUVE C,et al.Epidemiology and clinical manifestations of enteroaggregativeEscherichiacoli[J].Clin Microbiol Rev,2014,27(3):614-630.
[47]TADESSE D A,ZHAO S,TONG E,et al.Antimicrobial drug resistance inEscherichiacolifrom humans and food animals,United States,1950-2002[J].Emerg Infect Dis,2012,18(5):741-749.
[48]SU H C,YING G G,TAO R,et al.Class 1 and 2 integrons,sulresistance genes and antimicrobial resistance inEscherichiacoliisolated from Dongjiang River,South China[J].Environ Pollut,2012,169:42-49.
[49]ZHANG W J,XU X R,SCHWARZ S.et al.Characterization of the IncA/C plasmid pSCEC2 fromEscherichiacoliof swine origin that harbours the multi resistance genecfr[J].J Antimicrob Chemoth,2014,69,385-389.
[50]侯芳,李耘,李湘燕.卫生部全国细菌耐药监测网2010年门诊来源细菌耐药监测[J].中国临床药理学杂志,2011,27(12):899-904.
[51]HOBBS E C,YIN X,PAUL B J,et al.Conserved small protein associates with the multidrug efflux pump AcrB and differentially affects antimicrobial resistance[J].Proc Natl Acad Sci USA,2012,109(41):16696-16701.
[52]MATSUMURA K,FURUKAWA S,et al.Roles of multidrug efflux pumps on the biofilm formation ofEscherichiacoliK-12[J].Biocontrol Sci,2011,16:69-72.
[53]DHANJI H,MURPHY N M,AKHIGBE C,et al.Isolation of fluoroquinolone-resistant O25b:H4-ST131Escherichiacoliwith CTX-M-14 extended-spectrumβ-lactamase from UK river water[J].J Antimicrob Chemoth,2010,66(3):512-516.
[54]KUMARASAMY K K,TOLEMAN M A,WALSH T R,et al.Emergence of a new antimicrobial resistance mechanism in India,Pakistan,and the UK:a molecular,biological,and epidemiological study[J].Lancet Infect Dis,2010,10(9):597-602.
[55]LIU Y Y,WANG Y,WALSH T R,et al.Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China:a microbiological and molecular biological study[J].Lancet Infect Dis,2016,16(2):161-168.
[56]MARIN M A,FONSECA E L,ANDRADE B N,et al.Worldwide occurrence of integrative conjugative element encoding multidrug resistance determinants in epidemicVibriocholeraeO1[J].PloS ONE,2014,9(9):e108728.
[57]SAFA A,NAIR G B,KONG R Y C.Evolution of new variants ofVibriocholeraeO1[J].Trends Microbiol,2010,18(1):46-54.
[58]YU L,ZHOU Y,WANG R,et al.Multiple antimicrobial resistance ofVibriocholeraeserogroup O139 in China from 1993 to 2009[J].PloS ONE,2012,7(6):e38633.
[59]KIM H B,WANG M,AHMED S,et al.Transferable quinolone resistance inVibriocholerae[J].Antimicrob Agents Chemoth,2010,54(2):799-803.
[60]KITAOKA M,MIYATA S T,UNTERWEGER D,et al.Antimicrobial resistance mechanisms ofVibriocholerae[J].J Med Microbiol,2011,60(4):397-407.
[61]HUDA N,LEE E W,CHEN J,et al.Molecular cloning and characterization of an ABC multidrug efflux pump,VcaM,in non-O1Vibriocholerae[J].Antimicrob Agents Chemoth,2003,47(8):2413-2417.
[62]HUDA M,CHEN J,MORITA Y,et al.Gene cloning and characterization of VcrM,a Na+-coupled multidrug efflux pump,fromVibriocholeraeNon-O1[J].Microbiol Immunol,2003,47(6):419-427.
[63]SMITH K P,KUMAR S,VARELA M F.Identification,cloning,and functional characterization of EmrD-3,a putative multidrug efflux pump of the major facilitator superfamily fromVibriocholeraeO395[J].Arch Microbiol,2009,191(12):903-911.
[64]TAYLOR D L,BINA X R,BINA J E.VibriocholeraeVexH encodes a multiple drug efflux pump that contributes to the production of cholera toxin and the toxin co-regulated pilus[J].PLoS ONE,2012,7(5):e38208.
[65]BAKER S.A return to the pre-antimicrobial era[J].Science,2015,347:1064-1066.
[66]CROFTS T S,GASPARRINI A J,DANTAS G.Next-generation approaches to understand and combat the antibiotic resistome[J].Nat Rev Microbiol,2017,15(7):422-434.
[67]CHUA S L,YAM J K,HAO P,et al.Selective labelling and eradication of antimicrobial-tolerant bacterial populations inPseudomonasaeruginosabiofilms[J].Nat Commun,2016,7:10750.
