二氧化碳气腹压对兔肾脏的影响及其机制研究
2018-03-31余伟民姚小兵
李 维,程 帆,赵 胜 ,余伟民,饶 婷,阮 远,袁 润,姚小兵
(武汉大学人民医院:1.麻醉科;2.泌尿外科,湖北武汉 430060)
随着微创外科理念的迅速发展,腹腔镜手术以“创伤小,术后粘连轻,恢复快”等优点逐步取代传统开放手术成为外科手术治疗的重要手段,并广泛应用于各个学科。气腹的建立是腹腔镜手术进行的重要一步,在气体的选择上,人们进行过不断的尝试,包括氮气,氦气,二氧化碳等等。其中二氧化碳气体又以“安全,刺激小,不燃烧,易制取,价格低廉”等优点脱颖而出成为目前应用最多的气体[1]。但是随着人们对腹腔镜技术的了解逐渐深入,人们发现二氧化碳气腹的建立也存在着种种术后并发症[2]。肾脏作为重要的人体器官,其受到二氧化碳气腹压的影响尤为重要[3]。有临床研究发现,二氧化碳气腹压对人体肾脏的影响主要包括:肾小球滤过率下降,肌酐及尿素氮上升,尿量降低。不少动物实验研究发现过高的二氧化碳气腹压以及气腹作用时间的延长会导致组织氧化损伤的加重,最终甚至会导致细胞凋亡[4]。但是气腹压引起肾组织细胞凋亡的机制目前并不是很明确,本研究拟通过建立二氧化碳气腹压动物实验模型,评价二氧化碳气腹压力对动物肾脏的影响,并探讨其可能发生的机制。
1 材料与方法
1.1材料无特定病原体(specific pathogen free,SPF)级新西兰大白兔,雌雄不拘,体重2~2.5 kg,购于武汉大学动物研究中心,饲养温度19~21 ℃,保持通风,正常标准饮食。气腹机,正置显微镜(Nikon 80i);TUNEL检测试剂盒(瑞士罗氏公司);透射电镜(H-600,日本东京);电泳仪(武汉谷歌生物),兔抗Bcl-2多克隆抗体(LSBio),兔抗Bax多克隆抗体(LSBio),兔抗Cytc多克隆抗体(Novus),兔抗caspase3多克隆抗体(abcam),兔抗β-actin单克隆抗体(abcam)。
1.2实验分组将18只新西兰大白兔随机分为3组:0 mmHg组(对照组),8 mmHg组(低气腹压组),18 mmHg组(高气腹压组),每组6只,分别给予对应大小的气腹压力。
1.3气腹压力动物模型建立取10 g/L戊巴比妥钠(45 mg/kg)沿耳缘静脉注射麻醉实验大白兔,仰卧位固定。备皮,于脐旁切一大小约0.5 cm切口,并逐层切开肌肉层至腹腔,从切口处小心插入气腹针,并连接气腹机,用缝线缝合密闭腹部伤口,打开气腹机建立气腹环境,各组分别接受对应二氧化碳气腹压力(对照组仅连接气腹针,不行气体灌注),气腹作用时间为2 h。气腹作用完成后拔出气腹针,放出腹腔内多余二氧化碳气体,关闭腹腔,并给予80 U/kg青霉素耳缘静脉注射以预防伤口感染。整个手术操作过程中应尽量避免触碰肾脏,以免造成人为损伤。
1.4标本留取二氧化碳气腹作用48 h后沿耳缘静脉注射过量麻醉剂以处死实验动物,立即取实验动物右侧肾脏,用冷的生理盐水充分冲洗干净,一部分立即行4%多聚甲醛固定,用于石蜡包埋,一部分用2.5%戊二醛固定,用于透射电镜检测,另一部分于-80 ℃冻存,用于后期蛋白质印迹(Western blot,WB)检测。
1.5HE染色取小块兔肾组织,用4%多聚甲醛溶液固定后,脱水透明并行石蜡包埋。包埋后的组织块经切片,脱蜡,染色,透明等步骤行苏木素-伊红(hematoxylin and eosin,HE)染色。最后于正置显微镜下200倍视野观察肾组织病理学改变,并拍照保存。不同组肾损伤程度采用Paller评分法相互比较,标准为:正常肾小管为0分,肾小管明显扩张为1分;可见细胞扁平或肿胀为1分;刷状缘损伤为1分,脱落为2分;管型2分,肾小管管腔内有脱落或坏死的细胞为1分。随机选取5个视野进行评估,评分越高说明肾损伤越严重。
1.6TUNEL染色检测细胞凋亡取上述石蜡包埋组织块行切片,脱蜡等步骤并按TUNEL试剂盒说明逐步行TUNEL(转移酶介导的三磷酸脱氧鸟苷-生物素刻痕末端标记,terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end labeling assay)染色,将染色完成的切片置于正置显微镜下,200倍视野对比观察不同组的肾脏组织染色情况,并拍照保存。TUNEL染色后凋亡的细胞其细胞核呈棕黄色,且形态不规则,大小不一致,而正常细胞的细胞核被苏木素复染成蓝色。我们通过计算凋亡指数来比较不同组肾组织细胞凋亡情况,方法为每张TUNEL切片选取5个阳性细胞数最多的高倍视野,并计算出阳性细胞所占百分比。
1.7透射电镜观察线粒体超微结构取绿豆大小新鲜兔肾脏组织块,丢入2.5%戊二醛溶液充分固定,再经锇酸固定,梯度乙醇脱水,丙酮包埋,切片及醋酸铀-枸橼酸铅双染色等步骤制作透射电镜超薄切片。最后在透射电子显微镜下8 000倍视野观察线粒体超微结构改变,并拍照保存。
1.8WB检测Bcl-2、Bax、Cytc及Caspase-3的含量取适量兔肾组织行液氮研磨,然后加入适量RIPA裂解液和苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)溶液以提取组织总蛋白,然后用聚氯基丙烯酸正丁酯(bicinchoninic acid,BCA)法行蛋白定量。取适量组织总蛋白行聚丙烯酰胺凝胶电泳(SDS-PAGE),并将分离的蛋白质通过电转转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,用脱脂牛奶封闭1 h后,将目的条带分别与对应的一抗反应(4 ℃,过夜),PBST(磷酸盐缓冲液+吐温)溶液清洗5 min 3次,然后将条带与羊抗兔荧光二抗反应(常温,1 h),PBST溶液清洗5 min,3次最后将条带放入奥德赛仪器下成像并分析。

2 结 果
2.1HE染色光镜下可见0 mmHg组和8 mmHg组兔肾脏组织结构正常,而18 mmHg组图肾脏可见肾小球肾小管细胞轻度水肿,部分肾小管轻度扩张,并有少量炎性细胞浸润(图1A)。Paller评分结果示:0 mmHg组(1.1±0.2)分,8 mmHg组(1.5±0.3)分,18 mmHg组(12.2±1.1)分。18 mmHg组与0 mmHg及8 mmHg组相比,Paller评分明显升高,且差异有显著性统计学意义(P<0.05),而0 mmHg与8 mmHg组之间相比差异无显著性意义(P>0.05)(图1B)。

图1不同气腹压力作用下的兔肾脏HE染色
A:不同组HE染色图片;B:不同组Paller评分结果。与0 mmHg组对比,*P<0.05。
2.2TUNEL染色光镜下观察不同组TUNEL染色切片,0 mmHg组与8 mmHg组兔肾组织细胞核基本全染成蓝色(正常细胞),极少数染为棕黄色,而18 mmHg组肾组织中棕黄色细胞核(凋亡细胞)的数量明显增多,但比例不高。这些凋亡的细胞不同程度的分布于肾脏组织的各个部分(肾小球,肾小管以及集合管),其中肾小球血管网和肾小管的凋亡更加明显(图2A)。凋亡指数计算结果示:0 mmHg组(0.04±0.02),8 mmHg组(0.06±0.01),18 mmHg组(0.21±0.04)。18 mmHg组与0 mmHg及8 mmHg组相比,凋亡指数明显增高,差异有显著性统计学意义(P<0.05),而0 mmHg组与8 mmHg组相比差异不明显(P>0.05)(图2B).

图2不同气腹压力作用下的兔肾脏TUNEL染色
A:不同组肾脏TUNEL染色图片; B:不同组肾脏凋亡指数计算结果。与0 mmHg组对比,*P<0.05。
2.3线粒体超微结构透射电子显微镜下观察不同组肾脏细胞线粒体超微结构,0 mmHg组与8 mmHg组兔肾细胞内的线粒体形态结构完整,可见正常的线粒体内膜外膜以及线粒体嵴。而18 mmHg组兔肾细胞内部分线粒体发生肿胀,有空泡形成,并发生线粒体嵴的断裂,有的线粒体甚至发生膜的破裂导致基质外漏(图3A)。异常线粒体比例结果显示:0 mmHg组(3.1±0.4)%,8 mmHg组(4.5±0.5)%,18 mmHg组(24.2±3.6)%。18 mmHg组与0 mmHg及8 mmHg组相比,肿胀的线粒体比例明显增高,差异有显著性统计学意义(P<0.05),而0 mmHg与8 mmHg组的线粒体均正常,无显著差异(P>0.05)(图3B)。
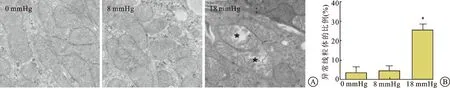
图3不同气腹压力作用下的兔肾脏线粒体结构变化
A:不同组肾脏电镜下线粒体超微结构图片,图中*标记的为肿胀的异常线粒体; B:不同组异常线粒体所占比例。与0 mmHg组对比,*P<0.05。
2.4Bcl-2、Bax、Cytc及Caspase-3表达量WB检测结果显示:18 mmHg组与0 mmHg组及8 mmHg组相比,Bax的表达量明显升高(P<0.05);Bcl-2表达量明显降低(P<0.05)(图4A、B);Cytc表达量明显升高(P<0.05);Cleaved-caspase-3表达量明显升高(P<0.05)(图4A、B);而Pro-caspase-3表达量3组之间差异无统计学意义(P>0.05),同时0 mmHg组与8 mmHg组相比,上述各项蛋白表达量差异均不明显(P>0.05)。

图4不同气腹压力作用下兔肾组织Bcl-2、Bax、Cytc及caspase-3表达量
A:不同组兔肾组织各个指标western blot结果图,条带灰度值的深浅代表该蛋白表达量的高低; B:不同组兔肾脏Bcl-2.Bax相对表达量; C:不同组兔肾脏Cytc及caspase3相对表达量。与0 mmHg组对比,*P<0.05。
3 讨 论
许多国内外的临床及动物研究发现,过高及持续时间过久的二氧化碳气腹压会对机体肾脏产生不良影响,其原因主要包括以下3个方面:①气腹压会直接压迫肾脏引起肾皮质血流减少,从而导致组织缺血缺氧,当气腹压撤除之后肾脏血流灌注恢复,缺血再灌注损伤继而发生;②气腹压可以直接压迫静脉血流如中心静脉,导致静脉回流障碍,有效循环血容量降低,从而肾总的血流量也随之下降;③机体对二氧化碳气体的吸收会通过一系列复杂的变化引起心脏输出量的改变[5-6]。这3个方面最终会导致肾脏缺血缺氧并发生缺血再灌注损伤。为了对手术中气腹压力的掌控以及肾脏气腹压损伤的功能保护提供科学的理论依据,我们的研究着重探讨了二氧化碳气腹压力对兔肾脏损伤作用以及这种损伤可能发生的具体机制。
在缺血缺氧引起的细胞损伤以及凋亡的分子机制中,线粒体介导的细胞凋亡途径是最为常见的细胞凋亡机制之一[7]。在这种凋亡机制中,缺血缺氧及缺血再灌注导致活性氧(reactive oxygen species,ROS)的大量产生,钙离子超载等,这些上游的凋亡信号通过Bcl家族蛋白调节细胞内线粒体膜电位以及线粒体膜的通透性,从而控制线粒体内细胞色素C(cytochrome C,Cytc)的释放。其中Bcl-2蛋白能够保存膜电位,从而阻止Cytc的释放,而Bax蛋白可以消除线粒体膜电位,从而促进Cytc的释放[8]。从线粒体内释放的Cytc首先与胞质中的Apaf-1结合,然后与caspase-9反应,激活Pro-caspase-9生成Cleaved-caspase-9,然后继续活化下游的caspase蛋白,如caspase-3。被活化的caspase-3最终裂解成小片段Cleaved-caspase-3,并特异性的切割某些与细胞活性相关的蛋白质,最终导致细胞凋亡的发生[9-10]。
在本研究中,当二氧化碳气腹压升高到18 mmHg时,HE染色以及Paller评分的结果说明肾组织损伤明显加重了,这可能与该气腹压力下活性氧的大量产生有关。WB结果显示促凋亡蛋白Bax的表达量升高,而凋亡抑制蛋白Bcl-2表达量降低,同时电镜下也观察到异常肿胀的线粒体比例明显增加,这些变化均提示在该气腹压力作用下线粒体膜电位发生丢失,而且线粒体膜的通透性增加。另外,WB结果还显示Cytc以及Cleaved-caspase-3表达量明显升高,说明Cytc从组织线粒体内大量释放到胞浆并激活Pro-caspase-3生成了Cleaved-caspase-3片段,最终导致肾组织细胞凋亡的发生。另一方面,TUNEL染色结果显示18 mmHg组兔肾脏凋亡指数明显增加也支持了这一点。综上所述,过高的二氧化碳气腹压会通过多个方面导致肾实质的缺血缺氧并发生缺血再灌注损伤,此时大量产生的ROS会改变线粒体膜电位及线粒体膜的通透性,并引起凋亡相关蛋白Bcl-2、Cytc、caspase等的表达量的改变,最终引起肾组织细胞的凋亡。因而我们得出结论:过高的二氧化碳气腹压会导致兔肾脏细胞发生凋亡,而且这种凋亡的机制可能与线粒体介导的细胞凋亡途径相关。
[1] ISHIZAKI Y,BANDAI Y,SHIMOMURA K,et al. Changes in splanchnic blood flow and cardiovascular effects following peritoneal insufflation of carbon dioxide[J]. Surg Endosc,1993,7(5): 420-423.
[2] PAPPARELLA A,NINO F,COPPOLA S,et al. Peritoneal morphological changes due to pneumoperitoneum: the effect of intra-abdominal pressure[J]. Eur J Pediatr Surg,2014,24(4): 322-327.
[3] DE BARROS R F,MIRANDA M L,DE MATTOS A C,et al. Kidney safety during surgical pneumoperitoneum: an experimental study in rats[J]. Surg Endosc,2012,26(11): 3195-3200.
[4] SOUZA D B,COSTA W S,CARDOSO L E,et al. Does prolonged pneumoperitoneum affect the kidney? Oxidative stress,stereological and electron microscopy study in a rat model[J]. Int Braz J Urol,2013,39(1):30-36.
[5] BISHARA B,RAMADAN R,KARRAM T,et al. Nitric oxide synthase inhibition aggravates the adverse renal effects of high but not low intraabdominal pressure[J]. Surg Endosc,2010,24(4): 826-833.
[6] BEN-HAIM M,ROSENTHAL RJ. Causes of arterial hypertension and splachnic ischemia during acute elevations in intra-abdominal pressure with CO2pneumoperitoneum: a complex central nervous system mediated response[J]. Int J Colorectal Dis,1999,14(4-5):227-236.
[7] KWAK GH,KIM TH,KIM HY. Down-regulation of MsrB3 induces cancer cell apoptosis through reactive oxygen species production and intrinsic mitochondrial pathway activation[J]. Biochem Biophys Res Commun,2017,483(1): 468-474.
[8] KROEMER G,GALLUZZI L,BRENNER C. Mitochondrial membrane permeabilization in cell death[J]. Physiol Rev,2007,87(1): 99-163.
[9] ZHANG J,YU Q,HAN L,et al. Study on the apoptosis mediated by cytochrome c and factors that affect the activation of bovine longissimus muscle during postmortem aging[J]. Apoptosis,2017,22(6): 777-785.
[10] HASSOUN HT,LIE ML,GRIGORYEV DN,et al. Kidney ischemia-reperfusion injury induces caspase-dependent pulmonary apoptosis[J]. Am J Physiol Renal Physiol,2009,297(1): F125-F137.
(编辑 何宏灵)
