PD-L1在乳腺癌中的表达及其与细胞免疫的相关性分析
2018-03-30王立东徐卫国李蕊洁谌娜娜郭红辉赵跃鹏
王立东,徐卫国,杨 鑫,李蕊洁,谌娜娜,郭红辉,赵跃鹏
(1.华北理工大学附属医院肿瘤外科,河北唐山063009;2.迁安市人民医院肿瘤放化疗科,河北迁安 064400;3.迁安市人民医院病理科,河北迁安 064400;4.承德县医院外科,河北承德 067400)
乳腺癌是女性最常见的恶性肿瘤之一。研究证实,乳腺癌的生物学行为具有高淋巴管侵袭性,转移能力强,尽管经过规范的治疗,但仍然有相当部分乳腺癌患者出现复发转移。据统计,全球每年约52.2万人死于乳腺癌[1]。因此研究乳腺癌中与复发、转移相关,影响患者肿瘤微环境的异常信号通路,可能为乳腺癌的临床治疗提供新的靶点。本研究采用免疫组织化学法检测乳腺肿瘤组织中程序性死亡受体1(PD-L1)蛋白的表达情况,流式细胞术检测患者外周血清淋巴细胞亚群水平,探讨PD-L1蛋白与乳腺癌临床病理特征的相关性,并分析PD-L1蛋白表达水平与乳腺癌患者细胞免疫的相关性,旨在为乳腺癌的临床治疗提供新思路。
1 资料与方法
1.1一般资料 收集2010年9月至2016年9月于迁安市人民医院行手术治疗且临床资料完整的114例乳腺癌患者病理标本,均为女性患者,年龄为33~78岁,中位年龄51岁,组织学类型均为浸润性导管癌,术前均未行放疗、化疗或内分泌治疗。乳腺癌病理标本根据第7版国际抗癌联盟(UICC)乳腺癌TNM分期标准分期。根据术后免疫组织化学结果,雌激素受体(ER)、孕激素受体(PR)表达大于10%,即认为阳性;当人类表皮生长因子受体2(Her-2)为3+时认定为阳性,0~1+认定为阴性,2+时需结合FISH检测结果,如存在基因拷贝数扩增认定为阳性,反之则为阴性;选择Ki67阳性指数14%作为其表达水平高低的界定点,免疫组织化学结果显示Ki67≥14%判定为Ki67高表达,<14%认定为Ki67低表达[2];组织学分级:应用Bloom-Richardson分级法将乳腺癌组织标本分为Ⅰ、Ⅱ、Ⅲ级。本研究通过该院伦理委员会审批。患者及家属均签署知情同意书。
1.2方法
1.2.1主要仪器和试剂 石蜡切片机购自德国Leica公司;倒置光学显微镜购自日本Nikon公司;病理标本微波处理仪购自意大利MILESTON公司,4 ℃冰箱购自美的冰箱厂,鼠抗人PD-L1单克隆抗体购自Proteintech公司;柠檬酸钠-EDTA抗原修复液、5%牛血清清蛋白(BSA)封闭液、二抗、链霉素亲和素-生物素-过氧化物酶(SABC)、二氨基联苯胺(DAB)显色剂、苏木素购自MDL公司。
1.2.2免疫组织化学方法 乳腺癌组织石蜡块连续切片,每片2.5 μm,二甲苯脱蜡,梯度乙醇脱水,3%双氧水室温下浸泡切片10 min,柠檬酸钠-EDTA抗原修复液抗原修复,自然冷却至室温,磷酸盐缓冲液(PBS)清洗后使用5%BSA封闭液封闭组织,一抗(鼠抗人PD-L1单克隆抗体1∶100)孵育4 ℃过夜。PBS清洗后孵育二抗37 ℃,30 min。滴加SABC试剂孵育30 min,DAB显色,苏木素-伊红(HE)复染,梯度乙醇脱水,树胶封片观察,随机观察5个高倍视野。
1.2.3染色结果评定 细胞质及细胞膜棕褐色为PD-L1阳性表现,染色结果按照每张切片阳性细胞比例及着色深浅计分,行半定量分析。根据每个视野阳性细胞率及着色强度进行分级计分,然后根据两项之积平均数判定其阳性强度。染色强度评分:无色判定为0分,淡黄色判定为1分,棕黄色判定为2分,棕褐色判定为3分;再按阳性细胞百分率评分;阳性细胞小于5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。染色强度与阳性细胞百分比的乘积小于或等于1为阴性,大于1为阳性[3]。
1.3统计学处理 采用SPSS17.0统计软件进行统计分析。非正态分布计量资料用M(P25,P75)表示,组间比较采用秩和检验。单因素分析采用Fisher确切概率法。计数资料用频数表示,组间比较采用χ2检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1免疫组织化学染色结果 实验结果显示,PD-L1阳性表达时,组织细胞膜和细胞质呈均匀染色状态,为棕褐色,见图1。在114例乳腺癌组织中,35例PD-L1蛋白阳性表达,阳性率为30.7%。
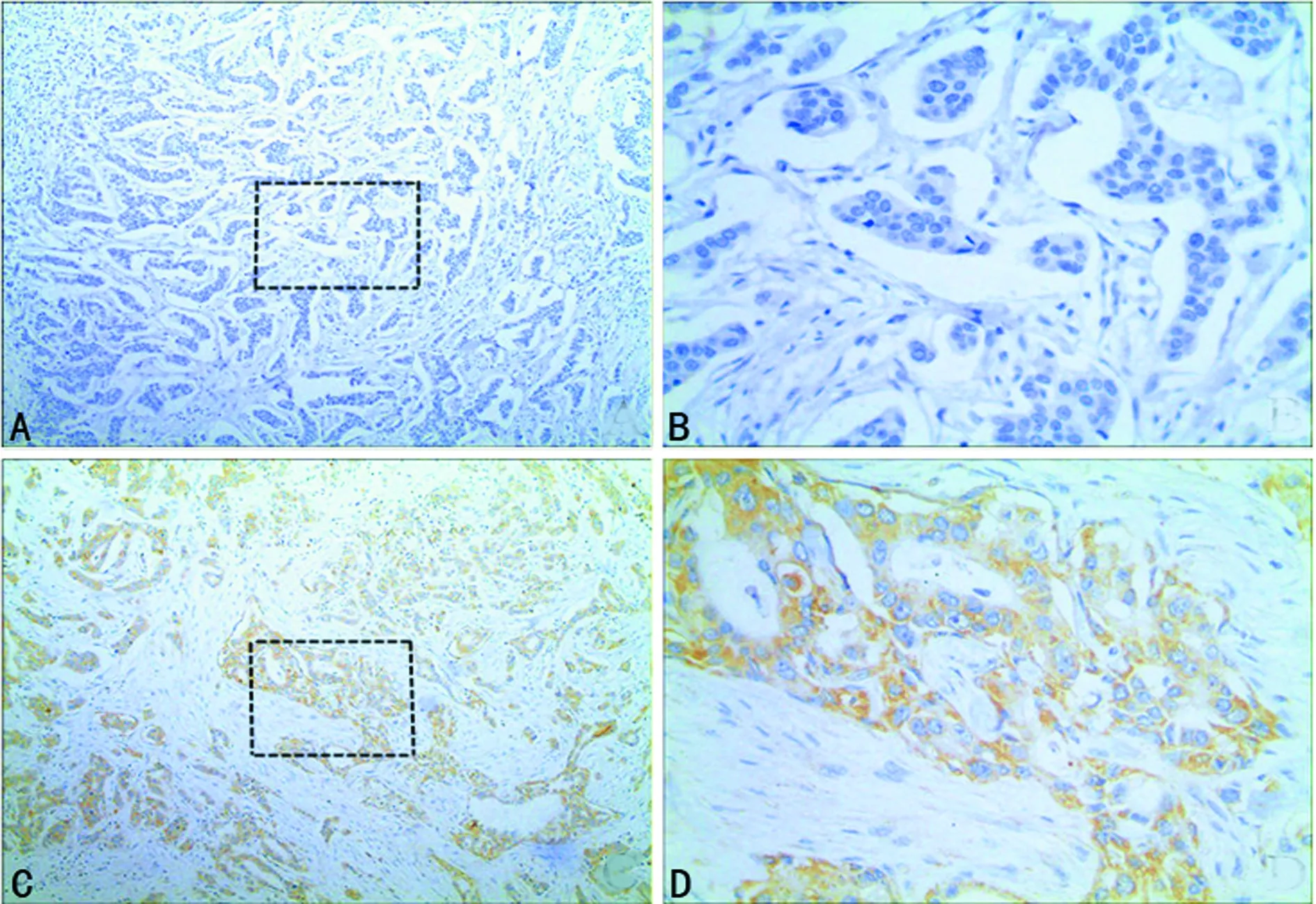
A:阴性表达 (HE×100);B:阴性表达(HE×400);C:阳性表达(HE×100);D:阳性表达 (HE×400)。
图1乳腺癌组织中PD-L1的表达
2.2PD-L1表达与临床病理特征关系 PD-L1表达与肿瘤大小(T分期)、Ki-67表达水平、组织学分级相关(P<0.05)。与年龄、淋巴结状态、ER、PR、Her-2表达水平无相关性(P>0.05)。PD-L1主要表达于肿瘤较大、分级高、Ki-67高表达的患者,见表1。
2.3PD-L1阳性表达与PD-L1阴性表达患者淋巴细胞亚群计数的比较 经两独立样本的秩和检验,PD-L1阴性表达患者CD3+、CD3+CD4+、CD3-CD16+CD56+细胞的水平高于PD-L1阳性表达患者(Z=10.705、9.135、7.563;P=0.009、0.016、0.024),差异有统计学意义,见表2。
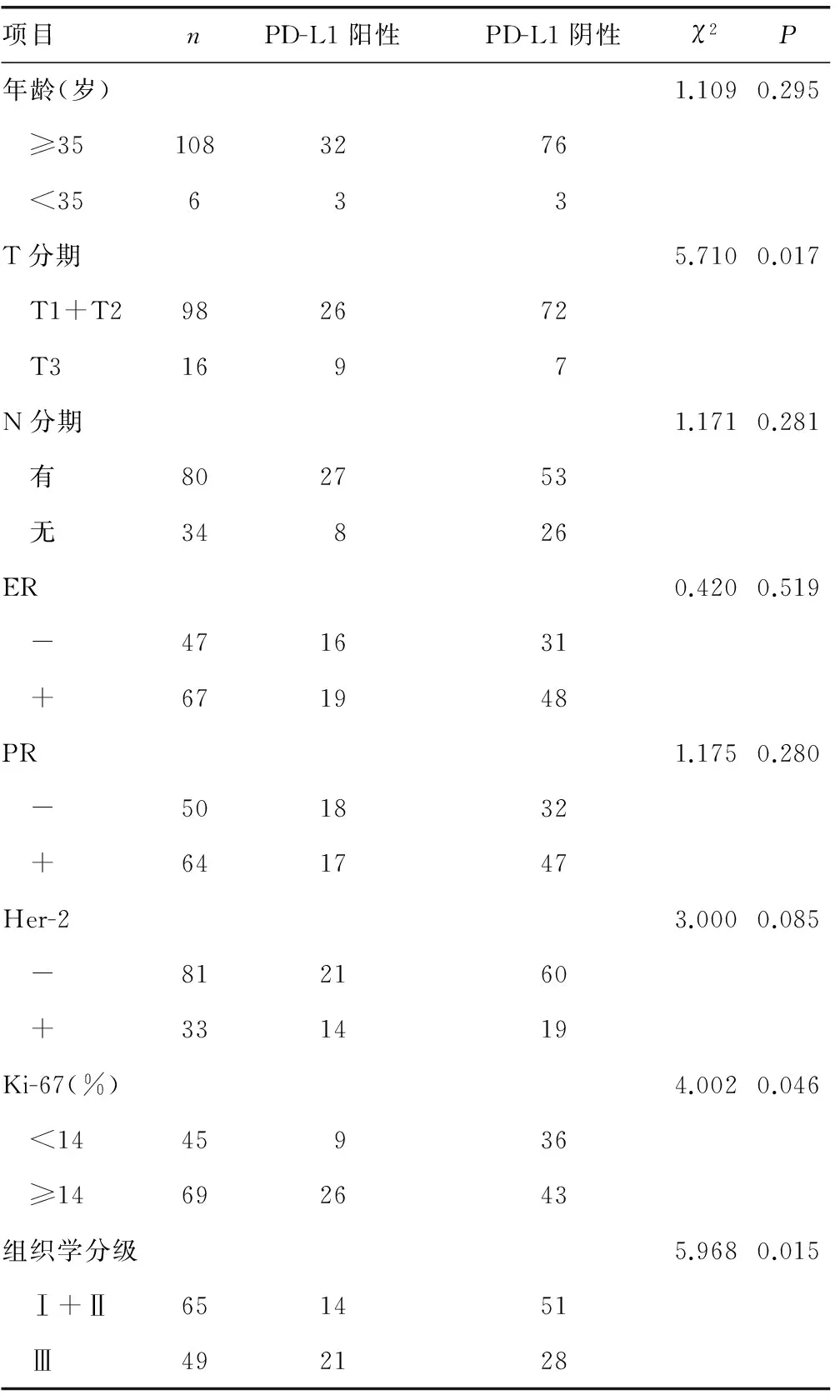
表1 PD-L1 的表达与乳腺癌患者临床病理特征的关系(n)
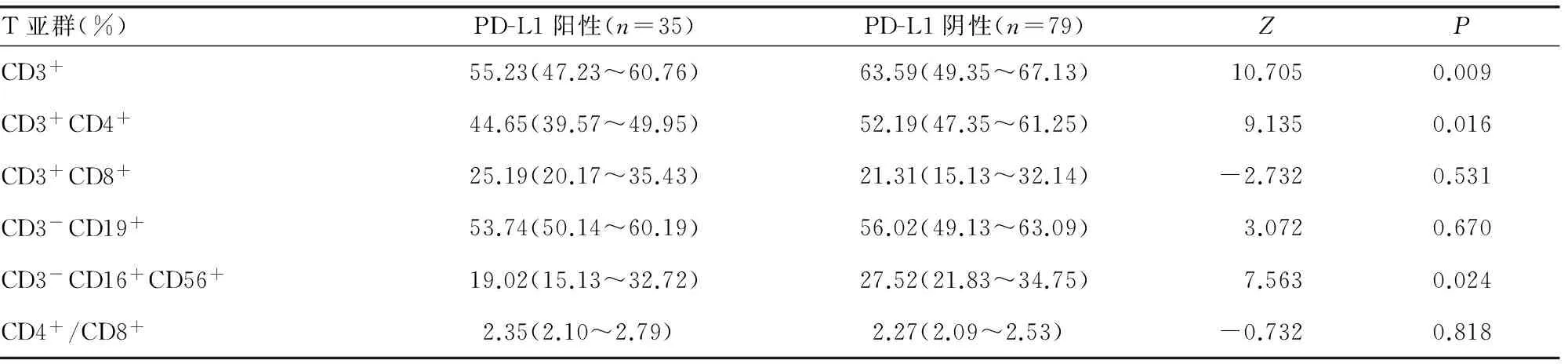
表2 PD-L1阳性表达与PD-L1阴性表达患者淋巴细胞亚群计数的比较[M(P25,P75)]
3 讨 论
PD-1是CD28/CTLA-4共刺激受体家族中的一员,与其配体PD-L1相互作用向T细胞传递一个抑制信号从而在肿瘤部位产生免疫抑制的肿瘤微环境[4]。肿瘤细胞可异常上调 PD-1及PD-L1的表达,抑制 T 细胞的免疫活性,造成肿瘤免疫逃逸,导致肿瘤发生、发展[5]。PD-L1不仅表达于抗原提呈细胞(APC)和树突状细胞,也表达于活化的单核细胞和B细胞,不同器官的非淋巴组织[6]。研究表明,PD-L1 亦表达于人类多种肿瘤细胞表面,例如肺癌、肾癌、黑色素瘤、乳腺癌等,抑制T细胞的活化,诱导其凋亡,促进肿瘤进展[7]。
本研究纳入114例乳腺浸润性导管癌患者,免疫组织化学法检测乳腺癌组织中PD-L1蛋白表达情况,结果显示PD-L1表达于乳腺癌组织的细胞膜和细胞质中,染色均匀,着色明显,共35例PD-L1阳性表达,阳性率为30.7%。区燕华等[8]用免疫组织化学方法检测了154 例乳腺癌组织中PD-L1 的表达情况,结果显示其阳性表达率为22.7%,与本课题研究结果相近。耿卫朴[9]研究了40例乳腺浸润性导管癌中PD-L1的表达情况,发现PD-L1阳性表达率为45%,与本课题研究结果有一定差别。本研究采用Fisher确切概率法分析PD-L1与临床病理特征的相关性,结果显示PD-L1表达与肿瘤大小、组织学分级、Ki-67的表达情况相关(P<0.05),与ER、PR、Her-2、淋巴结状态无明显关联性。PD-L1主要表达于肿瘤大于5 cm、Ki-67高表达及高组织学分级患者中,与QIN等[10]报道的结果相似,提示PD-L1的表达与更差的病理学特征相关。本研究采用独立样本秩和检验对PD-L1阳性表达组与PD-L1阴性表达组患者淋巴细胞亚群计数进行了比较,结果显示PD-L1阴性表达组患者CD3+、CD3+CD4+、CD3-CD16+CD56+细胞的水平高于PD-L1阳性表达组患者,两组CD3+CD8+、CD3-CD19+、CD4+/CD8+的细胞表达水平差异无统计学意义,而以上标记细胞亚群所代表的功能分别为:CD3+与人体T细胞免疫相关,其降低提示着机体免疫功能低下;CD3+CD4+和CD3+CD8+代表着辅助/诱导型T细胞和抑制/细胞毒性T细胞,其升高与降低与总T细胞相似;CD3-CD19+细胞水平的高低可反映机体细胞免疫的状态;CD3-CD16+CD56+细胞的水平则反映机体内NK细胞的活性,其可见于某些肿瘤细胞及病毒感染的细胞毒性作用;CD4+/CD8+比值的异常提示患者机体免疫功能处于失衡状态。本研究的结果提示,PD-L1的高表达可以恶化乳腺癌患者自身的细胞免疫,其机制可能与PD-L1相关通路抑制患者机体细胞免疫相关。
肿瘤的免疫治疗已然成为一种治疗肿瘤的重要方式。得益于癌细胞对常规治疗较敏感,使得部分乳腺癌患者的生存时间较其他恶性肿瘤患者更长,但复发转移性乳腺癌目前尚不可治愈,现有治疗手段终将会对这部分患者失效。这些肿瘤患者有可能在现有治疗方法全部失败后再次获益于抗PD-1/PD-Ls治疗,使其生存期进一步延长。本研究采用免疫组织化学法,以乳腺癌组织中PD-L1蛋白的表达情况为切入点,探讨PD-L1蛋白与乳腺癌临床病理特征的相关性,并分析PD-L1 蛋白表达水平与乳腺癌患者细胞免疫的相关性,结果显示PD-L1的表达与乳腺癌更差的临床病理特征密切相关,PD-L1的表达可以提示患者细胞免疫功能的下降。
[1]陈万青,郑荣寿.中国女性乳腺癌发病死亡和生存状况[J].中国肿瘤临床,2015,42(13):668-674.
[2]MU K,LI L,YANG Q,et al.A standardized method for quantifying proliferation by Ki-67 and cyclin A immunohistochemistry in breast cancer[J].Ann Diagn Pathol,2015,19(4):243-248.
[3]刘琳,赵坡,张忠梅,等.乳腺癌TMSG-1蛋白的表达及临床病理意义[J].中国现代医学杂志,2013,23(13):59-61.
[4]BACHY E,COIFFIER B.Anti-PD1 antibody:a new approach to treatment of lymphomas[J].Lancet Oncol,2014,15(1):7-8.
[5]HAWKES E A,GRIGG A,Chong G.Programmed cell death-1 inhibition in lymphoma[J].Lancet Oncol,2015,16(5):234-245.
[6]TOPALIAN S L,HODI F S,BRAHMER J R,et al.Safety,activity,and immune correlates of Anti-PD-1 antibody in cancer[J].N Engl J Med,2012,366(26):2443-2454.
[7]BOLAND J M,KWON E D,HARRINGTON S M,et al.Tumor B7-H1 and B7-H3 expression in squamous cell carcinoma of the lung[J].Clin Lung Cancer,2013,14(2):157-163.
[8]区燕华,林骏,罗深秋.程序性死亡因子配体1 在乳腺癌中的表达及意义[J].广东医学,2015,36(10):1515-1517.
[9]耿卫朴.人乳腺癌中共刺激分子PD-L1、PD-L2 的表达及其临床意义[J].临床与实验病理学杂志,2017,33(1):59-62.
[10]QIN T,ZENG Y,QIN G,et al.High PD-L1 expression was associated with poor prognosis in 870 Chinese patients with breast cancer[J].Oncotarget,2015,6(32):33972-33981.
