抑制DNA-PKcs对放射治疗后食管鳞癌细胞系EC109自噬蛋白表达和增殖的影响*
2018-03-30赵晓静李雨濛张中冕王豪勋
孙 佳,赵晓静,袁 翎,李雨濛,李 南,张中冕,王豪勋,韩 娜,马 军,王 健△
(1.郑州大学第二附属医院肿瘤科,河南郑州 450014;2郑州大学附属肿瘤医院/河南省肿瘤医院,河南郑州 450008;3郑州大学第二附属医院检验科,河南郑州 450014)
我国是食管鳞癌高发区,约90%的食管癌为鳞状细胞癌[1],是第四大癌症死亡原因。放疗是食管癌的主要治疗方法之一, DNA双键断裂(DSBs)是放疗造成DNA损伤的主要类型。肿瘤细胞可通过同源重组(HR)和非同源末端连接(NHEJ)对DSBs进行修复[2],降低放疗敏感性。真核细胞中DSBs主要由NHEJ修复,DNA-PKcs(DNA-dependent protein kinase catalytic subunit)是NHEJ的中心因子,因此可通过抑制DNA-PKcs增加放疗敏感性。NU7441是一种新型的DNA-PKcs抑制剂,可抑制DNA-PKcs磷酸化[3],从而抑制DSBs修复[4-5]。自噬是保守的细胞内过程。通过双层膜囊泡即自噬体与溶酶体融合,实现蛋白质和细胞器的降解。自噬在肿瘤发生发展过程中可能具有抗肿瘤和促进肿瘤发生的双重作用[6-7]。药物及放射照射可造成肿瘤细胞DNA损伤,并促进肿瘤细胞自噬现象,但自噬在DNA损伤、细胞死亡和增殖中的作用存在争议[8-10]。本研究用X射线照射诱导EC109细胞DNA断裂,用DNA-PKcs抑制剂NU7441抑制肿瘤细胞DSBs的自我修复过程,检测自噬蛋白表达,探讨阻断食管鳞癌细胞DNA修复对其自噬过程的影响。
1 材料与方法
1.1材料与试剂 食管鳞癌细胞系EC109为郑州大学第二附属医院消化疾病研究所保存;RMPI-1640细胞培养基、胎牛血清(FBS)、青链霉素混合液购于上海生工公司;磷酸化DNA-PKcs(ab18192)购于英国Abcam;总DNA-PKcs(4602S)、Beclin-1(3495S)、LC3B(2775S)、HRP标记的羊抗兔IgG(7074S)购于美国Cell Signaling Technology;凋亡检测试剂盒购于美天旎公司(130-092-052)。
1.2方法
1.2.1细胞培养和处理 EC109细胞用RPMI1640培养基(含10%胎牛血清、1%青链霉素),培养于37 ℃,5% CO2培养箱。细胞生长至对数期时,加入NU7441(8 μmol/L)并进行X射线照射。前期预试验结果发现在相同浓度伊立替康作用下,随着NU7441浓度逐渐增大,对细胞的抑制率也逐渐增大,呈浓度依赖性, NU7441在8 μmol/L时抑制效应最强,因此本研究中选8 μmol/L进行细胞处理。照射采用固定源皮距SSD照射,照射距离d为100 cm,照射剂量率600 MU/min,根据本课题组前期实验结果[11],采用一次照射,剂量设为8 Gy(瑞典Elekta公司Synergy直线加速器)。实验共分为4组(对照组、NU7441组、X-Ray组、X-Ray+NU7441组),食管鳞癌EC109细胞经过X射线照射和(或)NU7441处理24 h后,收集细胞进行下一步检测。
1.2.2Western blot检验 冰上用蛋白裂解液处理细胞,超声破碎,离心后取上清液,煮沸10 min后上样。p-DNA-PKcs、t-DNA-PKcs用5%~16%梯度分离胶电泳,转膜12 h×250 mA。Beclin-1及LC3B用14%分离胶电泳,转膜2 h×250 mA。5% 牛血清清蛋白(BSA)室温封闭1 h。一抗4 ℃震荡孵育过夜(p-DNA-PKcs、t-DNA-PKcs用1∶3 000,Beclin-1及LC3B用1∶1 000,β-actin为1∶5 000)。TBST洗膜3次后二抗孵育1 h。再次TBST洗膜3次,ECL染色,用FluorChem FC3成像仪采集图像和灰度分析,β-actin作为内参,计算相对表达量。
1.2.3凋亡检测 用1×Binding Buffer对细胞进行清洗并重悬;加入Annexin V-FITC(10 μL/106细胞),室温避光孵育15 min;1×Binding Buffer对细胞进行清洗并重悬;加入碘化丙啶(PI,5 μL/106细胞),上机检测;记录每组Annexin V-FITC阳性细胞所占百分比,分析实验结果。
1.2.4四甲基偶氮唑盐(MTT)法检测细胞增殖 以每孔5×103个细胞将EC109细胞接种至96孔板,过夜培养细胞贴壁后,分别对细胞进行照射和(或)NU7441处理,每组设置3个复孔;作用24 h后,用PBS对细胞进行清洗,每孔加入200 μL培养液和20 μL MTT,培养箱中孵育4 h;孵育结束后去除MTT,加入150 μL二甲基亚砜(DMSO),摇床缓慢摇10 min后,在Multiskan MK3酶标仪测定并记录每孔波长490 nm处的吸光度(A)值。细胞存活率=(A490nm实验组-A490nm空白组)/(A490nm对照组-A490nm空白组)。
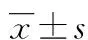
2 结 果
2.1各组p-DNA-PKcs及t-DNA-PKcs的表达比较 对磷酸化和总DNA-PKcs的相对表达量进行单因素方差分析发现:与对照组相比,NU7441组食管鳞癌细胞EC109中p-DNA-PKcs表达降低(P<0.01),X-Ray组p-DNA-PKcs表达升高(P<0.01);与对照组相比,NU7441组t-DNA-PKcs表达降低,X-Ray组t-DNA-PKcs表达升高,但差异无统计学意义(P>0.05),见图1。
A:Western blot蛋白条带;B:目的蛋白与β-actin灰度值比值柱形图;a:P<0.05,与对照组比较
图1各组p-DNA-PKcs及t-DNA-PKcs比较
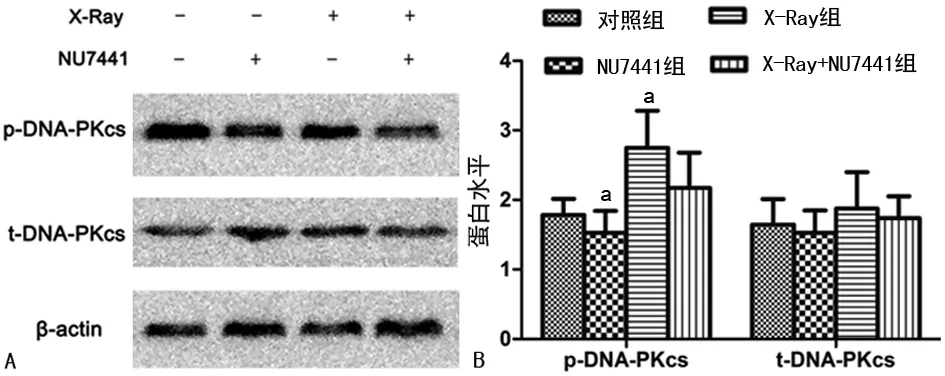
A:Western blot蛋白条带;B:目的蛋白与β-actin灰度值比值柱形图;a:P<0.05,与对照组比较;b:P<0.05,与X-Ray组比较
图2各组Beclin-1及LC3B的表达比较
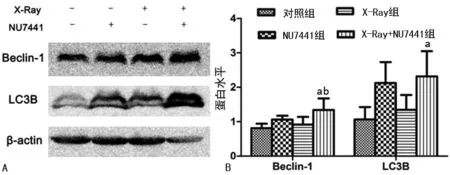
A:流式散点图;B:细胞凋亡率柱状图;a:P<0.05,与对照组比较;b:P<0.05,与X-Ray组比较
图3不同处理组对食管鳞癌细胞EC109的细胞凋亡影响
2.2各组自噬蛋白Beclin-1及LC3B的表达比较 与对照组相比,X-Ray+NU7441组食管鳞癌细胞EC109中Beclin-1及LC3B表达升高(P<0.05);与X-Ray组相比,X-Ray+NU7441组Beclin-1表达升高(P<0.05),见图2。
2.3细胞凋亡分析 与对照组相比,单独NU7441组细胞凋亡率无明显变化,X-Ray组及X-Ray+NU7441组凋亡率明显增加,差异有统计学意义(P<0.05)。与单独NU7441组和X-Ray组相比,X-Ray+NU7441组细胞凋亡率明显增加(P<0.05),见图3。
2.4MTT检测细胞增殖情况比较 与对照组相比,单独NU7441组细胞增殖无明显变化,X-Ray组及X-Ray+NU7441组增殖明显被抑制,差异有统计学意义(P<0.05)。与单独X-Ray组相比,X-Ray+NU7441组细胞抑制率明显增加(P<0.05),见图4。
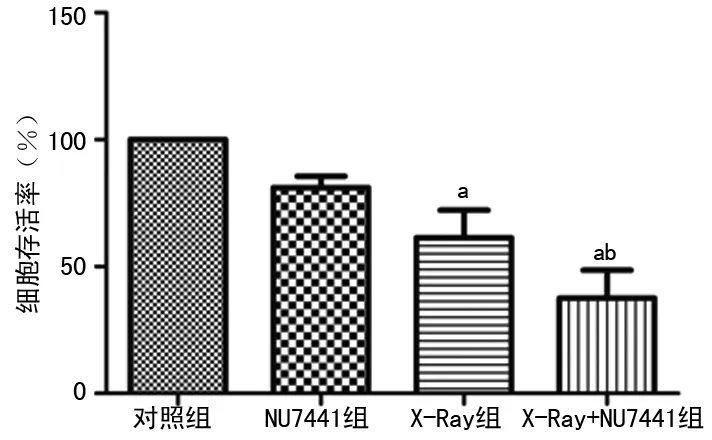
a:P<0.05,与对照组比较;b:P<0.05,与X-Ray组比较
图4不同处理组对食管鳞癌EC109细胞增殖的影响
3 讨 论
电离辐射可造成肿瘤细胞DSBs,肿瘤细胞可通过HR和NHEJ两种机制进行修复[2],这也是肿瘤细胞放疗抵抗的重要机制之一。DNA-PKcs是NHEJ的重要成分[2],其募集与磷酸化有助于肿瘤细胞通过NHEJ进行DNA断裂的修复。另外在DSBs修复中DNA-PKcs也参与DSBs诱导的细胞凋亡[12]。通过抑制DNA-PKcs对DSBs的修复可导致细胞死亡。NU7441可抑制DNA-PKcs,从而抑制DSBs的修复[3-5]。前期本课题组分别用0~8 Gy作用于EC109、TE7和EC9706食管癌细胞系,结果表明在8 Gy时DNA-PKcs mRNA升高最明显,因此将照射剂量定为8 Gy[11]。本研究中 Western blot结果显示,X-Ray照射后食管鳞癌细胞EC109中p-DNA-PKcs表达升高;NU7441处理后,p-DNA-PKcs则表达降低,且差异有统计学意义。证实放射照射可诱导p-DNA-PKcs增多,且NU7441可有效抑制p-DNA-PKcs。t-DNA-PKcs也有类似的变化趋势,但统计学分析无明显差异,可能由于DNA-PKcs的功能主要依靠其磷酸化[3],NU7441主要通过抑制DNA-PKcs磷酸化发挥作用。
放射照射可以促进自噬,同时也可诱导DSBs和继发的修复反应。以往研究均表明在DNA受损后,细胞自噬增多[8-9]。为进一步明确自噬与放射照射引起的DNA损伤间的关系,本研究用DNA-PKcs抑制剂NU7441抑制放射照射后EC109细胞DSBs修复,通过检测自噬蛋白Beclin-1及LC3B表达水平,观察EC109细胞自噬情况。结果显示单独放射照射或单独应用NU7441 EC109细胞自噬均增多;放射照射联合NU7441作用EC109细胞后自噬明显增多,表明放射照射、NU7441及放射照射联合NU7441均可诱导细胞自噬增多。
自噬在细胞中的作用存在争议,自噬既可诱导受损细胞死亡,也可对细胞起保护作用[13]。如自噬持续激活,细胞器和关键蛋白被耗尽,则导致一种特殊形式的细胞程序性死亡。但当处于外界压力下如营养缺乏时,自噬则为促进细胞存活的保护性机制。同样,自噬对放射照射所引起的DNA损伤的作用亦存在争议。研究表明放疗过程中自噬增加或减少均可增强放疗敏感性[13],如放疗联合雷帕霉素、NU7441增加自噬;联合3-methyladenine(3-MA)、baflomycin A1(Baf-A1)、Compound C减少自噬,均可增加放疗敏感性促进细胞死亡[14-18]。但放疗过程中NU7441增加自噬提高放疗敏感性的结果是一致的,研究表明NU7441可提高结肠癌[4],乳腺癌[5]和前列腺癌[19]的放疗敏感性,这也与本研究的实验结果相符。细胞凋亡检测发现,单独放射照射、放射照射联合NU7441均使细胞凋亡明显增多;且放射照射联合NU7441较单独放射照射细胞凋亡增多更加明显。MTT亦得到相似的结果。从而证实NU7441可增加EC109细胞放疗敏感性,提高放疗效率。
综上所述,本研究证实NU7441可阻断EC109细胞放射照射后DNA-PKcs修复通路,抑制DSBs的有效修复,并发现阻断EC109细胞放射照射后DNA-PKcs修复通路可促进细胞自噬并抑制细胞增殖。
[1]TORRE L A,BRAY F,SIEGEL R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]ILIAKIS G,MURMANN T,SONI A.Alternative end-joining repair pathways are the ultimate backup for abrogated classical non-homologous end-joining and homologous recombination repair:Implications for the formation of chromosome translocations[J].Mutat Res Genet Toxicol Environ Mutagen,2015,793:166-175.
[3]YANG C,WANG Q,LIU X,et al.NU7441 enhances the radiosensitivity of liver cancer cells[J].Cell Physiol Biochem,2016,38(5):1897-1905.
[4]ZHAO Y,THOMAS H D,BATEY M A,et al.Preclinical evaluation of a potent novel DNA-dependent protein kinase inhibitor NU7441[J].Cancer Res,2006,66(10):5354-5362.
[5]CISZEWSKI W M,TAVECCHIO M,DASTYCH J,et al.DNA-PK inhibition by NU7441 sensitizes breast cancer cells to ionizing radiation and doxorubicin[J].Breast Cancer Res Treat,2014,143(1):47-55.
[6]TANG D,KANG R,LIVESEY K M,et al.Endogenous HMGB1 regulates autophagy[J].J Cell Biol,2010,190(5):881-892.
[7]VALENCIA T,KIM J Y,ABU-BAKER S,et al.Metabolic reprogramming of stromal fibroblasts through p62-mTORC1 signaling promotes inflammation and tumorigenesis[J].Cancer Cell,2014,26(1):121-135.
[8]KANZAWA T,GERMANO I M,KOMATA T,et al.Role of autophagy in temozolomide-induced cytotoxicity for malignant glioma cells[J].Cell Death Differ,2004,11(4):448-457.
[9]ZENG X,YAN T,SCHUPP J E,et al.DNA mismatch repair initiates 6-thioguanine--induced autophagy through p53 activation in human tumor cells[J].Clin Cancer Res,2007,13(4):1315-1321.
[10]BAEH,GUANJL.Suppressionof
autophagy by FIP200 deletion impairs DNA damage repair and increases cell death upon treatments with anticancer agents[J].Mol Cancer Res,2011,9(9):1232-1241.
[11]赵晓静,马军,袁翎,等.食管鳞癌细胞系TE7放射照射后miRNAs及DNA修复相关因子的表达[J].郑州大学学报(医学版),2017,52(3):247-250.
[12]DERIANO L,GUIPAUD O,MERLE-B?RAL H,et al.Human chronic lymphocytic leukemia B cells can escape DNA damage-induced apoptosis through the nonhomologous end-joining DNA repair pathway[J].Blood,2005,105(12):4776-4783.
[13]XIN Y,JIANG F,YANG C,et al.Role of autophagy in regulating the radiosensitivity of tumor cells[J].J Cancer Res Clin Oncol,2017,143(11):2147-2157.
[14]PALUMBO S,PIRTOLI L,TINI P,et al.Different involvement of autophagy in human malignant glioma cell lines undergoing irradiation and temozolomide combined treatments[J].J Cell Biochem,2012,113(7):2308-2318.
[15] YU L,SHANG Z F,HSU F M,et al.NSCLC cells demonstrate differential mode of cell death in response to the combined treatment of radiation and a DNA-PKcs inhibitor[J].Oncotarget,2015,6(6):3848-3860.
[16] LIANG B,KONG D,LIU Y,et al.Autophagy inhibition plays the synergetic killing roles with radiation in the multi-drug resistant SKVCR ovarian cancer cells[J].Radiat Oncol,2012,7:213.
[17]HAN M W,LEE J C,CHOI J Y,et al.Autophagy inhibition can overcome radioresistance in breast cancer cells through suppression of TAK1 activation[J].Anticancer Res,2014,34(3):1449-1455.
[18]卢小迪,朱小东,赵伟,等.抑制磷酸腺苷激活的蛋白激酶活性增强人鼻咽癌细胞放射敏感性[J].重庆医学,2014(22):2900-2902.
[19]SHAHEEN F S,ZNOJEK P,FISHER A,et al.Targeting the DNA double Strand break repair machinery in prostate cancer[J].PLoS One,2011,6(5):e20311.
