IgE高亲和力受体蛋白的制备及其生物功能的鉴定
2018-03-30喻荷莲王世春徐小敏易中梅蒋天伦
徐 婷,张 强,喻荷莲,王世春,徐小敏,易中梅,蒋天伦
(陆军军医大学西南医院输血科,重庆 400038)
过敏性疾病常表现为支气管哮喘、过敏性鼻炎和过敏性皮肤病等,对患者的日常生活质量有极大影响,严重时可危及生命,且这类疾病多由特异性IgE抗体介导的Ⅰ型超敏反应所引起[1-3]。当Ⅰ型超敏反应启动时,IgE抗体结合于其高亲和力受体α段(alpha segment of high affinity IgE receptor,FcεRIα)上,IgE- FcεRIα的交联分子可促使肥大细胞脱颗粒并释放血管活性物质,从而引起过敏反应[4-5]。研究表明,FcεRIα 蛋白在IgE介导的过敏性疾病的发生中占有重要地位[6-8]。因此,本研究通过基因工程技术制备FcεRIα 蛋白并对其生物学功能进行鉴定,为后续进一步探讨FcεRIα在过敏性疾病中的作用奠定研究基础。
1 资料与方法
1.1一般资料 本研究经医院伦理学委员会批准,患者知情同意,从本院收集健康人和慢性荨麻疹(chronic urticaria,CU)患者标本各30例,健康人为对照组,CU患者为观察组。原核载体pET-28a(+)、TOP10菌株、Arcticexpress 表达菌株均购自南京钟鼎生物技术有限公司;DNA纯化试剂盒、质粒提取试剂盒购自美国Axygen公司;限制性内切酶、DNA聚合酶均购自日本Takara公司;Ni2+IDA亲和层析胶购自美国Novagen公司;小鼠抗人IgE单克隆抗体、HRP标记的山羊抗人IgG、HRP标记的山羊抗鼠IgG 单克隆抗体均购自英国Abcam公司;3,3′,5,5′-四甲基联苯胺(TMB)显色试剂盒购自上海碧云天生物技术有限公司。
台式高速离心机购自德国Sorval公司;Biologic LP层析系统、Mini Protean Ⅱ垂直平板电泳系统、Gel Doc2000成像系统、水平电泳系统均购自美国BIO-RAD公司;PTC-200基因扩增仪购自美国MJ Research公司;Hofer ΜV-25紫外透射仪购自美国Amersham Pharmacia公司;JY92-2D超声波细胞粉碎机购自中国新芝科技研究所;Multiskan MK3酶标仪购自美国Thermo公司。
1.2方法
1.2.1人FcεRIα基因的扩增 根据Gene Bank中人的FcεRIα mRNA序列(NM_002001.2),采用基于PCR的精确合成法(PCR-based accurate synthesis,PAS)的方法设计全长拼接引物合成基因FcεRIα,并在引物的上下游分别引入Nco Ⅰ和Xho Ⅰ酶切位点。引物序列如下:P1 上游引物为5′-TGT TTA ACT TTA AGA AGG AGA TAT ACC ATG GGC ATG GTC CCT CAG AAA CCT AAG G-3′;P2 下游引物为5′-AGC CGG ATC TCA GTG GTG GTG GTG GTT GCT CGA GTT GTA GCC AGT ACT TCT CA-3′。反应条件为95 ℃预变性5 min;95 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30 s,共30个循环;最后72 ℃延伸10 min。
1.2.2人FcεRIα重组表达质粒pET-FcεRIα的构建和鉴定 将人FcεRIα基因经Nco Ⅰ/Xho Ⅰ双酶切处理后连接至原核载体pET-28a(+),将重组质粒转入TOP10克隆菌株,挑取阳性克隆子经Xba Ⅰ/Xho Ⅰ双酶切鉴定正确后,送往上海生工公司测序。
1.2.3人FcεRIα的诱导表达 将质粒pET-28a(+)、pET-FcεRIα均转化至Arctic Express感受态细胞中。吸取1 mL菌液为诱导前对照,在剩余菌液中加入诱导剂异丙基-β-D-硫代半乳吡喃糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG),使其终浓度为0.5 mmol/L,11 ℃ 220 r/min振摇过夜,诱导蛋白表达。诱导后的菌液离心10 min,弃上清液,用PBS重悬菌体沉淀,后用超声波破碎细菌,分别收集上清液与沉淀液中的蛋白样品于12% SDS-PAGE检测分析。
1.2.4人FcεRIα包涵体蛋白的复性及纯化 收集菌体超声破碎后的沉淀,用包涵体洗涤液(20 mmol/L Tris,1 mmol/L EDTA,2 mol/L 尿素,1 mol/L NaCl,1% Triton X-100,pH 8.0)洗涤包涵体3次;用溶解缓冲液(20 mmol/L Tris,5 mmol/L DTT,8 mmol/L 尿素, pH 8.0)溶解包涵体,4 ℃放置过夜,于15 000 r/min 室温离心15 min;将上述溶液滴加至透析缓冲液(20 mmol/L Tris-HCl,100 mmol/L NaCl,pH 8.0)中,逐步成倍梯度稀释缓慢搅拌,将蛋白溶液装入透析袋于透析溶液中透析过夜。将包涵体溶液以0.5 mL/min流速上样至Ni-IDA-Sepharose CL-6B亲和层析柱中,利用低压层析系统对重组蛋白进行纯化,并采用12% SDS-PAGE检测分析。
1.2.5ELISA检测人血清中抗FcεRIα自身抗体的水平 将重组FcεRIα 40 ng/mL 100 μL包被于ELISA 板上,4 ℃过夜并封闭,于板孔中加入1∶100 稀释的对照组和观察组血清标本,37 ℃孵育30 min;加入HRP 标记的山羊抗人IgG(1∶5 000) ,37 ℃ 孵育30 min;洗板后,每孔加入TMB 显色液100 μL,于37 ℃避光显色20 min,加入50 μL H2SO4(2 mol/L) ,于20 min内测定吸光度(A)值。
1.2.6ELISA检测鉴定人FcεRIα重组蛋白与人血清中IgE的结合力 将重组FcεRIα 100 μL 包被于ELISA 板上,包被浓度分别设置为0、10、20、30、40、50、60 ng/mL,4 ℃过夜并封闭,于板孔中分别加入PBS(PBS组)、1∶100 稀释的对照组和观察组血清标本,37 ℃孵育30 min;加入100 μL 小鼠抗人IgE(1∶1 000) ,具体操作步骤同上。
1.3统计学处理 应用SPSS16.0 统计软件进行数据分析,组间差异采用单因素方差分析的SNK-q检验,以P<0.05为差异有统计学意义。
2 结 果
2.1人 FcεRIα 基因的扩增
2.1.1人FcεRIα基因的PCR扩增 设计全长拼接引物,通过基于PAS的方法获得FcεRIα 胞外区段基因,经核酸电泳显示目的基因大小约为560 bp,见图1。
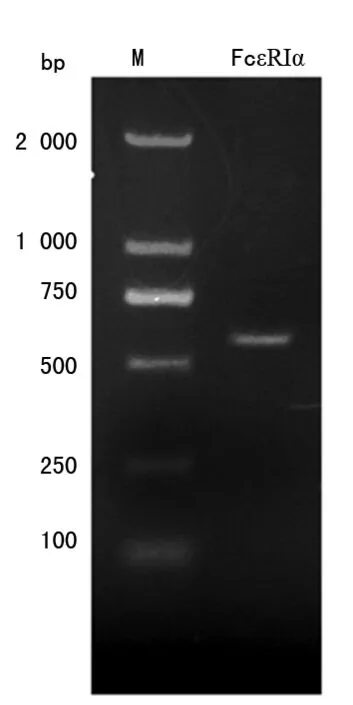
M:DNA分子量标记物
图1人FcεRIα基因合成产物电泳图
2.1.2重组质粒pET-FcεRIα的酶切鉴定 采用限制性内切酶Xba Ⅰ/Xho Ⅰ对重组质粒pET-FcεRIα进行双酶切,电泳条带大小约为5 300 bp 和600 bp,见图2。
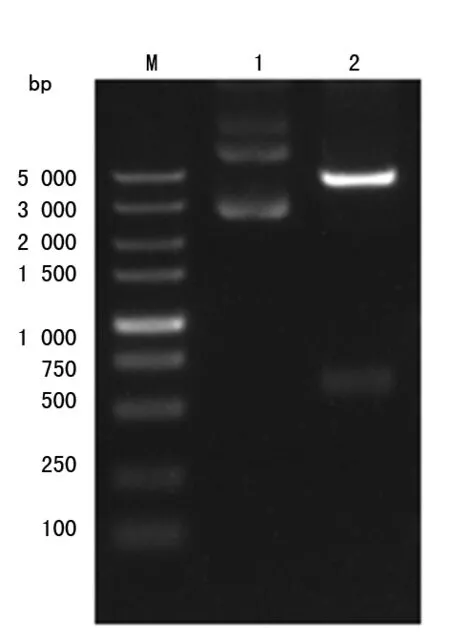
M:DNA分子量标记物;1:酶切前的重组质粒;2:酶切后的重组质粒
图2重组质粒pET-FcεRIα的双酶切鉴定
2.1.3阳性克隆子的测序结果 测序结果与GenBank中FcεRIα 的序列通过BLAST 软件进行比对,结果显示阳性克隆子的序列与原始序列一致。
2.2人FcεRIα 的诱导表达、复性及纯化
2.2.1人FcεRIα的诱导表达 SDS-PAGE结果显示,重组质粒pET-FcεRIα在原核表达宿主Arctic Express菌株中,诱导条件温度为11 ℃、IPTG 浓度为0.5 mmol/L、振摇转速为220 r/min过夜后,有相对分子质量约22 000大小的较浓条带出现,大小与预期蛋白相对分子质量一致,而在无诱导条件中则无条带出现。但是,从图3中可以发现,目标蛋白主要集中在诱导表达的菌体裂解后的沉淀中。
2.2.2人FcεRIα的复性及纯化 SDS-PAGE分析蛋白相对分子质量大小约为22 000(图4),纯化后的蛋白浓度明显高于未纯化前。
2.3人FcεRIα的生物功能的鉴定
2.3.1人血清中抗FcεRIα自身抗体水平的测定 对照组中抗FcεRIα自身抗体浓度为(2.19±0.48)ng/mL,观察组中抗FcεRIα自身抗体浓度为(13.65±1.64)ng/mL,观察组血清中的抗FcεRIα自身抗体浓度明显高于对照组(P<0.05)。
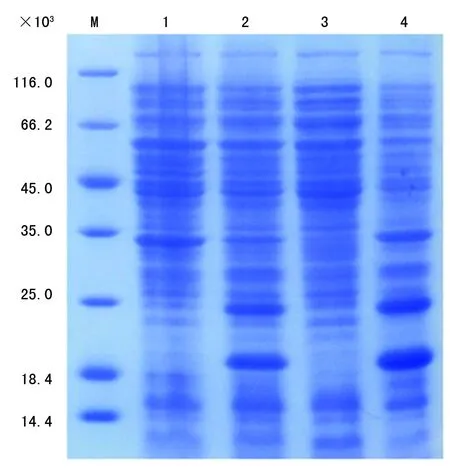
M:蛋白分子量标记物;1:重组质粒未诱导的表达产物;2:重组质粒诱导表达的可溶性产物;3:诱导表达的菌体裂解后上清液;4:诱导表达的菌体裂解后沉淀液
图3人FcεRIα诱导表达的SDS-PAGE分析
2.3.2人FcεRIα重组蛋白与人血清中IgE的结合力测定 将不同浓度的重组人FcεRIα分别包被于ELISA板,随包被蛋白量的增加,A值逐渐增大。当包被量继续增加时,A值不再继续增大。在包被蛋白量相同的条件下,观察组血清的A值均大于对照组(P<0.05,表1)。PBS组A值小于0.1,由此能判断重组的人FcεRIα可与人血清中的IgE 结合,见表1。
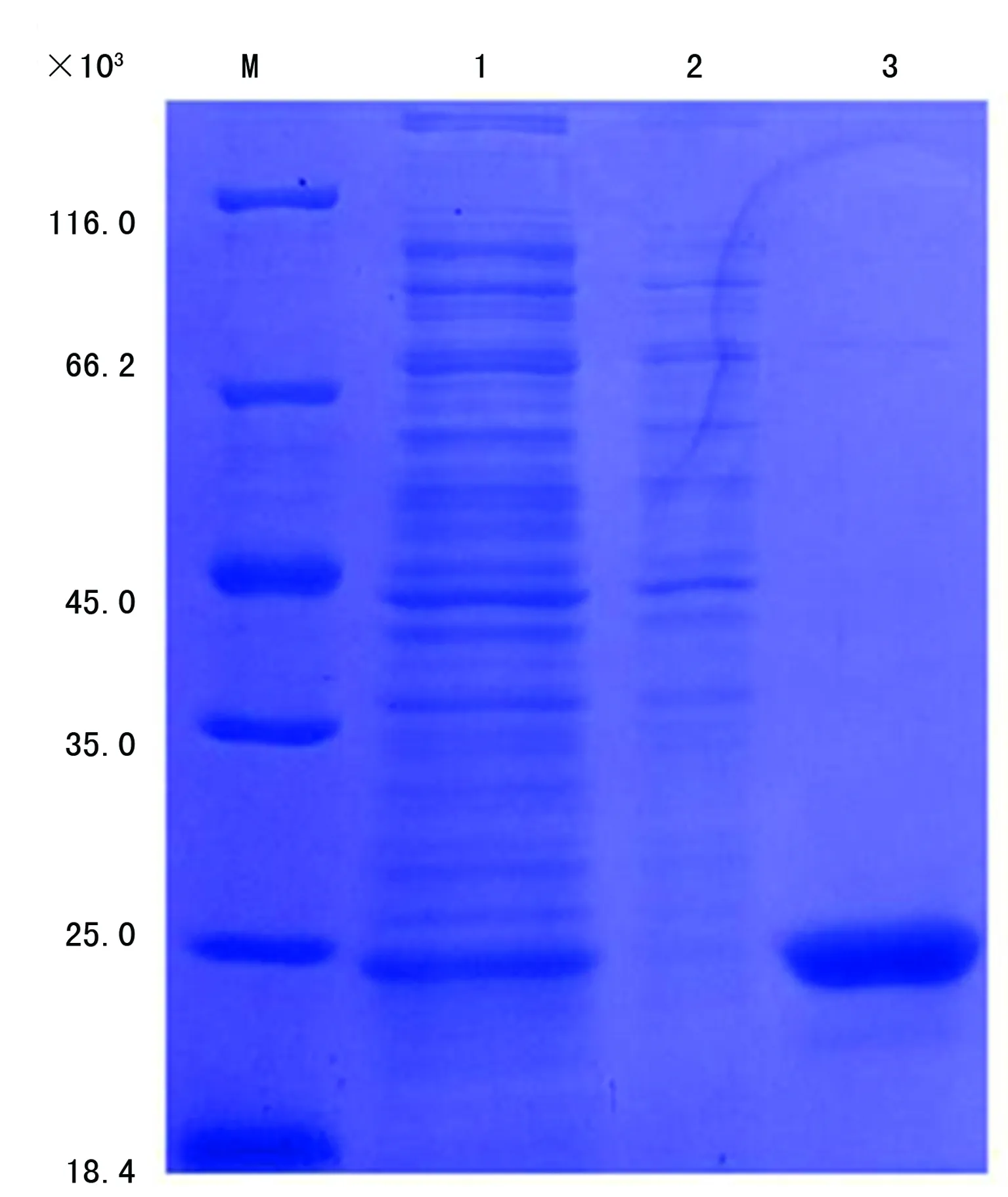
M:蛋白分子量标记物;1:未纯化的表达产物;2:穿透液;3:洗脱液
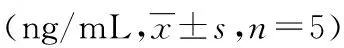
图4 人FcεRIα复性及纯化的SDS-PAGE分析表1 各组不同浓度人FcεRIα重组蛋白与血清中IgE结合的A值比较
a:P<0.05,与对照组比较
3 讨 论
本研究利用pET原核表达系统在体外成功制备了人FcεRIα蛋白并对重组蛋白的生物学功能进行了鉴定。结果表明,通过pET-28a(+)质粒克隆表达出的重组人FcεRIα蛋白能够有效地检测慢性荨麻疹患者血清中的抗FcεRIα抗体水平,并且能够与人血清中的IgE结合。本研究中的原核表达系统采用的是T7启动子,该启动子可调控目的基因的高效表达,同时在目的蛋白中融合His标签,有便于表达后的亲和纯化。实验采用低诱导温度(11 ℃)和低IPTG浓度(0.5 mmol/L),通过减慢蛋白合成速率,从而改变多肽折叠的动力学,进一步增加蛋白的正确折叠,为重组蛋白的正确表达提供了更有利的条件。
FcεRI是一个异四聚体结构,具有一条α链,一条β链,两条γ链,膜外区α链是IgE的结合部位,也是触发过敏反应的基本单位[9]。当多价抗原与IgE交联时,受体即发生微聚集而被激活,经过蛋白激酶活化、磷脂酰肌醇水解及钙离子流动等信号转导过程,使肥大细胞、嗜碱粒细胞发生释放炎性介质、分泌细胞因子及表达黏附分子等生物学反应,参与过敏性炎症的形成,从而引起过敏反应。在此过程中发现,当血清中IgE水平上升时,细胞表面的FcεRI表达也出现上调现象[5,10]。因此,由IgE-FcεRI介导的肥大细胞和嗜碱粒细胞活化被认为是速发性过敏反应的一个重要标志。近年来,关于IgE在过敏反应中的介导作用已逐渐清楚,越来越多的研究更多集中在FcεRIα上,尤其是在由抗FcεRIα自身抗体所引起的自身免疫性荨麻疹等疾病的研究中[11]。
在体外实验中,将自身免疫性荨麻疹患者血清与重组FcεRIα胞外区一起孵育,可抑制组胺释放,提示抗FcεRIα自身抗体结合的表位位于FcεRI的α链上。这种针对FcεRIα的自身抗体作为致病因子存在于约12%~30%的慢性荨麻疹患者血清中,并且这种自身抗体在自身免疫性慢性荨麻疹发病机制中具有重要作用[12-13]。在经典的Ⅰ型过敏反应中,抗原与结合于FcεRI上的IgE发生交联,激活信号传导系统,导致效应细胞脱颗粒而发生过敏,但在自身免疫性慢性荨麻疹中,IgG-抗IgE自身抗体与结合在FcεRI上的IgE发生交联,或IgG-抗FcεRIα自身抗体使相邻FcεRI直接交联来激活效应细胞释放炎症介质[14-15]。但是,目前国内在临床上尚未出现这类自身抗体的商品化诊断试剂盒,严重影响了抗FcεRIα自身抗体引起的此类疾病的诊断。因此,本研究通过基因工程技术制备了FcεRIα 蛋白并对其生物学功能进行了鉴定,不仅为抗FcεRIα自身抗体的诊断研究提供了实践基础,同时为后续进一步探讨FcεRIα在IgE介导的过敏性疾病中的作用奠定了研究基础。
[1]PATEL T R,SUR S.IgE and eosinophils as therapeutic targets in asthma[J].Curr Opin Allergy Clin Immunol,2017,17(1):42-49.
[2]WANG Y,GHOSHAL A G,BIN ABDUL MUTTALIF A R,et al.Quality of Life and economic burden of respiratory disease in Asia-Pacific-Asia-Pacific burden of respiratory diseases study[J].Value Health Reg,2016,9:72-77.
[3]CHANG W P,KUO C N,KUO L N,et al.Increase risk of allergic diseases in patients with ankylosing spondylitis:A 10-year follow-up population-based study in Taiwan[J].Medicine(Baltimore),2016,95(45):e5172.
[4]CIPRANDI G,MARSEGLIA G L,CASTAGNOLI R A,et al.From IgE to clinical trials of allergic rhinitis[J].Expert Rev Clin Immunol,2015,11(12):1321-1333.
[5]GOULD H J,SUTTON B J.IgE in allergy and asthma Today[J].Nat Rev Immunol,2008,8(3):205-217.
[6]LIU F,XU L,CHEN N,et al.Neuronal Fc-epsilon receptor Ⅰ contributes to antigen-evoked pruritus in a murine model of ocular allergy[J].Brain Behav Immun,2017,61(16):165-175.
[7]CRUSE G,YIN Y,FUKUYAMA T,et al.Exon skipping of FcεRIβ eliminates expression of the high-affinity IgE receptor in mast cells with therapeutic potential for allergy[J].Proc Natl Acad Sci U S A,2016,113(49):14115-14120.
[8]HONG J Y,BAE J H,LEE K E,et al.Antibody to FcεRIα suppresses immunoglobulin E binding to High-Affinity receptor Ⅰ in allergic inflammation[J].Yonsei Med J,2016,57(6):1412-1419.
[9]FIEBIGER E,TORTORELLA D,JOUVIN M H,et al.Cotranslational endoplasmic reticulum assembly of FcepsilonRI controls the formation of functional IgE-binding receptors[J].J Exp Med,2005,201(2):267-277.
[10]KRAFT S,KINET J P.New developments in FcepsilonRI regulation,function and inhibition[J].Nat Rev Immunol,2007,7(5):365-378.
[11]YUTA A.Immunotherapy for allergic rhinitis[J].Nihon Jibiinkoka Gakkai Kaiho,2015,118(2):152-155.
[12]DU TOIT G,PRESCOTT R,LAWRENCE P,et al.Autoantibodies to the high-affinity IgE receptor in children with chronic urticaria[J].Ann Allergy Asthma Immunol,2006,96(2):341-344.
[13]ECKMAN J A,HAMILTON R G,GOBER L M,et al.Basophil phenotypes in chronic idiopathic urticaria in relation to disease activity and autoantibodies[J].J Invest Dermatol,2008,128(8):1956-1963.
[14]KONSTANTINOU G N,ASERO R,FERRER M,et al.EAACI taskforce position paper:evidence for autoimmune urticaria and proposal for defining diagnostic criteria[J].Allergy,2013,68(1):27-36.
[15]LEE M F,LIN T M,LIU S W,et al.A rapid method of detecting autoantibody against FcεRIα for chronic spontaneous urticaria[J].PLoS One,2014,9(10):e109565.
