Map3k1基因下调对B6小鼠眼睑角质形成细胞增殖和迁移能力的影响*
2018-03-30刘莉莉夏婷婷朱顺星
景 瑾,刘莉莉,尤 杰,夏婷婷,张 进,刘 春,朱顺星△
(1.南通大学杏林学院,江苏南通 226001;2.南通大学实验动物中心,江苏南通 226001)
研究表明眼睑发育异常主要是由于眼睑角质形成细胞迁移受阻所致[1]。大量资料显示,Map3k1基因在小鼠眼睑形态建成过程中起到关键作用。Map3k1是丝裂原活化蛋白激酶(MAPK)家族中的重要成员,其表达的蛋白细胞外信号调节激酶1(MEKK1)具有广泛的生物学功能。MEKK1蛋白是MAPK信号传导通路的结点,可以调节JNK[2]、ERK1/2[3]、P38[4]、IKK-NFκB[5]等信号通路,这些信号通路参与调控相关细胞的增殖、分化、凋亡、迁移和侵袭等[2-5],对细胞的生存、生长起着至关重要的作用。本研究拟采用RNA干扰技术,实现对Map3k1的特异性沉默,来检测其对B6小鼠眼睑角质形成细胞生物学功能的影响。
1 材料与方法
1.1材料
1.1.1实验动物 B6(C57BL/6,B6)小鼠购自南通大学实验动物中心,饲养在清洁级屏障动物房内, 室内温度为(23±2)℃, 湿度控制为(55±5)%,自由采食和饮水,室内照明采用12 h∶12 h 明暗交替,定期更换笼具、垫料。
1.1.2主要仪器及试剂 CO2细胞培养箱购自Thermo公司(美国);倒置相差显微镜购自Leica公司(德国);抗菌药物、大豆胰蛋白酶抑制剂购自Amresco公司(美国);角质形成细胞无血清培养基(DK-SFM)、0.25%胰蛋白酶-乙二胺四乙酸(EDTA)购自Gibco公司(美国);中性蛋白酶Ⅱ购自Roche公司(瑞士);24孔细胞培养板购自Corning公司(美国);质粒抽提试剂盒购自Omega公司(美国);Mouse monoclonal to MEKK1购自Abcam公司(英国);Anti-Mouse IgG、HRP-linked Antibody购自Cell Signaling公司(美国)。
1.2方法
1.2.1B6小鼠眼睑角质形成细胞的分离和原代培养 取1 d B6小鼠,超净台中取眼睑,在75%乙醇中清洗,然后在0.01 mol/L磷酸盐缓冲液(PBS)中清洗;将眼睑放入添加有中性蛋白酶Ⅱ(3 mg/mL)和抗菌药物的DK-SFM 培养液中,4 ℃消化18 h;加入等体积的PBS,分离真皮和表皮,将表皮充分剪碎,加入0.25%胰蛋白酶-EDTA,37 ℃消化约10 min;再加入大豆胰蛋白酶抑制剂终止消化,1 200 r/min 室温离心5 min,弃上清液,PBS清洗一遍,加入含有10 ng/mL表皮生长因子(EGF)的DK-SFM 培养液重悬细胞;调整细胞密度为2×105个/mL;将细胞接种于12孔板,37 ℃、5% CO2培养箱中培养;24 h后更换培养液,每隔1 d换液1次。
1.2.2靶向沉默Map3k1基因的amiRNA表达载体 本课题组在前期实验中已成功构建靶向沉默Map3k1基因的amiRNA表达载体,并筛选出干扰效率最高的质粒[6]。Map3k1基因序列的miRNA靶向序列如下,miRNA3-F:5′-TGC TGA TCC ATC TCC TTT AAT AGG GAG TTT TGG CCA CTG ACT GAC TCC CTA TTA GGA GAT GGA T-3′;miRNA3-R:5′-CCT GAT CCA TCT CCT AAT AGG GAG TCA GTC AGT GGC CAA AAC TCC CTA TTA AAG GAG ATG GAT C-3。
1.2.3菌种复性与质粒抽提 -80 ℃冰箱中取出之前所保存的菌种,冰上溶解;吸取50 μL于1 mL LB液体培养基(含Amp+)中,37 ℃、220 r/min培养1 h;菌种状态良好时,直接以划线法涂LB平板[含氨苄青霉素(Amp+)],倒扣平板,37 ℃培养过夜;用10 μL枪头挑取平板上单克隆菌落至5 mL LB液体培养基(含Amp+)中,37 ℃、220 r/min摇床培养过夜,1 mL保种,1 mL送上海生工生物工程股份有限公司进行测序;测序正确的再次摇菌,按试剂盒说明书提取质粒,获得的质粒,核酸蛋白定量仪测浓度,-20 ℃存储备用;分装部分抽提的质粒DNA,送上海生工生物工程股份有限公司进行测序分析。
1.2.4Map3k1 amiRNA-3质粒转染B6小鼠眼睑角质形成细胞 取2 μL Map3k1 amiRNA-3质粒(568 ng/μL)溶于100 μL Opti-MEM基培中,取2 μL Lipofectamin 2000溶于100 μL Opti-MEM基培中,分别轻轻混匀,室温各孵育5 min;将两个混合液轻轻混匀,室温孵育20 min;角质形成细胞换液,更换DK-SFM 培养液800 μL;混合液加入12孔板中,轻轻混匀,细胞于37 ℃,5% CO2培养箱中培养6 h后更换DK-SFM 培养液。细胞转染后24、48、72 h分别提取总RNA和总蛋白。
1.2.5Real-Time PCR检测Map3k1 mRNA相对表达量 根据实验时间点要求提取细胞总RNA,采用TRIzol法提取。使用逆转录试剂盒RevertAidTMFirst Strand cDNA Synthesis Kit(Roche公司)进行逆转录反应。根据Map3k1基因mRNA设计RT-PCR反应引物如下,GAPDH-F:5′-GGA GCG AGA CCC CAC TAA C-3′,GAPDH-R:5′-GGC GGA GAT GAT GAC CCT-3′;Map3k1-F:5′-GGT CCT AAG AGG TCA GCA GTA TG-3′,Map3k1-R:5′- GGA CAG GTG TGA CGG GAT G-3′。RT-PCR反应采用SYBR Green MiX试剂,反应体系如下:SYBR Green mix 10 μL、 Primer-F(10 pmol)0.5 μL 、Primer-R(10 pmol)0.5 μL 、cDNA 1 μL、ddH2O 8 μL。RT-PCR反应条件为:95 ℃,5 min;45个循环(95 ℃,15 s;60 ℃,20 s;72 ℃,30 s),每个循环在延伸阶段收集荧光;产物熔解曲线分析:95 ℃,15 s;60 ℃,1 min;95 ℃,15 s。各组细胞目的基因均以内参基因GAPDH进行校正,为了减少误差,实验重复3批样本,每个样本均重复3次,使用2-ΔΔCT法进行相对定量分析。
1.2.6Western blot检测Map3k1蛋白相对表达量 根据实验时间点要求提取各组细胞总蛋白;并取适量以BCA蛋白定量试剂盒测定蛋白浓度;按说明书配制分离胶及浓缩胶:Gapdh配制12%的分离胶,Map3k1配制6%的分离胶;常规程序电泳,直至目的蛋白充分跑开;电泳结束后,Gapdh以300 mA,60 min的条件转膜,Map3k1以110 V,120 min的条件转膜;转膜结束后将膜取出,置于封闭液中室温封闭2 h;在膜上滴加适量1∶1 000稀释的一抗,4 ℃孵育过夜;用TBST洗涤1次,TBS洗涤2次;加二抗室温孵育2 h;再用TBST洗涤1次,TBS洗涤2次,取1 mL ECL显色液显色1 min。
1.2.7四甲基偶氮唑盐(MTT)法检测B6小鼠眼睑角质形成细胞的增殖水平 取对数生长期细胞,胰酶消化后离心收集,加入DK-SFM 培养液重悬细胞,细胞计数调整为 2×104/mL。将制备好的细胞悬液边轻轻混匀边加入96 孔板,每孔加入 100 μL;将接种好的细胞培养板放入培养箱中培养过夜,第2天做转染,分为Ctrl Map3k1组与Map3k1 amiRNA-3组,Ctrl Map3k1组只加入培养基不加细胞,每组设5个复孔取均值,实验重复 3 次。在转染24、48、72 h后MTT法测细胞活力;不同时间Map3k1 amiRNA-3组及Ctrl Map3k1组每孔加入10 μL MTT 溶液,继续培养 4 h;再加入 100 μL Formanzan溶解液,培养箱继续孵育约4 h,显微镜下观察待结晶物充分溶解后,在酶标仪吸光度(A)570 nm处测量各孔的A值。
1.2.8划痕实验检测B6小鼠眼睑角质形成细胞的迁移能力 取对数生长期细胞接种到24孔板,每孔接种1×106个细胞,并设3个重复;Map3k1 amiRNA-3组与Ctrl Map3k1组于转染36 h后,弃原培养液,加入含有10 μg/mL 丝裂霉素C的DK-SFM培养液培养12 h;然后用100 μL的枪头在每个孔的中央进行十字划痕;吸去培养液,0.01 mol/L PBS 轻洗;加入含有10 ng/mL EGF的DK-SFM 培养液,于十字划痕处显微镜观察拍照,记为0 h,每孔照数个不同的位置;培养24 h 后,依据记录的大致位置再次拍照。
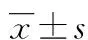
2 结 果
2.1Map3k1 amiRNA-3干扰质粒 测序结果与预期完全吻合(图1),miRNA序列正确插入pcDNA-miRNA载体中。
2.2Map3k1 amiRNA-3质粒对Map3k1基因的干扰效率 Real-time PCR结果(图2A)表明在转染Map3k1 amiR-3质粒后48 h,B6小鼠眼睑角质形成细胞Map3k1基因mRNA的表达量下降最为显著,干扰效率高达70%(P<0.01);Western blot结果(图2B、C)表明在转染Map3k1 amiR-3质粒后72 h,B6小鼠眼睑角质形成细胞Map3k1基因蛋白的表达量下降最为显著,干扰效率高达70%(P<0.05)。
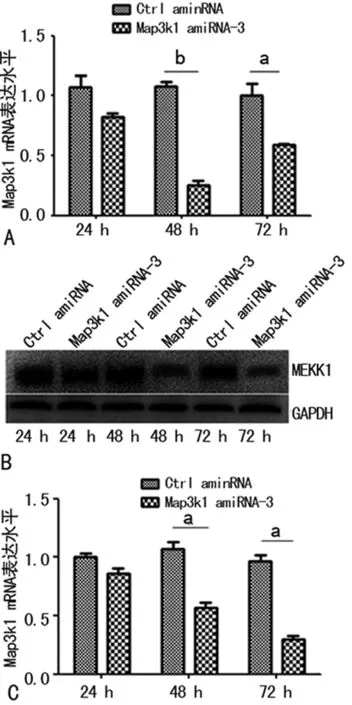
A:Real-Time PCR检测Map3k1 mRNA相对表达量;B:Western blot检测Map3k1 amiRNA-3蛋白的相对表达量;C:Map3k1 amiRNA-3蛋白的相对表达量;a:P<0.05,b:P<0.01
图2 Real-Time PCR、Western blot检测Map3k1 amiRNA-3的干扰效率
2.3MTT法检测B6小鼠眼睑角质形成细胞的增殖水平 细胞增殖水平检测结果显示:Map3k1 amiRNA-3组在转染24、48、72 h细胞增殖水平显著低于Ctrl amiRNA组(P<0.05)。见表1、图3。
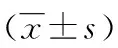
表1 MTT法不同时间细胞增殖水平检测
a:P<0.05,b:P<0.01,与Ctrl amiRNA组比较
2.4划痕实验检测B6小鼠眼睑角质形成细胞的迁移能力 Map3k1 amiRNA-3组角质形成细胞,在划痕后24 h,其穿过划痕区的细胞数量与相对距离均明显低于转染空载体的Ctrl amiRNA组(图4),定量分析发现Ctrl amiRNA组迁移的细胞数为(615±39)个,Map3k1 amiRNA-3组仅有(325±34)个,差异有统计学意义(P<0.05);细胞迁移划痕区的相对距离,Ctrl amiRNA组为(0.339±0.015),MAp3k1 amiRNA-3组为(0.181±0.027),两组差异有统计学意义(P<0.05)。

图4 划痕实验检测B6小鼠眼睑角质形成细胞的迁移能力
3 讨 论
眼睑是眼球前的软组织,当眼受到外界各种刺激时,可通过中枢神经的指挥及时将其关闭,从而阻挡外来异物或强光对眼睛造成伤害,对眼的发育和保护具有重要作用。若眼睑发育异常便会受到各种眼部疾病的困扰,如角膜病、白内障、视力减退等。研究表明眼睑发育异常主要是由于眼睑角质形成细胞迁移受阻所致[1]。有研究发现通过MEKK1的转导,可以引发角质形成细胞的迁移,MEKK1对角质形成细胞的运动有着至关重要的作用[7]。
RNA干扰是由双链RNA(dsRNA)诱发同源mRNA高效且特异性降解的现象,可以特异性剔除或关闭目的基因的表达,该技术具有成本低廉、高效率、高特异性、操作方便等优势[8-10],已成为各大实验室探索基因功能的常用技术。
Map3k1基因位于5q11.2,其编码的蛋白称为MEKK1,全长196×103。MEKK1是MAPK家族中的重要成员,具有Ser/Thr激酶活性,其C-端为催化结构域,N-端为调节结构域,可以磷酸化与其结合的下游靶蛋白,从而介导蛋白间的相互作用并影响其行为和生物学功能。MEKK1蛋白是MAPK信号传导通路的结点,可以调节JNK[2]、ERK1/2[3]、P38[4]、IKK-NFκB[5]等信号通路,这些信号通路参与调控相关细胞的增殖、分化、凋亡、迁移和侵袭等[2-5]。Map3k1对细胞的发生、发展起着至关重要的作用,有研究表明Map3k1具有可决定细胞命运的开关样功能,即促进和抑制细胞凋亡的双重作用[11]。而MEKK1 作为几个 MAPK 通路的上游调节因子,亦涉及不同种类和细胞类型的生物学反应,包括角质形成细胞的分化、T细胞活化和压力刺激诱导的细胞凋亡等。因而,本研究拟采用RNA干扰技术,实现对Map3k1的特异性沉默,来检测其对B6小鼠眼睑角质形成细胞生物学功能的影响。期许为更好的理解、掌握Map3k1在B6小鼠眼睑角质形成细胞中的作用,及其在眼睑发育过程中的作用提供理论依据。
首先通过前期实验中已成功构建靶向沉默Map3k1基因的amiRNA表达载体[6],实现对Map3k1的特异性沉默,干扰效率高达70%,为研究B6小鼠眼睑角质形成细胞生物学效应在干扰Map3k1前后的变化奠定了基础。
Map3k1基因参与调节各种类型的细胞运动迁移,研究发现Map3k1基因敲除的新生鼠由于上皮细胞迁移缺陷,导致出生时眼睑不能闭合[12],说明Map3k1基因在小鼠眼睑形态建成过程中起到关键作用。Map3k1表达的缺乏可减少细胞的迁移和侵袭能力[13]。在本实验中发现靶向抑制Map3k1的表达后,B6小鼠眼睑角质形成细胞的迁移能力被显著抑制,无论是迁移的距离还是迁移的细胞数量都显著下调(P<0.05)。此外,还发现Map3k1的表达被抑制后,会影响B6小鼠眼睑角质形成细胞的增殖能力(P<0.05)。这些结果表明靶向抑制Map3k1的表达能够广泛的影响B6小鼠眼睑角质形成细胞的生物学行为,从而影响眼睑的发育。
[1]KATO S,MOHRI Y,MATSUO T,et al.Eye-open at birth phenotype with reduced keratinocyte motility in LGR4 null mice[J].FEBS Lett,2007,581(24):4685-4690.
[2]LU H J,NING X J,TAO X E,et al.MEKK1 associated with neuronal apoptosis following intracerebral hemorrhage[J].Neurochem Res,2016,41(12):3308-3321.
[3]CHENG Y,LIN C H,CHEN J Y,et al.Induction of connective tissue growth factor expression by hypoxia in human lung fibroblasts via the MEKK1/MEK1/ERK1/GLI-1/GLI-2 and AP-1 pathways[J].PLoS One,2016,11(8):1-23.
[4]HUANG D S,LI X J,SUN L,et al.Regulation of hippo signalling by p38 signalling[J].J Mol Cell Biol,2016,8(4):328-337.
[5]AL-SADI R,GUO S H,YE D M,et al.TNF-alpha modulation of intestinal tight junction permeability is mediated by NIK/IKK-alpha axis activation of the canonical NF-kappa B pathway[J].Am J Pathol,2016,186(5):1151-1165.
[6]王胜洁,刘春,汪海峰,等.靶向抑制MAP3K1对小鼠乳腺癌细胞生物学行为的影响[J].黑龙江畜牧兽医,2016,290:26-31.
[7]XIA Y,KAO W W.The signaling pathways in tissue morphogenesis:a lesson from mice with eye-open at birth phenotype[J].Biochem Pharmacol,2004,68(6):997-1001.
[8]SUGAHARA R,TANAKA S,JOURAKU A,et al.Geographic variation in RNAi sensitivity in the migratory locust[J].Gene,2017,605:5-11.
[9]KAMATH R S,FRASER A G,DONG Y,et al.Systematic functional analysis of the Caenorhabditis elegans genome using RNAi[J].Nature,2003,421(6920):231-237.
[10]VOLPE T,KIDNER C,HALL I M,et al.Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi[J].Science,2002,297(5588):1833-1837.
[11]ZEBROWSKI D C,ALCENDOR R R,KIRSHENBAUM L A,et al.Caspase-3 mediated cleavage of MEKK1 promotes p53 transcriptional activity[J].J Mol Cell Cardiol,2006,40(5):605-618.
[12]YUJIRI T,WARE M,WIDMANN C,et al.MEK kinase 1 gene disruption alters cell migration and c-Jun NH2-terminal kinase regulation but does not cause a measurable defect in NF-kappa B activation[J].Proc Natl Acad Sci U S A,2000;97:7272-7277.
[13]STEED E,ELBEDIWY A,VACCA B,et al.MarvelD3 couples tight junctions to the MEKK1-JNK pathway to regulate cell behavior and survival[J].J Cell Biol,2014,204(5):821-838.
