17β-雌二醇对大鼠神经病理性疼痛阈值的影响*
2018-03-30顾雅娟
邓 超,顾雅娟,张 军
(石河子大学医学院第一附属医院麻醉科,新疆石河子 832000)
疼痛阈值具有性别差异[1],雌激素受体分布于中枢神经系统和外周神经系统中许多与痛觉有关的区域,可在多水平上影响疼痛的产生和传递[2],N-甲基-D-天冬氨酸受体1(N-methyl-D-aspartic acid receptor 1,NMDAR1)为兴奋性神经递质谷氨酸受体的一种亚型,广泛存在于神经系统中,并参与各种疼痛的产生、传导和维持,尤其在神经病理疼痛中的伤害性信息传递和调节过程中发挥了主要作用[3-4],但雌激素在调节神经病理性疼痛中所起的作用还不十分清楚。本研究对坐骨神经慢性压榨损伤(chronic constriction injury of the sciatic nerve,CCI)大鼠模型进行研究,探讨17β-雌二醇对神经病理性大鼠疼痛阈值的影响。
1 材料与方法
1.1实验动物 本实验已经医院动物管理伦理委员会同意,选用3个月龄健康,清洁级SD雌性大鼠体质量250 g左右,由新疆维吾尔自治区疾病控制中心提供,动物合格证编号:SYXK(新) 2016-0002。热刺激实验反应5~30 s的大鼠被留用,反应异常大鼠被剔除,实验室温度20~22 ℃,湿度50%~60%,光照时间8:00-20:00,给予同样标准的饮食,安静环境,分笼饲养1周,在异氟烷麻醉下,从脊柱两侧肋下,切口入腹行双侧卵巢切除术,休息5 周。
1.2方法
1.2.1动物模型制备与分组
1.2.1.1CCI动物模型的建立 按照Bennett 等的方法构建CCI动物模型[5]。手术主要步骤如下:异氟烷吸入麻醉下,固定大鼠于手术台,常规备皮、消毒、铺巾。暴露左侧坐骨神经,在接近其分叉之前游离出约7 mm的神经,用3根4-0的铬肠线间隔1 mm进行结扎,要求仅留下缢痕而不阻断神经血供,逐层缝合肌肉和皮肤,经肌内注射40万U青霉素预防感染,待大鼠清醒后分笼饲养。
1.2.1.2实验分组与处理 大鼠采用随机数字表法分5组(每组10只)。假手术组、CCI组、雌二醇组、拮抗剂组、复合组。假手术组:分离暴露左侧坐骨神经但不结扎,以等容量生理盐水颈后皮下注射; CCI组:制备CCI动物模型后,以等容量生理盐水颈后皮下注射。 雌二醇组:制备CCI动物模型后,颈后皮下注射17β-雌二醇(2 μL/d,Sigma 公司,美国)。拮抗剂组:制备CCI动物模型后,颈后皮下注射NMDAR1拮抗剂AP-5(100 nmol/d)。复合组:制备CCI动物模型后,颈后皮下注射:17β-雌二醇(2 μL/d )+ AP-5 (100 nmoL/d)。所有大鼠均于手术14 d后,再次异氟烷深麻醉后处死,取左侧L4~6脊髓背根神经节,采用免疫组织化学法和 Western blot 法测定脊髓背根神经节NMDARl蛋白的表达。
1.2.2检测指标及方法
1.2.2.1机械刺激缩足反射阈值测定 于术前1 d(T0)、术后1 d(T1)、3 d(T2)、7 d(T3)、14 d(T4),测定大鼠机械刺激缩足反射阈值(paw withdrawal mechanical threshold,PWMT),测试前将大鼠置于底为5 mm×5 mm的金属丝网眼垫的独立分隔的透明有机玻璃箱内,环境适应30 min,以减少正式测试时由于对陌生环境的应激而干扰实验结果。然后按照质量递增的顺序(1.0、1.4、2.0、4.0、6.0、8.0、10.0、15.0 g)依次施加von Frey纤维丝(stoeling公司,意大利) ,垂直刺激大鼠左后肢足底中部,为了防止测试对实验动物造成实质性的损伤,实验设定的最大刺激强度为15 g,以纤毛稍稍弯曲作为完全受力的标准。PWMT阈值为使大鼠出现抬足或添足时,施加von Frey纤维丝最小克数的值,每次刺激持续5 s,间隔30 s以上,连续5次。取中间3个数值求平均值。所有测试都在8:00-10:00。
1.2.2.2热刺激缩足反射潜伏期测定 于T0、T1、T2、T3、T4时点,测定大鼠热刺激缩足反射潜伏期(paw withdrawal thermal latency,PWTL),使用PL-200热刺痛仪(成都泰盟科技有限公司),测定大鼠左后肢足底中部皮肤对热刺激的反应,PWTL阈值为从照射到以出现抬足、躲避或舔足动作的缩足反应的时间。间隔5 min,连续测定5次,取中间3个数值求平均值,为了防止测试对实验动物造成实质性的损伤,单次照射不超过20 s。
1.2.2.3免疫组织化学法测定脊髓背根神经节NMDARl T4时点测定痛阈后,每组随机取5只大鼠,异氟烷深麻醉后,仰卧固定,快速开胸,暴露心脏,经左心室插管至升主动脉,剪开右心耳,进行心脏灌注。先以4 ℃无菌生理盐水快速灌注,至流出的液体变清亮,再用4%多聚甲醛先快后慢灌流固定约30 min。大鼠取俯卧位,清除左后肢毛发,在股骨中心处解剖钝性分离肌腱,找到坐骨神经,沿坐骨神经上行找到与之相连的L4~6脊神经节,分离并取出,置于10%的中性甲醛固定48 h,石蜡包埋,4 mm连续切片。按照SP二步法免疫组织化学试剂盒说明书(中杉金桥,北京)进行染色,每只大鼠做5张切片。主要过程包括:(1)3%的H2O2,阻断内源性过氧化物酶;(2)用枸橼酸在高温和高压下对样品进行8 min的抗原修复,然后冷却至室温;(3)在室温下,用1×磷酸盐缓冲液冲洗3次(5分/次);(4)NMDAR1一抗(1∶800,兔抗,ab59302,Abcam公司,英国)50 μL滴于玻片上,4 ℃冰箱孵育12 h;(5)每张切片在室温(20~25 ℃)加50 μL加入二抗即用型免疫组织化学MaxVisionTM试剂盒(1∶200,山羊抗兔,KIT-5005,迈新生物技术,福州);(6)DAB显色,苏木精复染,二甲苯透明,中性树脂封片。大鼠L4~6脊髓背根神经节阳性细胞,多为圆形或椭圆形的神经元,定位于细胞质,胞质呈棕黄色,呈强阳性表达。测量NMDARl免疫反应的平均吸光度(A)值,用采用MoticMed 6.0数码彩色医学图像分析系统(北京麦克奥迪公司)进行NMDARl平均光密度测定。
1.2.2.4Western blot法测定脊髓背根神经节NMDARl 将每组剩余的5只大鼠,异氟烷深麻醉后断头,立即取L4~6脊神经节,在冰浴下将上述组织匀浆,抽提总蛋白,BCA法测定蛋白浓度。蛋白样本40 μg与等体积的上样缓冲液混合,煮沸8 min,迅速冷却,8%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后,转至0.25 μm PVDF膜,5%脱脂奶粉(1 g脱脂奶粉,20 mL 1×TBST,0.5 mL吐温20)室温封闭1 h,加入NMDARl一抗(1∶200,兔抗,ab59302,Abcam公司,英国)和内参β-actin(1∶1 000,小鼠抗,中杉金桥,中国),4 ℃孵育12 h,1×TBST清洗5 min×6次,加二抗(1∶4 000,山羊抗兔,Santa Cruz公司,美国),室温(25 ℃)条件下孵育2 h,ECL超敏发光试剂盒(Thermo公司,34094,中国)显色,用ImagePro4.0软件(Bid-Rad公司,美国)对蛋白条带灰度值进行统计学分析。
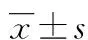
2 结 果
2.1一般结果 5组大鼠均无伤口感染,自由觅食。假手术组活动如常。CCI、雌二醇组、拮抗剂组、复合组,术后出现手术侧足趾并拢,偶有外翻,患肢行走可呈现跛行;站立时可见后足悬空,不敢着地,以健侧肢体持重,有舔足等保护动作,均无自噬现象,表明建模成功。
2.2PWMT和PWTL测定结果 与假手术组比较,术后所有时点,CCI组和雌二醇组大鼠PWMT降低,PWTL缩短(P<0.05)。与CCI组比较,雌二醇组大鼠术后所有时点,均表现出PWMT降低,PWTL缩短(P<0.05),见表1、2。
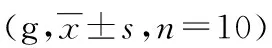
表1 各组大鼠不同时间段PWMT比较
a:P<0.05,与假手术组同时点比较;b:P<0.05,与CCI组同时点比较
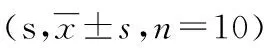
表2 各组大鼠不同时间段PWTL比较
a:P<0.05,与假手术组同时点比较;b:P<0.05,与CCI组同时点比较
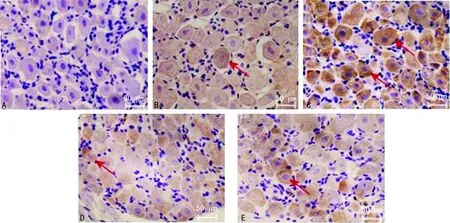
A:假手术组;B:CCI组;C:雌二醇组;D:拮抗剂组;E:复合组
图1各组免疫组织化学检测的结果(×200)
2.3免疫组织化学结果 大鼠L4~6脊髓背根神经节阳性细胞,多为圆形或椭圆形的神经元,定位于细胞质,胞质呈棕黄色,呈强阳性表达,见图1。假手术组、CCI组、雌二醇组、拮抗剂组、复合组A值分别为0.42±0.05、0.71±0.06、0.93±0.11、0.67±0.07、0.73±0.06。与假手术组比较,其余各组A显著升高(P<0.05);与CCI组比较,雌二醇组A显著升高(P<0.05)。
2.4Western blot结果 与假手术组比较,其余各组的NMDARl表达增高(P<0.05);与CCI组比较,雌二醇组的NMDARl表达显著升高(P<0.05),见图2。
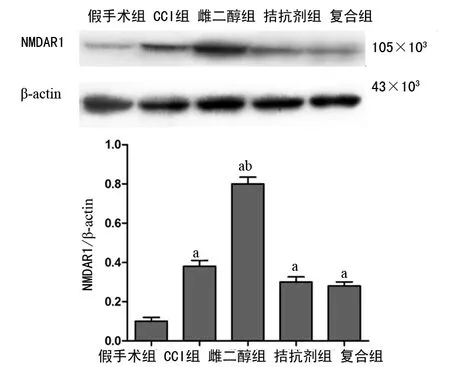
a:P<0.05,与假手术组同时点比较;b:P<0.05,与CCI组同时点比较
图2各组Western blot检测的结果
3 讨 论
国内外不同领域的研究者均都围绕神经病理性疼痛的发生,激发及传导的机制,解剖学和组织形态学变化,分子生物学及电生理学等试图对攻克神经病理性痛进行了研究,但迄今为止对神经病理性痛机制的认识仍十分局限,效果都不甚满意[6]。神经损伤致痛模型可分为:坐骨神经慢性缩窄性损伤模型、脊神经结扎模型、背神经节慢性压迫模型等[7]。以上模型各有优势,本研究采用CCI模型,因为与其他模型相比,其损伤程度可控性强,疼痛变化稳定,重复操作效果基本一致[8],本研究的大鼠在造模后,除假手术组外,其余各组的疼痛感在术后第1天即可出现并持久至术后第7天达到峰值,在术后各时点PWMT明显降低,PWTL显著缩短,证明建模成功,大鼠行为学结果显示,在术后各时点雌二醇组与CCI组比较,大鼠的PWMT降低更明显,PWTL时间更短,提示,雌激素可能在慢性神经病理性疼痛状况下,提高了机体对伤害性机械刺激和热刺激的敏感性,降低动物热痛阈,使机体对机械刺激和热刺激耐受能力下降,提示雌激素可能在病理状况下,在神经系统中发挥了作用,参与了疼痛的传递,并从行为学方面验证了雌激素可能增加了CCI模型大鼠患肢的敏感性。提示雌激素水平较高的大鼠对疼痛的反应更敏感,其机制可能是,雌激素在病理状况下,在神经系统中发挥了作用,参与了疼痛的传递,并从行为学方面验证了雌激素增加了CCI模型大鼠患肢的敏感性。本研究所测大鼠的痛域为机械痛域和热痛域,它们是大鼠痛域的两种表现形式,有研究显示机械痛阈的改变反应的是有髓神经介导的痛觉信号的变化,而热痛阈的改变反应的是无髓C纤维介导的痛觉信号的变化。因此雌激素组大鼠可能是由于雌激素放大了有髓神经和无髓C纤维介导的痛觉信号,而降低了大鼠的痛域,使痛觉敏化并产生痛觉超敏的结果。
N-甲基-D-天冬氨酸(NMDA)是存在于神经系统的正常兴奋性神经递质谷氨酸受体,参与疼痛的生成、传播和维护过程。NMDA受体活性调节的失衡与神经系统疾病发病机制密切相关。不同神经系统疾病状态下,NMDA受体的表达变化也不同[9]。以往对NMDA受体蛋白与神经系统疾病关系的研究多集中在脑和脊髓等中枢神经系统,而本文取材L4~6脊神经节,脊神经内含假单极神经元,为疼痛感觉传入神经的第一级神经元[10],本实验结果也显示,经坐骨神经部分结扎过的大鼠术侧的背根神经节L4~6NMDAR1的平均光密度值升高,表达增强,提示NMDAR1的上调可能是神经病理性疼痛发生发展的一种重要参与途径,结果同时显示经过17β-雌二醇干预后,雌二醇组大鼠术侧的背根神经节L4-6NMDAR1的平均光密度值升高更明显,表达量与CCI组差异显著,这与行为学结果相一致,提示雌激素参与并增加了大鼠神经病理性疼痛的敏感性。
本研究结果也显示雌激素大鼠背根神经节神经原上NMDAR1受体1显著增加,大鼠疼痛超敏,其原因可能是雌激素受体和NMDA受体在背根神经节神经原上都有分布,位置重叠,在背根神经节上共表达,雌激素对NMDA受体产生了有直接作用,通过上调NMDA受体的表达增加功能和通道开放来增强背根神经节伤害性刺激的传递。大量的实验证据表明,人和动物对病理性神经痛均存在性别差异,对雌激素与NMDA受体关系的研究,也主要针对可调节脑内几个区域和脊髓神经元的NMDA受体活性[11]。表明雌激素通过调节谷氨酸受体的表达或翻译后修饰[12],改变脑内谷氨酸受体传递[13],雌激素增加了NMDA受体介导的下丘脑神经元兴奋,本研究通过Western blot及免疫组织化学法检测神经损伤后脊髓背根神经节上NMDAR受体亚基表达情况,得出了一致的结果,而运用NMDAR特异性拮抗剂AP-5可以使NMDA受体表达水平下降[14],从而使大鼠的疼痛阈值显著提高[15],由此可见,NMDA受体的NMDA1调节亚基在神经病理性疼痛发生发展过程中起着重要作用。
综上,本研究认为雌激素在慢性神经病理性疼痛状况下,可以提高机体对机械刺激和热刺激的敏感性,其机制可能是增加了NMDAR1的表达,对防治病理性神经痛提供了新的思路。
[1]AFFAITATI G,CECCARELLI I,FIORENZANI P,et al.Sex differences in the analgesic effects of ICI 182 780 and Flutamide on ureteral calculosis in rats[J].Horm Behav,2011,59(1):9-13.
[2]LIU T,JIANG C Y,FUJITA T,et al.Enhancement by interleukin-1β of AMPA and NMDA receptor-mediated currents in adult rat spinal superficial dorsal horn neurons[J].Mol Pain,2013,9(1):16.
[3]CHARLET A,LASBENNES F,DARBON P,et al.Fast non-genomic effects of progesterone-derived neurosteroids on nociceptive thresholds and pain symptoms[J].Pain,2008,139(3):603-609.
[4]BI R,FOY M R,THOMPSON R F,et al.Effects of estrogen,age,and calpain on MAP kinase and NMDA receptors in female rat brain[J].Neurobiol Aging,2003,24(7):977-983.
[5]WANG F.Modeled behavioral evaluation of the neuropathic pain with social defect in rats:a preliminary methodology evaluation.[J].2014,20(20):164-169.
[6]TATARD-LEITMAN V M,JUTZELER C R,SUH J,et al.Pyramidal cell selective ablation of N-methyl-D-aspartate receptor 1 causes increase in cellular and network excitability[J].Biol Psychiatry,2015,77(6):556-568.
[7]CLIFFORD J L,MARES A,HANSEN J,et al.Preemptive perineural bupivacaine attenuates the maintenance of mechanical and cold allodynia in a rat spinal nerve ligation model[J].BMC Anesthesiol,2015,15(1):135.
[8]AMANDUSSON A,BLOMQVIST A.Estrogen receptor-alpha expression in nociceptive-responsive neurons in the medullary dorsal Horn of the female rat[J].Eur J Pain,2010,14(3):245-248.
[9]BURSZTAJN S,RUTKOWSKI M D,DELEO J A.The role of the N-methyl-D-aspartate receptor NR1 subunit in peripheral nerve injury-induced mechanical allodynia,glial activation and chemokine expression in the mouse[J].Neuroscience,2004,125(1):269-275.
[10]WANG L Q,LIU S Z,WEN X,et al.Ketamine-mediated afferent-specific presynaptic transmission blocks in low-threshold and sex-specific subpopulation of myelinated Ah-type baroreceptor neurons of rats[J].Oncotarget,2015,6(42):44108-44122.
[11]TANAKA M,SOKABE M.Bidirectional modulatory effect of 17β-estradiol on NMDA receptors via ERα and ERβ in the dentate gyrus of juvenile male rats[J].Neuropharmacology,2013,75:262-273.
[12]FRICK K M,ZHAO Z,FAN L.The epigenetics of estrogen[J].Epigenetics,2011,6(6):675-680.
[13]RYAN J,ARTERO S,CARRIRE I,et al.Brain volumes in late life:gender,hormone treatment,and estrogen receptor variants[J].Neurobiol Aging,2014,35(3):645.
[14]GANDHI R,RYALS J M,WRIGHT D E.Neurotrophin-3 reverses chronic mechanical hyperalgesia induced by intramuscular acid injection[J].J Neurosci,2004,24(42):9405-9413.
[15]KHODOROVA A,NICOL G D,STRICHARTZ G.The p75NTR signaling cascade mediates mechanical hyperalgesia induced by nerve growth factor injected into the rat hind paw[J].Neuroscience,2013,254(7):312-323.
