磁共振扩散张量成像在大鼠C6脑胶质瘤分级中的应用研究*
2018-03-30李香营蒋锡丽陈建强战跃福唐少虎韩向君
李香营,蒋锡丽,杨 光,陈建强,战跃福,唐少虎,韩向君
(中南大学湘雅医学院附属海口医院/海口市人民医院放射科,海口 570208)
胶质瘤是中枢神经系统最常见的原发性恶性肿瘤[1],术前准确评估胶质瘤的恶性程度对预测肿瘤生物学行为,制定手术方案至关重要。磁共振扩散张量成像(diffusion tensor imaging,DTI)作为一种新的成像方法,可以反映组织微观结构变化,广泛用于胶质瘤诊断、鉴别诊断、分级及手术方案的制订[2-3]。本研究旨在探讨临床3.0T DTI在Wistar大鼠C6脑胶质瘤分级中的应用价值。
1 材料与方法
1.1材料 C6胶质瘤细胞株购于中国科学院上海生命科学研究院细胞所,复苏后培养于10%胎牛血清、1%青链霉素混合液的RPMI-1640培养基中,传代接种。采用随机数字表将67只体质量215~330 g健康雌性Wistar大鼠分成实验组57只,对照组10只。注射浓度大于1×106/10 μL,注射点位于bregma点前1 mm,矢状缝右旁开3 mm处,注射方式采用硬脑膜下进6 mm,退1 mm,微量注射器注射速度为10 μL/min,整个过程缓慢进行,接种后大鼠先单笼喂养,记录苏醒时间、饮水进食及精神状态等。对照组为假手术组,注射相同剂量不含C6胶质细胞的全培养基。
1.2方法
1.2.1DTI扫描及图像处理 DTI扫描采用美国GE公司3.0T医用扫描机,配备大鼠专用线圈,通道数目为8,所有成活大鼠分别在接种后第1~2周(22只)和3~4周(35只)行常规MRI及DTI检查,增强方式采用尾静脉注射钆喷替酸葡甲胺(Gd-DTPA,Mmagnevist,Schering,德国)2.5~3 mL/kg,增强序列为常规轴位T1WI和T1-3D-IR-FSPGR序列。 T2WI序列参数为TR 3 000 ms,TE 120 ms,层间距 0 mm,层厚 3 mm,矩阵 192×192。DTI采用自旋回波的回波平面成像(SE-EPI),15个非共线梯度方向,梯度扩散因子(b)值为0、800 s/mm2,TR 2 500 ms,TE 88.7 ms。
DTI原始数据均由GE公司ADW4.4后处理工作站的Function Tool软件进行,首先消除图像噪声,经工作站自动计算产生部分各向异性分数(FA)图,并进行图像配准,获得瘤体感兴趣区(ROI)的FA 值。ROI选择避开出血、坏死、脑沟裂池等影响测量结果的区域[4],以降低测量误差。图像分析由两名高级职称神经影像专家共同完成,在两人达成共识的情况下确定瘤体及对侧镜像脑组织区各多个等大(2 mm2,9Pix)ROI,得到相应部位的FA值。
1.2.2HE染色和免疫组织化学检查 所有接受DTI扫描的大鼠,1%戊巴比妥钠(40 mg/kg)麻醉后经心脏灌注4%多聚甲醛固定全脑24~48 h切片,取瘤体最大层面做连续冠状切片进行HE染色,光镜下观察接种肿瘤的分化程度,根据世界卫生组织(WHO)2002年中枢神级系统肿瘤的分类分级标准
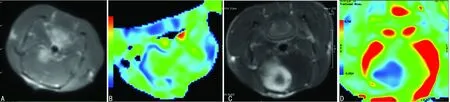
A、B:T1增强及FA伪彩图显示右侧大鼠大脑半球低级别C6胶质瘤。C、D:T1增强及FA伪彩图显示右侧大鼠大脑半球高级别C6胶质瘤,瘤体内出现坏死
图1不同级别C6脑胶质瘤T1增强和FA图
确定胶质瘤分级,低级别胶质瘤为WHO Ⅰ~Ⅱ级,高级别胶质瘤为WHOⅢ~Ⅳ级。另取切片3张行GFAP免疫组织化学检查,方法按试剂盒说明书完成。
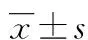
2 结 果
2.1MRI检查结果 实验组57只大鼠均成功完成MRI扫描,低级别胶质瘤体积相对较小,信号均匀,增强后多呈轻度均匀强化。高级别胶质瘤肿瘤体积多较大,信号不均匀,增强后多以明显不均匀强化或环状强化为主。DTI显示瘤体高级别胶质瘤瘤体FA值为(0.167±0.035),低级别胶质瘤瘤体FA值为(0.147±0.015),差异有统计学意义(t=2.34,P<0.05),见图1。10只对照组大鼠MRI扫描检查未见异常信号。
2.2病理结果 本组研究57只荷瘤大鼠中,低级别胶质瘤(WHO Ⅰ~Ⅱ级)18只,高级别胶质瘤(WHO Ⅲ~Ⅳ级)39只,其中1~2周时,肿瘤级别Ⅰ~Ⅱ级18例,Ⅲ~Ⅳ级4例,接种3~4周,肿瘤级别Ⅲ级14例,Ⅳ级21例。HE染色显示瘤体肿瘤细胞排列密集,以高级别更加明显,伴有不同程度出血和坏死,细胞核异形性明显。对照组大鼠均未见肿瘤生长。
3 讨 论
胶质瘤是脑内最常见的恶性肿瘤,占原发性脑肿瘤的80%[3],术前准确评估胶质瘤的恶性程度对预测肿瘤生物学行为,制定手术方案及预测转归、评估预后至关重要[2,5]。由于肿瘤存在不同程度的异质性,根据活检或手术切除标本的组织学特点进行分级存在一定缺陷[6]。DTI作为一种新的功能成像方法,可以反映水分子的弥散特点,评估组织微观结构变化,广泛用于胶质瘤诊断、鉴别诊断、分级及手术方案的制订[1,7]。大鼠C6脑胶质瘤接近于人脑胶质瘤的生物学特性,并且实验结果具备良好的可重复性,为此本研究通过建立鼠脑胶质瘤模型,旨在探讨临床3.0T DTI在Wistar大鼠C6脑胶质瘤分级中的应用价值。
本组实验结果显示C6细胞在接种1~2周时,肿瘤级别Ⅰ~Ⅱ级18例,Ⅲ~Ⅳ级4例,接种3~4周,肿瘤级别Ⅲ级14例,Ⅳ级21例,这与已有研究结果相似[8-9],也进一步证实了鼠脑胶质瘤的病理级别与C6细胞接种后处死的时间窗有关[10]。不过李明等[11]通过将C6细胞接种到SD大鼠,并在不同时间点扫描处死大鼠后发现肿瘤的病理级别在Ⅱ~Ⅲ级,推测可能与植入的细胞种类、动物个体间差异及接种后处理时间等因素有关。
本研究通过建立不同时间段大鼠C6脑胶质瘤模型后高级别胶质瘤瘤体FA值高于低级别胶质瘤,差异有统计学意义(P<0.05),这与国内外多项研究结果相似[12-13]。不过FA值在胶质瘤分级中的作用研究结果也存在一定争议,EL-SEROUGY等[3]在一项35例胶质瘤患者的DTI研究中发现瘤体MD值联合瘤周组织FA值对鉴别高级别胶质瘤和低级别胶质瘤有一定帮助,而瘤体FA值在胶质瘤分级中作用有限。这可能有两方面原因:(1)FA值受多种因素影响,比如肿瘤细胞密度、细胞外闻隙、白质纤维髓鞘完整性等;(2)目前研究多针对DTI在胶质瘤患者分级中的应用,因不同患者存在异质性,缺乏实验的可重复性,研究结果存在争议。不过,本组研究采用接近人脑胶质瘤的大鼠胶质瘤模型,实验结果具备良好的可重复性,降低了个体异质性造成的实验偏倚。
综上所述,通过建立C6大鼠脑胶质瘤模型发现,DTI参数FA值可以为术前胶质瘤分级提供准确可靠、无创的影像学信息。不过本研究也存在一些缺陷,首先本研究样本量较少,无法确定胶质瘤分级的具体阈值,这也是以后研究的方向。另外临床3.0T磁共振空间分辨力不足,不能满足大鼠白质纤维示踪,之后本课题组将进行更高场强MRI鼠脑胶质瘤分级研究。
[1]MOHAMMADZADEH A,MOHAMMADZADEH V,KOORAKI S,et al.Pretreatment evaluation of gioma[J].Neuroimaging Clin N Am,2016,26(4):567-580.
[2]PAPAGEORGIOU T S,CHOURMOUZI D,DREVELENGAS A,et al.Diffusion tensor imaging in brain tumors:A study on gliomas and metastases[J].Phys Med,2015,31(7):767-773.
[3]EL-SEROUGY L,ABDEL R A A,EZZAT A,et al.Assessment of diffusion tensor imaging metrics in differentiating low-grade from high-grade gliomas[J].Neuroradiol J,2016,29(5):400-407.
[4]WANG W,STEWARD C E,DESMOND P M.Diffusion tensor imaging in glioblastoma multiforme and brain metastases:the role of p,q,L,and fractional anisotropy[J].AJNR Am J Neuroradiol,2009,30(1):203-208.
[5]CHOI Y S,AHN S S,LEE S K,et al.Amide proton transfer imaging to discriminate between low- and high-grade gliomas:added value to apparent diffusion coefficient and relative cerebral blood volume[J].Eur Radiol,2017,27(8):3181-3189.
[6]CHAWALPARIT O,SANGRUCHI T,WITTHIWEJ T,et al.Diagnostic performance of advanced MRI in differentiating high-grade from low-grade gliomas in a setting of routine service[J].J Med Assoc Thai,2013,96(10):1365-1373.
[7]LIANG R,WANG X,LI M,et al.Potential role of fractional anisotropy derived from diffusion tensor imaging in differentiating high-grade gliomas from low-grade gliomas:a meta-analysis[J].Int J Clin Exp Med,2014,7(10):3647-3653.
[8]陈淑玲,郭子义,钟小航.晚期鼠脑胶质瘤模型的建立与磁共振灌注成像研究[J].重庆医学,2014,43(25):3317-3318,3321.
[9]李香营,魏晓,刘辉,等.Wistar大鼠C6脑胶质瘤晚期阶段模型的建立及MR成像[J].实用放射学杂志,2012,28(3):461-464.
[10]魏晓,李香营,袁园,等.适于脑胶质瘤浸润MRI研究的动物模型构建[J].中国医学计算机成像杂志,2013,19(4):390-392.
[11]李明,冯华,李飞,等.大鼠C6脑胶质瘤模型的病理特征与MRI的观察[J].中华神经外科杂志,2005,21(5):279-282.
[12]蒋玲,姚振威,冯晓源,等.DTI定量参数对胶质瘤分级与肿瘤增殖活性的评价[J].中国医学计算机成像杂志,2013,19(2):106-110.
[13]SERVER A,GRAFF B A,JOSEFSEN R,et al.Analysis of diffusion tensor imaging metrics for gliomas grading at 3 T[J].Eur J Radiol,2014,83(3):156-165.
