重症患者念珠菌菌种分布及卡泊芬净敏感性分析
2018-03-30李方义张静邹子俊易修文李伟超周林郑煜凯何志捷
李方义 张静 邹子俊 易修文 李伟超 周林 郑煜凯 何志捷
(1.中山大学孙逸仙纪念医院重症医学科,广州 510120;2.中山大学孙逸仙纪念医院皮肤科,广州 510120)
侵袭性念珠菌病是重症患者最常见的深部真菌病,其发病率约为2.6‰~16.5‰,且呈现逐渐上升趋势,死亡率高达40%~60%[1-2]。早期正确选择抗真菌药物治疗是提高侵袭性念珠菌病治疗成功率、降低患者死亡率的最重要手段[3]。因此,了解念珠菌对棘白菌素类药物的敏感性,对指导临床合理用药有重要意义。本研究采用CLSI M27-A3微量液基稀释法对中山大学孙逸仙纪念医院重症医学科重症患者分离到的念珠菌进行卡泊芬净药敏检测,为本院重症医学科抗真菌药物的选择提供依据。
1 菌株来源和方法
1.1 菌株来源
中山大学孙逸仙纪念医院2015年2月1日~2016年2月1日入住重症医学科,满足以下入选标准患者进行前瞻性研究,入选标准:①年龄≥18岁;②重症医学科住院时间>3 d;③转入重症医学科24 h APACHE II评分>15分。收集入选的患者分离到的念珠菌菌株。同一患者重复分离到同一种属且耐药性一致的念珠菌认为是同一菌株,否则认为是不同菌株。
1.2 方法
菌种鉴定 将标本接种至科玛嘉念珠菌显色培养基,37℃培养,观察24~72 h。根据菌落形态特点、镜下特点或小培养特点、生理及生化试验等方法来鉴定。部分非白念珠菌结合API20鉴定到种。试剂盒API20购自生物梅里埃公司。
卡泊芬净敏感性检测 参照临床和实验室标准化委员会 (Clinical and Laboratory Standards Institute, CLSI)2008年发布的酵母菌液基稀释法抗真菌药物敏感参考方法第3版 (M27- A3)进行念珠菌卡泊芬净药物敏感实验。质控菌株为近平滑念珠菌ATCC22019和克柔念珠菌ATCC6258。各菌种敏感性临床折点见表1。
表1念珠菌卡泊芬净药物敏感实验临床折点
Tab.1Susceptible/SDD/resistant is defined ofCandidaspp to caspofugin
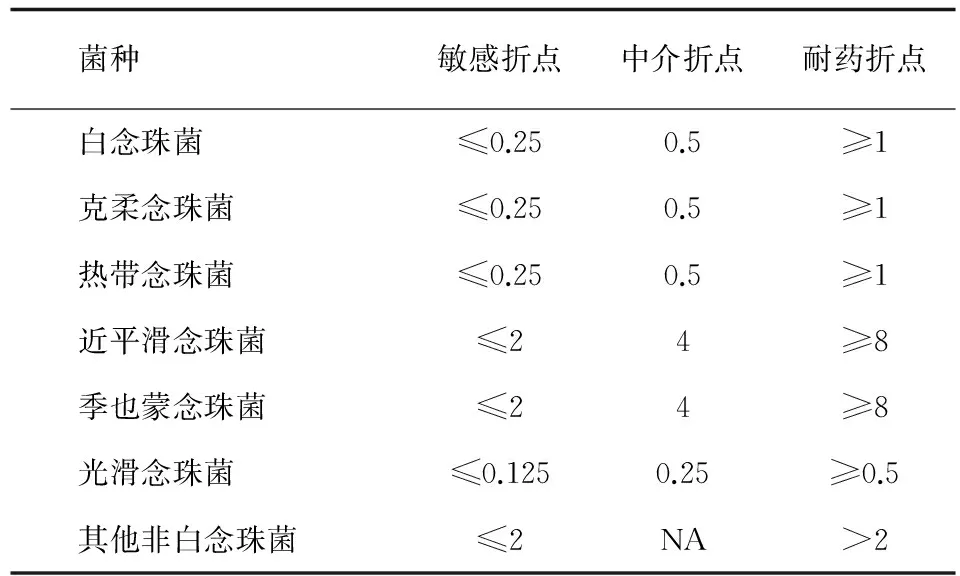
菌种敏感折点中介折点耐药折点白念珠菌≤0.250.5≥1克柔念珠菌≤0.250.5≥1热带念珠菌≤0.250.5≥1近平滑念珠菌≤24≥8季也蒙念珠菌≤24≥8光滑念珠菌≤0.1250.25≥0.5其他非白念珠菌≤2NA>2
注:NA.无或不适用
1.3 统计学方法
采用SPSS 20.0进行统计分析,对定性变量采用频率或频率分布进行统计描述。
2 结 果
2.1 菌种分布
本研究共收集念珠菌菌株76株,白念珠菌占37株,占48.7%。其次为热带念珠菌20株,占26.3%。近平滑念珠菌、光滑念珠菌各8株,各占10.5%;克柔念珠菌、季也蒙念珠菌、葡萄牙念珠菌1株。念珠菌菌种分布情况见表2。
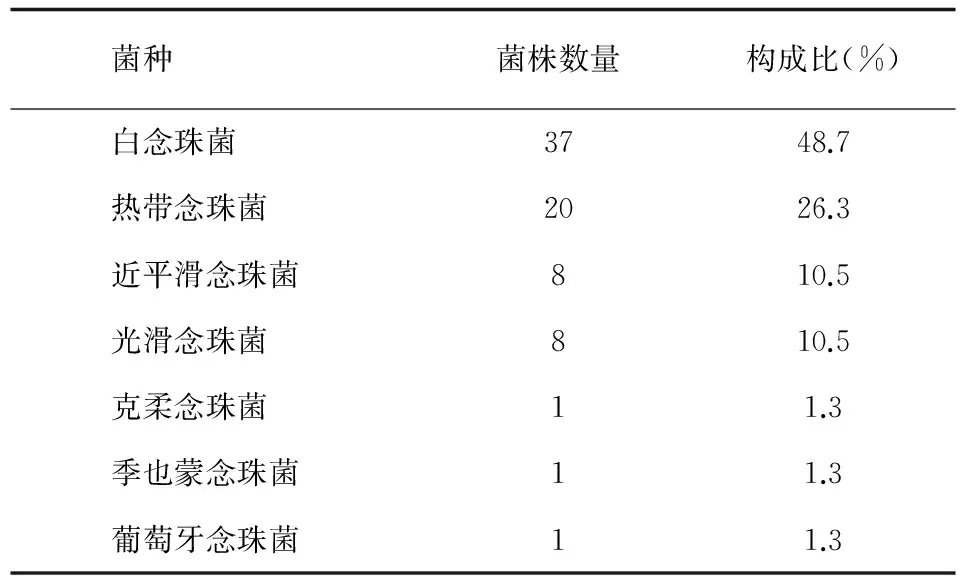
表2 念珠菌菌种分布情况
2.2 部位分布
79株真菌菌株大部分来自于呼吸道,占74.7% (n=59),泌尿道、血液、引流管、导管、分泌物,分别占12.7% (n=10)、5.1% (n=4)、3.8% (n=3)、2.5% (n=2)、1.3% (n=1)。
2.3 卡泊芬净药物敏感试验
根据CLSI M27-A3微量液基稀释法药物敏感实验,绝大部分念珠菌菌株对卡泊芬净敏感,敏感率为94.7%。其中,分离到卡泊芬净耐药的光滑念珠菌1株,占1/8。卡泊芬净中介的光滑念珠菌2株,白念珠菌1株,分别占2/8、1/37。各念珠菌菌种对卡泊芬净的敏感性见表3。
3 讨 论
棘白菌素类药物具有不良反应少、药物相互作用小、临床疗效好等优势,已被2016年美国感染病协会 (IDSA)等指南推荐用于侵袭性念珠菌病的一线治疗[4],其在重症医学科重症患者的应用也越来越广泛。然而近些年来,国内外各研究显示棘白菌素类药物耐药念珠菌菌株存在逐渐增多的趋势[5-6]。真菌致病菌耐药性是决定IFD抗真菌药物治疗是否有效的重要因素,因此抗真菌药物耐药性研究对正确选择抗真菌药物治疗具有重要临床指导意义。
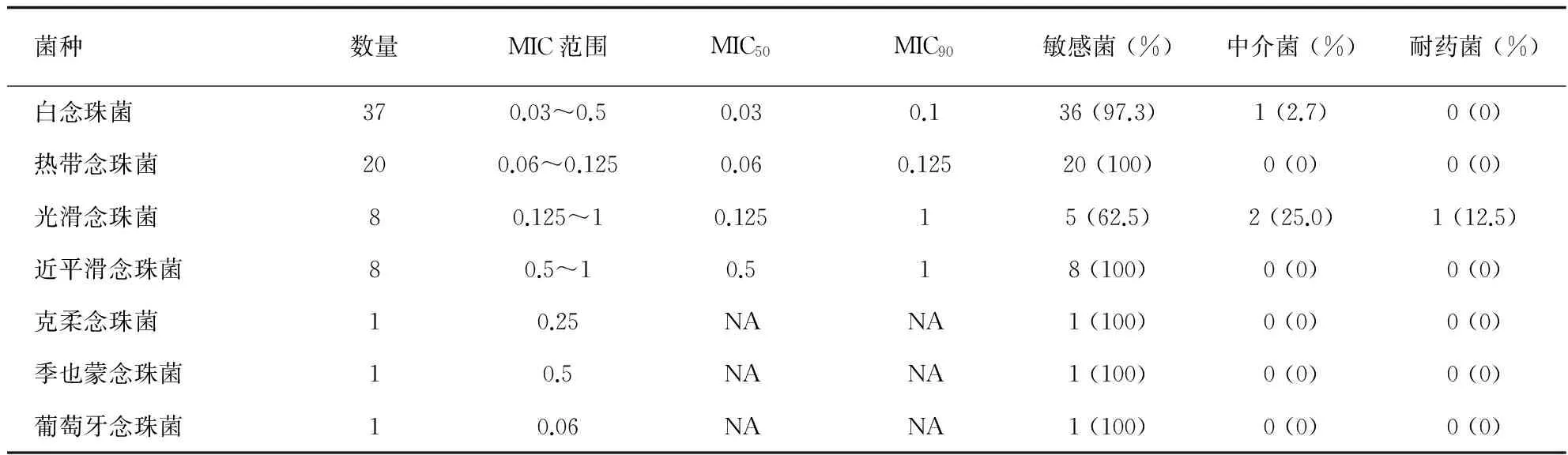
表3 念珠菌对卡泊芬净的敏感性
由于氟康唑的广泛使用,目前侵袭性念珠菌病致病菌白念珠菌的比例已下降至50%以下[7]。这一趋势在我国同样明显,多中心流行病学调查的结果显示白念珠菌的比例为38.2%~42.5%[6,8-9]。本研究中白念珠菌占到46.7%,与既往的研究类似。非白念珠菌的分布具有明显的地区特异性,例如北美地区最主要的非白念珠菌为光滑念珠菌,我国的多中心流行病学调查显示以近平滑念珠菌为主[8-9]。而在本研究中热带念珠菌是最常见的非白念珠菌,占25.3%。这一结论与来自于印度南部的研究结果类似[10],该研究认为重症医学科中分离到高比例热带念珠菌可能与使用广谱抗生素、TPN、化疗或慢性基础疾病如糖尿病、肿瘤等多种因素有关。Tan BH等以亚洲6个国家为多中心进行的念珠菌血症病原菌检测研究中也得到热带念珠菌是这些国家最常见的念珠菌血症致病菌,其认为造成这种现象的重要原因可能是热带地区国家的温暖气候更适合热带念珠菌生长[11]。我院所在的广州地区,与上述国家的气候类似,这可能是导致本研究中热带念珠菌比例较高的重要原因之一。
国外各项研究显示重症医学科重症患者中对棘白菌素类药物耐药的白念珠菌、克柔念珠菌和热带念珠菌均较少见,而对棘白菌素类药物耐药的光滑念珠菌却相对常见,并不断增多。Alexander等的研究显示2001年至2010年美国的光滑念珠菌对棘白菌素类药物的耐药率由4.9%上升至12.3%。欧洲的研究也报导可类似的趋势[12]。来自丹麦的一项研究也显示,2004~2013年间,光滑念珠菌的耐药率由0%上升至3.1%[13]。国内2009~2011年China-SCAN研究也显示分离到的卡泊芬净中介菌株均为光滑念珠菌。本研究中共收集的76株念珠菌,多数对卡泊芬净敏感,敏感率为94.7%。卡泊芬净不敏感念珠菌以光滑念珠菌为主,与既往研究一致。
其中,分离到的1株卡泊芬净耐药光滑念珠菌来自于1例仅有氟康唑暴露史而无棘白菌素类药物暴露史的患者,但该患者分离到的光滑念珠菌是氟康唑敏感菌株。该菌株耐药的产生可能机制是:氟康唑暴露时,真菌首先产生胁迫适应反应,再通过DNA修复不足或非整倍体形成途径,发生了FKS基因突变,最终导致了棘白菌素类药物耐药性的产生[14]。
另有2株卡泊芬净中介光滑念珠菌和1株卡泊芬净中介白念珠菌均来自于无氟康唑和棘白菌素类药物暴露史的患者。既往有研究发现无棘白菌素药物或三唑类药物暴露史的患者中也能分离到棘白菌素耐药菌株,结合某些医院能观察到耐药菌株集中出现的现象,提示可能棘白菌素类药物耐药菌株能在患者间相互传播[15]。本研究中这3例患者在转入我院重症医学科前,均在其他医院或病房有较长的住院时间,且分离到2株卡泊芬净中介光滑念珠菌的患者在重症医学科住院时间存在交叉,不排除卡泊芬净中介菌株来自于转入前病房患者间或重症医学科患者间相互传播的可能。另外,有学者对念珠菌血症肿瘤患者中无抗真菌药物暴露史但分离到抗真菌耐药菌株的患者进行影响因素分析,提示严重疾病状态本身就是真菌耐药性产生的独立风险因素[16]。本研究中这3例分离到卡泊芬净中介念珠菌的患者转入重症医学科时APACHE II评分均≥33分,SOFA评分均≥8分,病情严重,这也可能是这些患者分离到卡泊芬净中介菌株的原因之一。最后,值得注意的是光滑念珠菌卡泊芬净敏感性结果解释仍需要十分谨慎,因为可能存在实验室间差异,其具体机制尚不清楚,需要进一步探讨分析[17]。
综上所述,中山大学孙逸仙纪念医院重症医学科重症患者念珠菌仍以白念珠菌最常见。非白念珠菌中以热带念珠菌最常见。我院重症患者的念珠菌对卡泊芬净具有很高的敏感性。
[1] Yapar N. Epidemiology and risk factors for invasive candidiasis[J]. Ther Clin Risk Manag, 2014, 10(95): 105.
[2] Calandra T, Roberts JA, Antonelli M, et al. Diagnosis and management of invasive candidiasis in the ICU: an updated approach to an old enemy[J]. Crit Care, 2016, 20(1): 125.
[3] Morrell M, Fraser VJ, Kollef MH. Delaying the empiric treatment ofCandidabloodstream infection until positive blood culture results are obtained: a potential risk factor for hospital mortality[J]. Antimicrob Agents Chemother, 2005, 49(9): 3640-3645.
[4] Pappas PG, Kauffman CA, Andes DR, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2015, 62(4): e1-50.
[5] Pfaller M, Boyken L, Hollis R, et al.Invitrosusceptibility of invasive isolates ofCandidaspp. to anidulafungin, caspofungin, and micafungin: six years of global surveillance[J]. J Clin Microbiol, 2008, 46(1): 150-156.
[6] Pfaller MA, Castanheira M, Messer SA, et al.Invitroantifungal susceptibilities of isolates ofCandidaspp. andAspergillusspp. from China to nine systemically active antifungal agents: data from the SENTRY antifungal surveillance program, 2010 through 2012[J]. Mycoses, 2015, 58(4): 209-214.
[7] Kullberg BJ, Arendrup MC. Invasive candidiasis[J]. N Engl J Med, 2015, 373(15): 1445-1456.
[8] Guo F, Yang Y, Kang Y, et al. Invasive candidiasis in intensive care units in China: a multicentre prospective observational study[J]. J Antimicrob Chemother, 2013, 68(7): 1660-1668.
[9] Wang H, Xiao M, Chen SC, et al.Invitrosusceptibilities of yeast species to fluconazole and voriconazole as determined by the 2010 National China Hospital Invasive Fungal Surveillance Net (CHIF-NET) study[J]. J Clin Microbiol, 2012, 50(12): 3952-3959.
[10] Yesudhason BL, Mohanram K.Candidatropicalisas a predominant isolate from clinical specimens and its antifungal susceptibility pattern in a tertiary care hospital in Southern India[J]. J Clin Diagn Res, 2015, 9(7): DC14-16.
[11] Tan BH, Chakrabarti A, Li RY, et al. Incidence and species distribution of candidaemia in Asia: a laboratory-based surveillance study[J]. Clin Microbiol Infect, 2015, 21(10): 946-953.
[12] Alexander BD, Johnson MD, Pfeiffer CD, et al. Increasing echinocandin resistance inCandidaglabrata: clinical failure correlates with presence ofFKSmutations and elevated minimum inhibitory concentrations[J]. Clin Infect Dis, 2013, 56(12): 1724-1732.
[13] Arendrup MC, Perlin DS. Echinocandin resistance: an emerging clinical problem[J]. Curr Opin Infect Dis, 2014, 27(6): 484-492.
[14] Perlin DS. Echinocandin resistance inCandida[J]. Clin Infect Dis, 2015, 61(suppl 6): S612-S617.
[15] Vallabhaneni S, Cleveland AA, Farley MM, et al. Epidemiology and risk factors for echinocandin nonsusceptibleCandidaglabratabloodstream infections: data from a large multisite population-based candidemia surveillance program, 2008-2014[C]. Open Forum Infect Dis, 2015, 2[4]: ofv163.
[16] Farmakiotis D, Tarrand JJ, Kontoyiannis DP. Drug-resistantCandidaglabratainfection in cancer patients[J]. Emerg Infect Dis, 2014, 20(11): 1833-1840.
[17] Fothergill AW, Mccarthy DI, Albataineh MT, et al. Effects of treated versus untreated polystyrene on caspofungininvitroactivity againstCandidaspecies[J]. J Clin Microbiol, 2016, 54(3): 734-738.
