KiSS1蛋白和MMP-2在宫颈癌组织中的表达及诊断价值
2018-03-26李颖,王瑚
李 颖,王 瑚
(锦州市中心医院 妇产科,辽宁 锦州121000)
宫颈癌(ICC)是女性常见的生殖道恶性肿瘤,随着人们生活方式的改变及人口的高龄化,发病率明显上升,且日趋年轻化。早期ICC无明显症状,术后易复发和转移,早期诊断能够明显提高治愈率[1],降低死亡率。临床亟待寻找敏感性高、特异性强的检测方法,以早期诊断,提高治愈率,提高患者的生活质量。本文检测宫颈组织(NCE)、宫颈上皮内瘤变(CIN)及ICC组织中的KiSS1和MMP-2的表达,以便指导临床诊疗。
1 材料与方法
1.1标本选取2016年3月-6月我院治疗存档的宫颈组织蜡块78例,宫颈癌38例,平均年龄(45.61±4.27)岁,根据2003年FIGO标准,Ia期14例,Ib期12例,Ⅱ期12例;22例深层浸润,16例浅层浸润;淋巴转移8例,无淋巴转移30例;29例分化为中、低级,9例分化为高级。同期22例行切除术CIN患者,平均年龄(44.73±4.55)岁。同期行子宫肌瘤切除术的NCE患者18例,平均年龄(45.39±4.53)岁。
1.2免疫组化试剂[2]南京德泰生物科技公司生产的MMP-2多克隆抗体、KiSS1蛋白兔抗人单克隆抗体,武汉默沙克生物科技有限公司生产的SP试剂盒。
1.3方法采用免疫组化SP法,宫颈组织的存档蜡块78例,38例ICC、22例CIN,18例NCE。石蜡包埋,每隔100 μm切取4 μm切片2张,分别用抗KiSS1蛋白抗体及抗MMP-2抗体染色,一抗阴性对照为PBS液。
1.4结果判定[3]由两名病理科医师采用盲法观察。(A)染色强度评分:强染色为3分,中等染色为2分,无色为0分,弱染色为1分;(B)染色阳性细胞比例评分:<5%为0分,5%-25%为1分,26%-50%为2分,>50%为3分;阳性表达为总分(A+B)≥3分,阴性表达<3分。
1.5统计学分析应用SPSS11.0软件分析,分析KiSS1蛋白和MMP-2在宫颈癌组织中的诊断价值,均数比较采用t检验,采用Fisher精确检验,统计阳性率,差异有统计学意义时P<0.05。
2 结果
2.1KiSS1、MMP-2表达KiSS1在NCE、CIN、ICC的阳性表达率依次降低(86.36%vs77.78%vs44.74%),差异具有统计学意义(P<0.05)。MMP-2在NCE、CIN、ICC的阳性表达率依次升高(16.67%vs31.82%vs63.16%),差异具有统计学意义(P<0.05)。见表1。
2.2KiSS1、MMP-2与ICC病理相关性KiSS1蛋白与MMP-2的阳性表达率与ICC浸润深度、组织学分级、临床分期密切相关(P<0.05)。见表2。
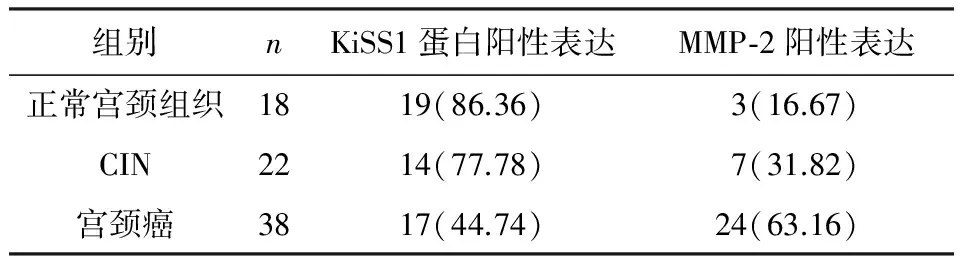
表1 KiSS1蛋白和MMP-2在NCE、CIN及ICC中的表达
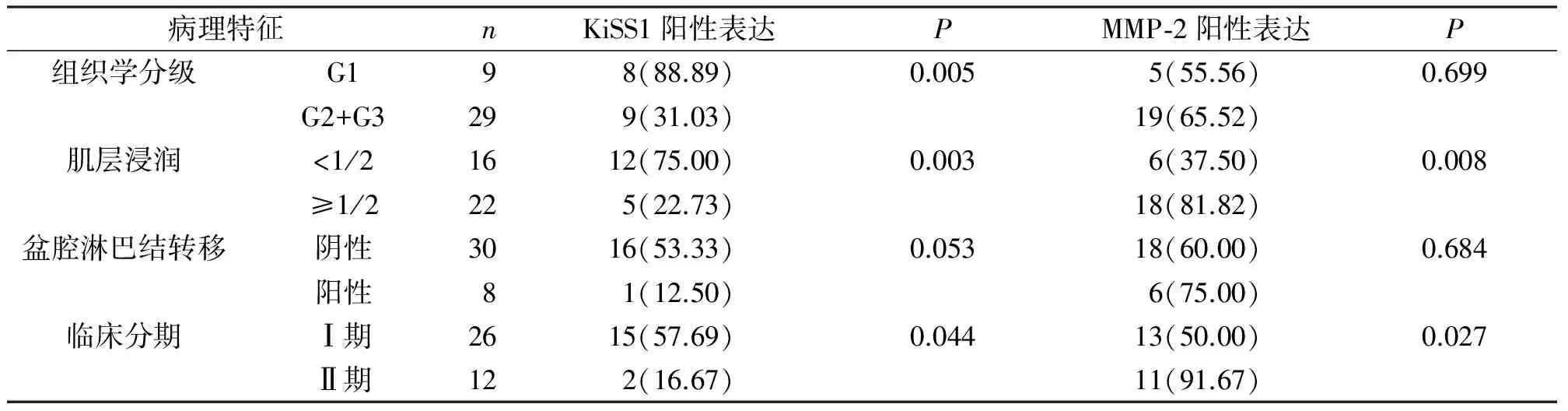
表2 ICC中二者的表达与病理相关性
3 讨论
KiSS1属于单纤丝蛋白,与GPR54受体结合后降低基质金属蛋白酶活性,上调钙离子水平,抑制肿瘤细胞的趋化、增殖、转移[4]。KiSS1在正常组织中高表达,在癌细胞中往往表达过低或缺失,临床较常用的检测微转移非侵入性的标记物,对于早期诊断ICC具有重要临床价值。本研究中KiSS1蛋白在ICC组织中的阳性率44.74%,明显低于其余二种组织的阳性表达,提示可能是ICC发生初期,随着疾病的恶化程度加大下降更加明显。ICC进展中的浸润深度、组织学分级及临床分期与其表达水平具有相关性,随着病情程度加深表达下降[5]。表明KiSS1蛋白的低表达发生在癌变早期阶段,其低水平表达促进了ICC的发生、发展、转移,发挥类似癌基因样作用,提示可将KiSS1蛋白的表达情况作为ICC的临床分期指标,并用于判断预后[6]。
MMP-2是一种非糖化的明胶酶,癌细胞要穿越基底膜侵入周围组织,MMP-2在机体内降解细胞外基质(ECM)中Ⅳ型胶原,在肿瘤的侵润、转移中作用重大[7]。在ICC的发生发展过程中,促进癌细胞大量增殖,导致肿瘤发生,最终患者死亡,MMP-2高表达能够促进肿瘤形成新生血管,降解ECM速度加快,癌细胞顺利穿越基底膜向远处侵袭、转移[8]。MMP-2在各种肿瘤中的异常表达及其分子机制逐渐被阐释,肿瘤的侵袭和转移需要蛋白酶类降解ECM,破坏基底膜的完整性,提供侵袭“通道”[9]。MMP-2表达率可以区分正常细胞和肿瘤细胞,评估癌细胞增殖、侵袭程度,已作为一种特异的肿瘤标志物应用于临床,可以作为判定癌浸润及转移的重要指标。临床治疗采取对MMP-2的降解功能进行阻断,使其减少对ECM的降解,抑制肿瘤穿越基底膜进行转移[10]。
本研究中发现ICC组织中MMP-2的阳性率明显高其它组织,随着临床分期、肿瘤分级、浸润深度的加深而增加,这表明MMP-2参与了恶性肿瘤的生长和转移[11],MMP-2的高表达促进了恶性肿瘤的发生进展,其还预示着患者预后不良[12],检测MMP-2的表达水平可做为高风险肿瘤的标志物,有效评估患者的预后[13]。
[1]吉 宏,李莲英,郭 强,等.MMP-2及CK19在早期宫颈癌淋巴结微转移中的表达及其意义[J].中国肿瘤临床,2011,38(14):843.
[2]张小平,李明玉.KiSS1蛋白和MMP2在宫颈癌中的表达及临床意义[J].中国实验诊断学,2013,17(3):507.
[3]傅 瑶,梁冠盈,迟秋君,等.HPV感染及MMP-2、MMP-7、MMP-9的表达与子宫颈癌相关性分析[J].哈尔滨医科大学学报,2014,48(6):444.
[4]周亭芳,李高峰,李 朵,等.白杨素增强辐射诱导宫颈癌HeLa细胞系球形成细胞凋亡[J].湖南师范大学学报,2015,12(3):1.
[5]赵玉婵,李 莲,张连梅,等.NF-κB、MMP-9在宫颈癌组织中的表达及意义[J].河北医药,2013,35(20):3050.
[6]宋广叶,宋志宇,邵淑丽,等.基质金属蛋白酶-7基因表达在子宫颈鳞状细胞癌发生发展中的意义[J].肿瘤研究与临床2010,11(22):778.
[7]汤 轶,孙晓红.二甲双胍对宫颈癌Hela细胞Twist及E-cadherin表达的影响及机制[J].山东医药,2016,56(9):31.
[8]朱 伟,黎桂仙,韩 坤,等.顺铂处理联合STAT3 RNA干扰对宫颈癌细胞增殖的影响[J].包头医学院学报,2015,31(6):1.
[9]滕燕伊,刘晓云,郑 洪,等.重Ki-67、MMP-7、MMp-2 在宫颈CIN和宫颈癌中的表达及意义[J].庆医科大学学报,2010,3(7):989.
[10]刘田雨,姚书忠.宫颈癌肿瘤微环境研究进展[J].国际妇产科学杂志,2015,42(2):149.
[11]方禛浩,谌 錾,李妍静,等.NF-κB和STAT3对宫颈癌作用的研究进展[J].中国妇产科临床杂志,2013,14(1):81.
[12]齐玉明,王春丽,冯社军.毛萼乙素通过调节STAT3抑制宫颈癌C-33A细胞survivin的表达[J].西部医学2016,28(5):625-627,631.
[13]朱 伟,黎桂仙,韩 坤,等.顺铂处理联合STAT3 RNA干扰对宫颈癌细胞增殖的影响[J].包头医学院学报,2015,31(6):1.
