不同方法制备的AlOOH对分层复合催化剂CO加氢反应性能的影响
2018-03-23韩燕梅郝树宏高志华
韩燕梅,郝树宏,高志华,黄 伟
(1.太原理工大学 煤科学与技术教育部和山西省重点实验室,太原 030024;2.国网山西电力科学研究院,太原 030001)
近年来,能源开发与环境保护已成为关乎人类社会能否可持续发展的两大课题。化石能源特别是煤的清洁利用和可再生清洁能源的开发受到广泛的关注,而CO催化加氢合成低碳醇是煤炭资源洁净利用的重要途径之一[1-2]。目前,CO加氢合成低碳醇的催化剂体系总体上可归为改性甲醇合成催化剂体系、改性F-T合成催化剂体系、钼基催化剂体系和贵金属催化剂体系等四大类[3-6]。然而,这些催化剂体系存在很多不足,如改性甲醇合成催化剂体系生成的产物仍主要是甲醇;改性F-T合成催化剂仍存在醇类选择性低、烃选择性高和产物含水量大等问题;改性的钼基催化剂存在合成反应条件苛刻的劣势;贵金属高昂的价格和容易毒化失活限制了其工业化的应用等。因此,如何进一步开发合成气制备低碳醇的新催化剂,使其具有高的醇选择性、稳定性,温和的反应条件是目前低碳醇合成的研究重点。
本课题组前期自主创新提出的完全液相法研究发现,CuZnAl催化剂中Al组分并不是以通常的γ-Al2O3存在,而是以一种介稳相AlOOH的形式存在[7]。目前,AlOOH主要用于γ-Al2O3前驱体的制备[8-9],作为吸附剂[10]和负载型催化剂载体[11-12],以其作为催化剂鲜有报道。前期课题组单独制备了AlOOH,将其与工业甲醇合成催化剂C302机械混合后用于CO加氢反应,产物中出现选择性较高的C2+OH[13],但其作用机理尚不明确。
为了进一步研究AlOOH在合成C2+OH中的作用,本研究利用沉淀法、溶胶凝胶水热法及一步水热法分别制备了3种AlOOH样品,并采用C302与AlOOH分层装填的方式代替前期两者机械混合的复合方式用于CO加氢反应,目的是试图将C302催化剂合成的甲醇在AlOOH催化剂上进一步反应,结合表征来考察不同制备方法对催化剂结构和性能的影响。
1 实验部分
1.1 AlOOH样品的制备
1.1.1 沉淀法
将56.27 gAl(NO3)3·9H2O和40.54 g尿素(按Al3+浓度为0.3 mol/L,硝酸铝和尿素物质的量的比为1∶4.5)加入盛有500 mL蒸馏水的三口烧瓶中,在95 ℃加热条件下回流搅拌72 h,经离心、洗涤后在60 ℃下干燥制得白色样品,命名为C.
1.1.2 溶胶凝胶水热法
将10.21 g异丙醇铝在80 ℃、快速搅拌下缓慢加入到90 mL去离子水中进行水解,在回流条件下充分搅拌1 h,使异丙醇铝完全水解,形成乳白色沉淀;然后加5 mL浓度为1 mol/L HNO3进行胶溶,继续搅拌10 h后形成透明溶胶;最后倒入100 mL聚四氟乙烯内衬水热反应釜中,在200 ℃恒温24 h.待自然冷却至室温后倒出产物并离心、洗涤,然后在100 ℃烘干制得白色样品,命名为RS.
1.1.3 一步水热法
取3 mmol Al(NO3)3·9H2O溶解于60 mL的蒸馏水中,搅拌30 min,将溶液倒入100 mL聚四氟乙烯内衬水热反应釜中,200 ℃恒温24 h.反应结束后冷却至室温,将得到的产物离心、洗涤,在60 ℃下干燥,所得白色样品命名为ST.
1.2 分层复合催化剂的装填
首先将上述方法制备的AlOOH与工业甲醇合成催化剂C302分别压片造粒(40~60目),然后将两者分层装填于固定床反应管内,C302在上层,AlOOH在下层,上、下层催化剂质量比为2∶1,催化剂的总用量为3 g,复合催化剂分别命名为C302-C,C302-RS,C302-ST.
1.3 复合催化剂活性评价
在全自动平行四路反应装置中对复合催化剂进行评价。首先,对反应装置进行气密性检测,保证装置不漏气后通入氢氮混合气(20%H2+80%N2),在250 ℃下常压还原10 h,然后切换合成气(CO+H2)进行反应。反应压力为4.0 MPa,反应温度为250 ℃,合成气总流量100 mL/min,氢碳比n(H2)/n(CO)=1.反应后气相产物经GC9560色谱在线分析后排空,液相产物经冷阱冷却后每隔24 h收集一次并离线测定。
1.4 产物分析及数据处理
反应产物由上海华爱GC9560气相色谱分析,其中有机组分(甲醇、二甲醚、乙醛、C2+OH及烃类等)经HP-PLOT/Q色谱柱进行分离后利用FID检测;无机组分(H2,CO,CO2)经过TDX-01色谱柱分离后用TCD检测。CO转化率XCO和各组分的选择性Si计算公式如下:
(1)
(2)
式中:XCO表示CO转化率;Si表示i组分的选择性;i表示气相及液相产物中除CO以外所有的含C化合物;n(CO)in表示进口气体中CO的物质的量;ni(g)表示气相产物中i组分的C物质的量;ni(l)表示液相产物中i组分的C物质的量。
1.5 样品的表征
XRD表征在DX-2700 X-ray型衍射仪上用连续扫描法测定。以CuKα为辐射源,Ni为滤片,扫描范围2θ=5°~ 85°,扫描速率为8(°)/min.
BET在Quantachrome SI N2吸附仪上进行测定。催化剂的比表面积和平均孔径采用BET和BJH公式计算得到。
FTIR分析采用VERTEX70型红外光谱仪测定。将0.1 g KBr与样品混合研磨后压片,扫描范围为4 000~400 cm-1.
NH3/CO2-TPD-MS在TP-5080型程序升温脱附仪上进行。取样品0.1 g,在280 ℃He气气氛下预处理30 min,降温至50 ℃吸附NH3/CO230 min,He气吹扫50 min,以10 ℃/min的速率程序升温至810 ℃,尾气采用QIC20质谱检测器进行检测。
2 结果与讨论
2.1 活性评价
表1为不同方法制备的AlOOH与C302按质量比为1∶2分层装填于固定床中用于CO加氢的活性评价结果。从产物分布来看,3个催化剂产物中甲醇居多,烃类、乙醛的含量很少。其中C302-RS的甲醇选择性接近90%,而C302-C的甲醇选择性明显较低,表现出较高的二甲醚选择性,同时CO2选择性也较大,表明该催化剂不仅具有较强的甲醇脱水能力,同时具备较强的水煤气变换能力。进一步研究发现C302-ST催化剂不同于其他两个催化剂的显著优势是C2+OH选择性相对较高,表明一步水热法制备的AlOOH具有碳链增长的能力。同时从表1中可以看出,C302-ST的CO转化率达到18%,而C302-C和C302-RS的CO转化率在5%附近波动。由此可见,AlOOH不同制备方法影响分层复合催化剂的结构,进而影响催化剂的活性和产物的选择性。

表1 分层复合催化剂的CO加氢活性评价结果Table 1 Performance of composite catalysts loaded by layers in CO hydrogenation reaction
2.2 XRD表征
图1是不同方法制备的AlOOH样品的XRD谱图。从图中可以看出,催化剂在2θ为14.5°、28.1°和38.4°处的衍射峰均归属为AlOOH的衍射峰,样品呈现出勃姆石相,谱图中未见其他杂质物相衍射峰的存在。不同方法制备的样品结晶度存在较大差异,沉淀法C得到的样品结晶度较低,而溶胶凝胶水热法RS、一步水热法ST得到的样品均峰形尖锐,有较高的结晶度,说明经过水热处理有利于样品的结晶,使晶型趋于完整。从图中还可以看出不同方法制备的样品晶面的择优取向不同,一步水热法是(020)晶面择优取向,而其他样品晶面择优取向不明显。结合活性数据,一步水热法ST的CO加氢的主要产物是C2+OH,说明其C2+OH的产生与结晶的完整程度以及(020)晶面的择优取向有关。
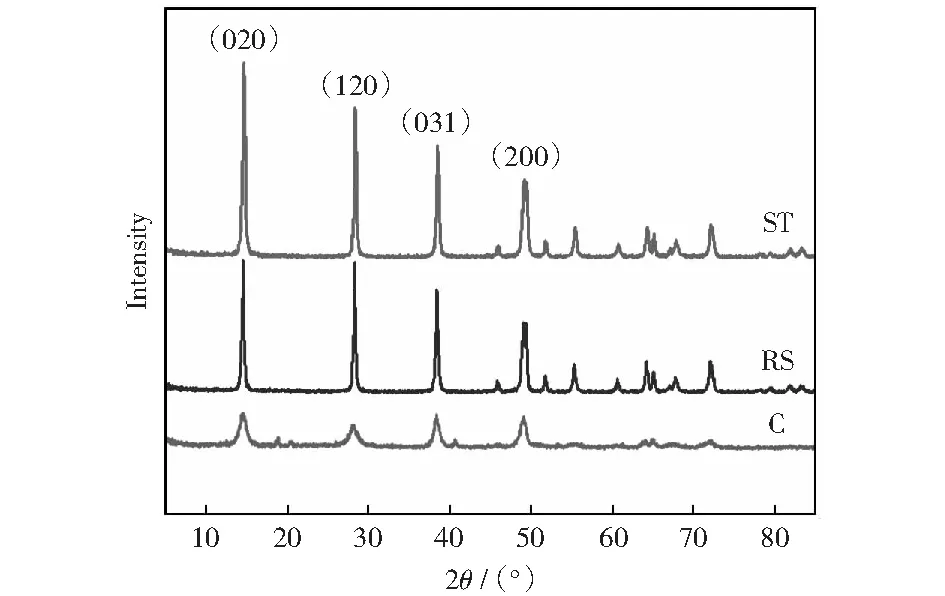
图1 不同AlOOH样品的XRD谱Fig.1 XRD patterns of different AlOOH samples
2.3 BET表征
不同方法制备的AlOOH的织构性质如表2,其吸脱附曲线及孔径分布如图2(a)和图2(b).从吸脱附曲线和孔径分布曲线可以看出3个样品等温线均为第Ⅳ类,回滞环形状为H3型,孔结构为平行板壁的狭缝孔。3个样品孔径分布较为宽泛。从样品的织构性质可以看出沉淀法C具有较高的比表面积,而其他两者的比表面积都较小,这是由于这两种方法制备的AlOOH样品结晶度较高造成的,这与XRD表征结果是一致的。一般认为较大的孔径能够为碳链增长提供足够空间,有利于C2+OH的形成,结合活性数据来看,沉淀法C并没有表现出较高的C2+OH选择性,反而一步水热法ST的C2+OH选择性较高,说明AlOOH样品的织构性质并不是影响分层复合催化剂CO加氢合成C2+OH的关键因素。

表2 不同AlOOH样品的织构性质Table 2 Textural properties of different AlOOH samples

图2 不同AlOOH样品的吸脱附曲线(a)和孔径分布曲线(b)Fig.2 N2 adsorption and desorption and pore size distribution isotherms of different AlOOH samples
2.4 FTIR表征
图3是不同方法制备的AlOOH的FTIR谱图。从图中可以看出,3个样品的红外谱图基本相近,3 092 cm-1和3 292 cm-1归属于Al—O—H的伸缩振动吸收峰;1 080 cm-1的强吸收峰和1 161 cm-1的肩峰对应于Al—O—H的对称弯曲振动和非对称弯曲振动;在764,647,486 cm-1处的吸收峰分别归属为Al—O的扭曲振动、伸缩振动和弯曲振动吸收峰[14]。1 384 cm-1处吸收峰为杂质NO3-.另外从谱图可以看出采用沉淀法制备的样品C在3 400 cm-1处和1 645 cm-1处出现新的吸收峰,分别归属为O—H的伸缩振动和弯曲振动,表明样品C中游离水含量较高。同时比较发现样品C在3 092 cm-1和3 292 cm-1处的特征吸收峰相较于其他两个样品较弱。文献[15]认为3 292 cm-1与1 161 cm-1处的两个吸收峰与结晶度高有关,而文献[16-17]中3 092 cm-1处的吸收峰与AlOOH层间结构水直接相关,这与XRD表征RS和ST样品结晶度高一致,同时说明其层状结构完整。
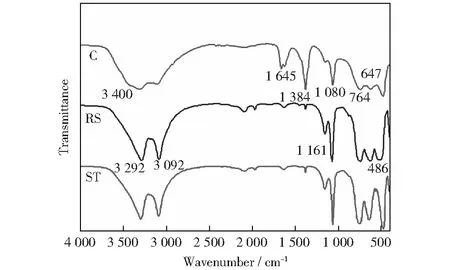
图3 不同AlOOH样品的FTIR表征Fig.3 FTIR spectra of different AlOOH samples
2.5 NH3-TPD-MS和CO2-TPD-MS表征
图4是不同方法制备AlOOH的NH3-TPD-MS表征。从NH3-TPD-MS谱图可以看出,沉淀法制备的样品C仅在150 ℃附近出现一个NH3脱附峰,归属于弱酸中心,而其他两种样品除150 ℃附近的低温脱附峰外,在550 ℃还有一个NH3高温脱附峰,归属于强酸中心;且3个样品的酸含量存在明显的差别。表3通过对面积积分给出了不同样品的弱酸含量、强酸含量及两者的比值。从中可以看出,沉淀法制备的样品C弱酸量远大于其他两个催化剂,这与前面XRD和FT-IR表征中发现的样品C结晶度低有关系。文献[18-20]表明,甲醇脱水生成二甲醚是催化剂的弱酸中心起作用的结果,催化剂的弱酸位是其活性中心,这与本文研究结果相一致。 另外,从表3发现一步水热法制备的催化剂ST弱酸量和强酸量明显高于溶胶凝胶水热法RS.

图4 不同AlOOH样品的NH3-TPD-MS表征Fig.4 NH3-TPD-MS profiles of different AlOOH samples

CatalystsWeakacid/10-6Strongacid/10-6n(Strong)∶n(Weak)C7.38--RS0.131.138.69ST0.633.856.11
图5是不同方法制备AlOOH的CO2-TPD-MS表征。3个样品在110 ℃附近的CO2脱附峰归属为弱碱中心,而300~550 ℃之间的CO2脱附峰归属为中强碱中心,样品RS和ST在600 ℃以后还出现一个CO2脱附峰,该脱附峰归属为强碱中心。从图中可以看出不同方法制备的样品其碱含量差别较大。表4对面积积分给出了不同催化剂的弱碱量和中强碱量及两者的比值。由此可以看出,沉淀法制备的样品C其弱碱量和中强碱量都明显高于其他两个样品。活性评价显示一步水热法ST表现出最好的活性和C2+OH选择性,说明适宜比例的强弱酸位和强弱碱位的协同作用是促进该催化剂生成C2+OH的重要原因。

图5 不同AlOOH样品的CO2-TPD-MS表征Fig.5 CO2-TPD-MS profiles of different AlOOH samples

表4 不同AlOOH样品的碱量Table 4 Basic amount of different AlOOH samples
3 结论
不同制备方法对AlOOH的结构及催化性能存在显著的影响。经过水热处理的溶胶凝胶水热法和一步水热法得到的AlOOH结晶度较高,层状结构完整,表面酸性发生明显改变。沉淀法表现出较高的二甲醚选择性,这与其丰富的弱酸量直接相关,而一步水热法表现出较高的C2+OH选择性,该催化剂是结构敏感型的,与其晶型完整、择优取向晶面明显、具有适宜强弱酸位和强弱碱位都有密切关系。
[1] MORTOLA V B,DAMYANOVA S,ZANCHET D,et al.Surface and structural features of Pt/CeO2-La2O3-Al2O3catalysts for partial oxidation and steam reforming of methane[J].Applied Catalysis B:Environmental,2011,107(3/4):221-236.
[2] 李德宝,马玉刚,齐会杰,等.CO加氢合成低碳混合醇催化体系研究新进展[J].化学进展,2004,16(4):584-592.
LI D B,MA Y G,QI H J,et al.Progress in synthesis of mixed alcohols from CO hydrogenation[J].Progress in Chemistry,2004,16(4):584-592.
[3] FANG K G,LI D B,LIN M G,et al.A short review of heterogeneous catalytic process for mixed alcohols synthesis via syngas[J].Catalysis Today,2009,147(2):133-138.
[4] MEI D H,ROUSSEAU R,KATHMANN S M,et al.Ethanol synthesis from syngas over Rh-based/SiO2catalysts:a combined experimental and theoretical modeling study[J].Journal of Catalysis,2010,271(2):325-342.
[5] YANG X M,WEI Y,SU Y L,et al.Characterization of fused Fe-Cu based catalyst for higher alcohols synthesis and DRIFTS investigation of TPSR[J].Fuel Processing Technology,2010,91(9):1168-1173.
[6] HERACLEOUS E,LIAKAKOU E T,LAPPAS A A,et al.Investigation of K-promoted Cu-Zn-Al,Cu-X-Al and Cu-Zn-X (X=Cr,Mn) catalysts for carbon monoxide hydrogenation to higher alcohols[J].Applied Catalysis A:General,2013,455(30):145-154.
[7] 高志华.浆态床甲醇、二甲醚催化剂液相合成新技术的基础研究[D].太原:太原理工大学,2007.
GAO Z H.Study on a complete liquid phase preparation technology for the catalyst used in slurry reactor to synthesis methanol and dimethyl ether[D].Taiyuan:Taiyuan University of Technology,2007.
[8] CHEN X Y,ZHANG Z J,LI X L,et al.Controlled hydrothermal synthesis of colloidal boehmite (γ-AlOOH) nanorods and nanoflakes and their conversion into γ-Al2O3nanocrystals[J].Solid State Communications,2008,145(7/8):368-373.
[9] LI G C,LIU Y Q,LIU D,et al.Synthesis of flower-like Boehmite (AlOOH) via a simple solvothermal process without surfactant[J].Materials Research Bulletin,2010,45(10):1487-1491.
[10] XU Z H,YU J G,LOW J X,et al.Microemulsion-assisted synthesis of mesoporous aluminum oxyhydroxide nanoflakes for efficient removal of gaseous formaldehyde[J].ACS Applied Materials Interfaces,2014,6(3):2111-2117.
[11] GREATHOUSE J A,HART D B,OCHS M E.Alcohol and thiol adsorption on (oxy)hydroxide and carbon surfaces:Molecular dynamics simulation and desorption experiments[J].The Journal of Physical Chemistry C,2012,116(51):26756-26764.
[12] HUANG J,WANG Y,ZHENG J M,et al.Influence of support surface basicity and gold particle size on catalytic activity of Au/γ-AlOOH and Au/γ-Al2O3catalyst in aerobic oxidation of α,ω-diols to lactones[J].Applied Catalysis B:Environmental,2011,103(3):343-350.
[13] 李磊磊,田慧辉,韩燕梅,等.AlOOH在一氧化碳加氢反应中结构与性能的探究[J].燃料化学学报,2016,44(7):830-836.
LI L L,TIAN H H,HAN Y M,et al.The structure and property of AlOOH in CO hydrogenation[J].Journal of Fuel Chemistry and Technology,2016,44(7):830-836.
[14] PRIVA G K,PADMAJA P,WARRIER K G K,et al.Dehydroxylation and high temperature phase formation in sol-gel boehmite characterized by Fourier transform infrared spectroscopy[J].Journal of Materials Science Letters,1997,16:1584-1587.
[15] MUSIC S,DRAGCEVIC D,POPOVIC S.Hydrothermal crystallization of boehmite from freshly precipitated aluminium hydroxide[J].Materials Letters,1999,40(6):269-274.
[16] 罗玉长.拟薄水铝石结构的演化[J].无机盐工业,1998,30(2):3-5.
LUO Y C.The structure evolution of pseudo-boehmite[J].Inorganic Chemicals Industry,1998,30(2):3-5.
[17] PETROVIC R,MILONJIC S,JOKANOVIC V,et al.Influence of synthesis parameters on the structure of boehmite sol particles[J].Powder Technology,2003,133(1/2/3):185-189.
[18] XU M T,LUNSFORD J H,WAYNE GOODMAN D,et al.Synthesis of dimethyl ether (DME) from methanol over solid-acid catalysts[J].Applied Catalysis A:General,1997,149(2):289-301.
[19] JOO O S,JUNG K D,HAN S H.Modification of H-ZSM-5 and γ-alumina with formaldehyde and its application to the synthesis of dimethyl ether from syngas[J].Bulletin-Korean Chemical Society,2002,23(8):1103-1105.
[20] 解峰,黎汉生,赵学良,等.甲醇在活性Al2O3催化剂表面的吸附与脱水反应[J].催化学报,2004,25(5):403-408.
XIE F,LI H S,ZHAO X L,et al.Adsorption and dehydration of methanol on Al2O3catalyst[J].Chinese Journal of Catalysis,2004,25(5):403-408.
