负载型金-银双金属催化剂低温催化尾氯脱氢性能
2018-03-23路亭亭李玉娜王寒寒李福祥薛建伟吕志平
路亭亭,刘 茜,李玉娜,王寒寒,李福祥,薛建伟,吕志平
(太原理工大学 化学化工学院,太原 030024)
尾氯是氯碱工业中对氯气压缩液化制备成液氯时,不凝气体富集产生的混合气,该混合气含有氯气、氮气、氧气及氢气等成分。由于氢气爆炸极限的限制,尾氯无法用于下游产品的生产。目前,处理尾氯的主要方法是补加一定比例的氢气与尾氯混合,并燃烧合成盐酸,但该方法无法解决混合气体含氢易爆炸的安全问题,因此必须寻找其他有效的处理方法。
1957年,KULCSAR et al[1]研制出一种以活性炭为载体的催化剂,通过催化尾氯中的氢气和氯气生成氯化氢的反应达到脱氢目的。研究者将贵金属钯作为活性组分负载到氧化铝载体上,在250~260 ℃下对混合气体脱氢,可使混合气体含氢量达到10-6级[2],用SiO2为载体负载LaCl3、KCl及CuCl2,在400 ℃时催化反应,最终氢含量可达10-6级。然而通过催化氢氯反应而实现尾氯脱氢的方法存在着反应温度高、催化剂寿命低等弊端。金催化剂具有优异的低温催化活性、良好的抗水性、稳定性和抗潮湿性能,可在许多低温氧化反应中应用[3-6]。THOMPSON[7]提出负载型金催化剂可应用于氢氯反应、一氧化碳氧化反应、水煤气变化等方面,金催化剂相比于其他贵金属(Rh,Pt,Pd)廉价,已被证明是非常好的催化剂。
为了探索这种强腐蚀、强氧化的过量氯气混合气体气氛中氢气的催化反应脱除,本实验选择耐湿性较好的金-银双金属催化剂,在低温条件下对含有Cl2、O2、N2等模拟尾氯的混合气进行催化脱氢性能研究,为最终解决尾氯中氢气的催化安全脱除提供依据。
1 实验部分
采用阴离子浸渍法[8]和等量浸渍法制备催化剂,先计算等体积浸渍1 g γ-Al2O3所需的体积V,然后将氯金酸溶液加入坩埚中,加入去离子水使总体积为V,然后用NaOH溶液调节pH为7,将1 g γ-Al2O3加至上述溶液中,在室温条件下浸渍24 h以上,用稀氨水溶液浸泡10 min,最后用去离子水冲洗、过滤,至上层清液用AgNO3溶液检验无Cl-存在。之后在100 ℃的干燥箱中恒温干燥15 h,再放进一定温度的马弗炉中焙烧4 h,用氢气在一定温度下还原3 h,待温度冷却后得Au-Ag/Al2O3.
模拟工业尾氯的组成配制成混合气充入储气罐,用氮气将整个管路进行吹扫,以去除管路中残存的水蒸气和杂质。将储气罐接入实验装置,把催化剂放入固定床反应器中,在一定反应温度下进行反应,定时取样分析。实验结束后取出催化剂,用氮气吹扫管路,该流程如图1所示。
本实验采用X射线衍射、傅里叶红外光谱以及氮吸附-脱附等表征手段,对催化剂样品进行表征。
2 结果与分析
2.1 焙烧温度对Au-Ag/Al2O3催化脱氢性能的影响
在催化反应过程中,随着焙烧温度的升高,氢气转化率和氢-氧反应选择性先增大后减小。当焙烧温度为500 ℃时,氢气转化率达到91.90%,氢-氧反应选择性为65.03%,如图2所示。焙烧温度太高时,金属氧化物的结晶程度增强,而且会使金颗粒长大,发生烧结现象;温度过低,则不能使氢氧化物完全分解为活性相,活性组分含量降低,导致催化剂的活性降低[9]。

图2 焙烧温度对Au-Ag/Al2O3的催化脱氢性能的影响Fig.2 Influence of calcinations temperature on performance of catalytic dehydrogenate reaction
2.2 还原温度对Au-Ag /Al2O3催化脱氢性能的影响
在催化反应过程中,随还原温度的升高,氢气转化率和氢-氧反应选择性出现先增大后减小的变化(如图3所示)。当还原温度太低时,不能将催化剂中的氧化物完全还原为活性金属价态;若还原温度太高,则金属颗粒容易发生团聚现象,活性中心利用率下降,催化剂活性降低[10]。从图3可看出,还原温度为250 ℃时,氢气转化率和氢-氧反应选择性分别达到91.75%和64.26%.

图3 还原温度对Au-Ag/Al2O3的催化脱氢性能的影响Fig.3 Influence of reduction temperature on performance of catalytic dehydrogenate reaction
2.3 Au/Al2O3和Au-Ag/Al2O3在不同反应温度下催化脱氢性能的比较
随着反应温度的升高,两种催化剂氢气转化率和氢氧反应选择性均先增加后保持稳定(如图4所示)。尽管双金属催化剂Au-Ag/Al2O3的氢氧反应选择性略低于Au/Al2O3,但可以看到,其脱氢反应转化率均高于催化剂Au/Al2O3.在100 ℃时,Au-Ag/Al2O3催化剂转化率为94.58%,Au/Al2O3催化剂转化率为86.29%,因此,使用Au-Ag/Al2O3催化剂,更有利于尾氯中氢气的脱除,达到尾氯催化脱氢的目的。

图4 Au/Al2O3和Au-Ag/Al2O3催化剂催化脱氢性能的比较Fig.4 Performance comparison of catalytic dehydrogenation reaction in Au/Al2O3 and Au-Ag/Al2O3
2.4 负载型催化剂Au-Ag /Al2O3的XRD表征
2.4.1 不同焙烧温度下制备的Au-Ag/Al2O3的XRD表征
从图5中可以看出,当Au-Ag/Al2O3催化剂经过350~500 ℃焙烧处理后,均未出现金属的特征衍射峰,而在600 ℃焙烧处理后,2θ为36°和38°处出现银和金的衍射峰。考虑到如果焙烧温度过低,金属的络合物尚未完全分解而形成氧化态;然而焙烧温度过高,加速了活性组分在载体表面的迁移,金颗粒和银颗粒的粒径明显增大,催化剂的催化脱氢性能明显降低[9]。因此综合2.1中的催化结果,选择焙烧温度500 ℃为最佳。

图5 不同焙烧温度下Au-Ag/Al2O3的XRD谱Fig.5 XRD patterns of Au-Ag/Al2O3 at different calcination temperature
2.4.2 不同还原温度下制备的Au-Ag/Al2O3的XRD表征
由图6中看出,在2θ为37°、45.5°、67.1°处均出现γ-Al2O3特征衍射峰。谱图上没有发现零价金和银的特征衍射峰,这可能是因为金属负载量偏低且粒子高度分散在载体上,或者γ-Al2O3的特征衍射峰遮盖了金属的特征衍射峰[11]。

图6 不同还原温度下Au-Ag/Al2O3的XRD谱Fig.6 XRD patterns of Au-Ag/Al2O3 at different reduction temperature
2.5 负载型催化剂Au-Ag/Al2O3的FTIR谱图分析
图7为负载型催化剂Au-Ag/Al2O3的FTIR图谱,图中a曲线代表γ-Al2O3,b曲线代表Au-Ag/Al2O3催化反应前,c曲线代表催化脱氢反应后。图中出现的特征吸收峰:波数为620 cm-1的是Al3+离子的六配位特征吸收峰;880 cm-1的是四配位的Al—O振动引起的吸收峰[12];1 650 cm-1附近的较弱的特征吸收峰为H—OH键之间通过弯曲振动所引起的吸收峰;3 450 cm-1附近的特征吸收峰可解释为载体吸附水伸缩振动或者表面的—OH产生的吸收峰[13],从图中可以看出曲线a、b、c的特征峰的峰型基本相同,峰强度几乎没有改变,说明Au-Ag/Al2O3双金属催化剂具有较强的耐湿性能,载体的骨架结构稳定。
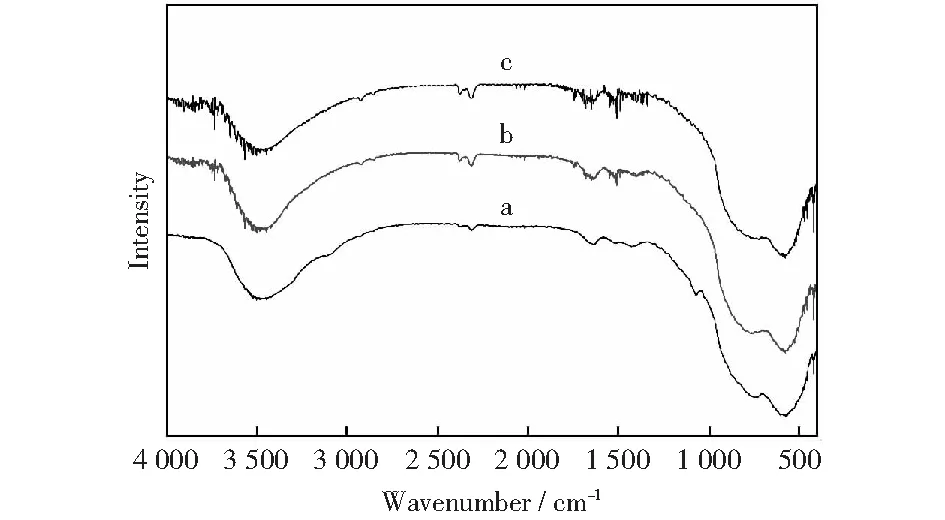
图7 不同状态下的Au-Ag/Al2O3的FTIR谱Fig.7 FTIR patterns of Au-Ag/Al2O3 at different states
2.6 负载金属前后的氮吸附脱附测试
从Al2O3和Au-Ag/Al2O3的孔分布和比表面积分布表(如表1)中看出,γ-Al2O3的比表面积和总孔容在负载前后及反应前后均有一定程度的减小,这可能是因为金属粒子占据部分孔道或迁移团聚在一起,而平均孔径没有发生变化,说明金属的负载和反应过程对γ-Al2O3的孔结构影响不大。

表1 Al2O3和Au-Ag/Al2O3的孔分布和比表面积分布Table 1 Pore size and surface area distribution of Al2O3 and Au-Ag/Al2O3
3 结论
1) 在金-银负载量为0.4%~0.7%时,稀氨水浸泡时间为10 min,500 ℃焙烧4 h,氢气250 ℃还原3 h后,制得的Au-Ag/Al2O3双金属催化剂在反应温度为100 ℃下的催化脱氢性能最佳,氢气转化率为94.58%,氢-氧反应选择性为59.28%.
2) 对负载金属和脱氢反应前后的催化剂进行N2吸附脱附表征,可知负载金属和脱氢反应后,载体γ-Al2O3的比表面积和总孔容稍有减小,平均孔径不变,说明负载和反应后,并没有改变催化剂的孔结构,催化剂结构稳定。
3) 通过对比负载前后和反应前后的XRD图谱和FTIR图谱可知,负载和脱氢反应后,金属金和银在载体上均高度分散,以Al2O3为载体的负载型Au-Ag催化剂在富氯气氛催化反应中结构稳定。
[1] KULCSAR G J,KULCSAR-NOVAKOVA M.The slow combustion of hydrogen in the chlorine resulting from electrolysis in order to avoid explosions.II The study of the slow combustion of hydrogen in chlorine in the presence of active carbon in order to determine the technical characteristics of the reaction[J].Studii si Cercetari de Chimie,1957,8:221-230.
[2] PIETERS W J M,WENGER F.Removal of low concentrations of hydrogen from chlorine gas:US4224293[P].1980-09-23.
[3] 周华,董守安.纳米金负载型催化剂的研究进展[J].贵金属,2004,25(2):49-55.
ZHOU H,DONG S A.Advances in the research of supported gold particle catalysts[J].Precious Metals,2004,25(2):49-55.
[4] BOND G C,THOMPSON D T.Catalysis by gold[J].Catalysis Reviews:Science and Engineering,1999,41(3/4):319-388.
[5] HARUTA A.When gold is not noble:catalysis by nanoparticles[J].Chemical Record,2003,3(2):75-87.
[6] HARUTA M.Catalysis of gold nanoparticles deposited on metal oxides[J].CATTECH,2002,33(43):102-115.
[7] THOMPSON D T.Highlights of the symposium on gold/silver catalysis[J].Gold Bulletin,2001,34(4):134-140.
[8] 索掌怀,翁永根,金明善,等.金溶液pH值及浸泡处理对Au/Al2O3催化剂上CO氧化反应活性的影响[J].催化学报,2005,26(11):1022-1026.
SUO Z H,WENG Y G,JIN M S,et al.Influence of gold solution pH value and steeping treatment on CO oxidation reactivity over Au/Al2O3catalyst[J].Chinese Journal of Catalysis,2005,26(11):1022-1026.
[9] 高典楠,王胜,刘莹,等.焙烧温度对Pd/Al2O3催化剂上甲烷燃烧反应性能的影响[J].催化学报,2010,31(11):1363-1368.
GAO D N,WANG S,LIU Y,et al.Methane combustion over Pd/Al2O3catalyst:effect of calcination temperature[J].Chinese Journal of Catalysis,2010,31(11):1363-1368.
[10] 詹亮,张睿,王艳莉,等.Pd在超级活性炭上的负载对其储氢性能的影响[J].新型炭材料,2005,20(1):33-38.
ZHAN L,ZHANG R,WANG Y L,et al.Properties of super-activated carbon coated with palladium for hydrogen storage[J].New Carbon Materials,2005,20(1):33-38.
[11] 许立信,王豹,李培杰,等.Au/γ-Al2O3催化氧化葡萄糖制备葡萄糖酸钠的研究[J].食品工业科技,2012,33(16):289-295.
XU L X,WANG B,LI P J,et al.Catalytic oxidation of glucose to sodium gluconate by Au/γ-Al2O3catalysts[J].Science and Technology of Food Industry,2012,33(16):289-295.
[12] 张学清,项金钟,胡永茂,等.纳米Al2O3的制备及红外吸收研究[J].中国陶瓷,2004,40(1):26-29.
ZHANG X Q,XIANG J Z,HU Y M,et al.Study on preparation and IR absorbency of nanoscale Al2O3[J].China Ceramics,2004,40(1):26-29.
[13] 王志明,王昊.Al2O3-SiO2溶胶的红外吸收光谱分析[J].玻璃纤维,2000(1):6-8.
WANG Z M,WANG H.Analysis of infrared absorption spectra of Al2O3-SiO2sol[J].Fiber Glass,2000(1):6-8.
