肉品中的蛋白质氧化机制及其影响因素
2018-03-20谷东陈陶宁萍王锡昌李钰金刘远平
袁 凯,张 龙,谷东陈,吴 娜,陶宁萍,王锡昌,*,李钰金,刘远平
(1.上海海洋大学食品学院,上海 201306;2.荣成泰祥食品股份有限公司,山东 威海 264309)
在过去的十几年间,关于肉制品中蛋白质氧化的相关研究引起了国内外广泛关注。这些研究主要集中于蛋白质氧化对食品加工和食用品质的影响及其对人体健康的危害方面[1]。
肉制品中的蛋白质氧化可直接由活性物质诱导发生。此类活性诱导物质主要包括一些含有氮氧元素的化学自由基或非自由基基团[2]。其中自由基诱导物包括羟自由基(·OH)、超氧阴离子自由基(·)、过氧化自由基(HO2·)、一氧化氮自由基(NO·)等;非自由基诱导物包括过氧化氢(H2O2)、单重态氧(1O2)、亚硝酸根()、次氯酸(HClO)和臭氧(O3)等[2-3]。活性诱导物质的产生因素分为外部因素(X射线、γ射线、化学物质等)和内部因素(内源酶、肌红蛋白金属催化酶系、生物代谢等)[2,4]。此类物质造成蛋白质结构改变或破坏,主要包括氨基酸侧链的修饰、蛋白质多肽骨架断裂、蛋白分子间发生聚合等,从而导致蛋白质理化性质发生改变,进而影响肉品的加工特性、营养价值和食用风味[5],甚至可能危害消费者的身体健康[6]。
1 肉品中蛋白质氧化的机理
蛋白质氧化是蛋白质直接或间接受活性诱导物质诱导所发生的一种共价键修饰变化。按诱导物分类,反应类型包括自由基诱导反应和非自由基诱导反应。按修饰作用分类,反应类型包括直接诱导反应和间接诱导反应[3]。
1.1 直接诱导氧化反应
自由基诱导物均含有一个孤电子,表现出强反应活性,它们通过夺氢、偶合、加氧及裂解等反应方式直接作用于蛋白质分子[7]。自由基诱导物进攻蛋白质分子主要有3 个作用位点:主肽链骨架、脂肪族氨基酸侧链基团、芳香族氨基酸侧链基团[8]。自由基主要通过单电子还原、夺氢、加氧的方式将肽主链上的中心碳基团转化为烷过氧自由基(COO·)和烷氧自由基(CO·),进而通过α-酰胺化或二酰胺途径造成肽主链断裂或形成交联物;脂肪族氨基酸侧链基团则易直接被氧化成羰基化合物;芳香族氨基酸侧链基团受自由基攻击后,所得反应产物通过加氢和偶合反应转化为芳香衍生物和芳香自由基[5,9-12]。
1.2 间接诱导氧化反应
脂质过氧化反应和非酶糖基化反应能间接诱导蛋白质发生氧化[9],肉品加工及贮藏过程中脂质过氧化不可避免,脂质过氧化反应过程中产生大量中间产物,如COO·、CO·、活性羰基化合物和氢过氧化物等。COO·和CO·作用于肽主链和氨基酸侧链基团;活性羰基化合物与蛋白质侧链基团作用形成共价交联物[13];氢过氧化物与蛋白质通过ε-氨基途径形成酰胺加合物。脂质过氧化反应中产生的活性醛诱导蛋白质氧化变性能力最强,此类醛主要为α、β-不饱和醛类(4-羟基-2-壬烯醛、丙烯醛、丙二醛)[14]。其中活性最强的丙二醛与蛋白质直接发生Micheal加成反应,或与蛋白质发生氨基反应生成席伏碱[15-16]。
此外,非酶糖基化反应能间接诱导蛋白质发生氧化,该反应机理尚不明确,已知此类反应促使蛋白质之间形成交联,更多的理论解释需进一步研究。
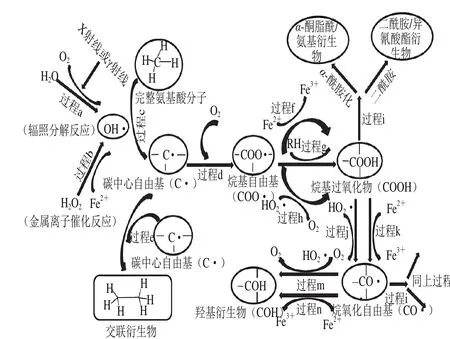
图1 肉制品中自由基诱导蛋白质氧化途径Fig.1 Free radical-mediated pathway of protein oxidation in meat
综上所述,蛋白质氧化反应类型多样,发生机理也十分复杂。图1为金属离子诱导蛋白质氧化的链式反应机制。首先活性氧(reactive oxygen species,ROS)(金属离子催化产生)夺取蛋白质分子上一个氢原子,产生一个碳中心自由基(C·)(反应过程c),C·有氧条件下被修饰成COO·(反应过程d)。COO·易与Fe2+发生氧化还原反应(反应过程f),或夺取一个外部氢原子(反应过程g),亦或被质子化的超氧化自由基攻击(反应过程h),最终都形成烷基过氧化物(COOH)。COOH与过氧化自由基(HO2·)均能与Fe2+反应生成CO·和羟基衍生物(C O H)(反应过程m和n)[2,5]。有氧条件下,两个C·与彼此间通过形成碳碳链(C—C)生成交联衍生物(反应过程e)。COOH和烷基自由基衍生物均能通过α-酰胺化或者二酰胺途径发生裂解(反应过程i)[5],生成蛋白质片段。
蛋白质氧化的其他发生机理与图1中金属离子诱导氧化类似,由于氧化剂和氧化作用位点的不同,其链式反应过程各异。
2 蛋白质氧化评估指标
2.1 羰基含量
蛋白质羰基含量被广泛应用于评估蛋白质的氧化程度[3]。在链式反应过程中,多个途径生产羰基,途径及其反应机制分别如表1和图2所示。

表1 蛋白质氧化过程中的羰基产生途径Table1 Pathways for carbonyl production in protein oxidation
能直接被氧化的脂肪族氨基酸主要包括精氨酸(Arg)、赖氨酸(Lys)、苏氨酸(Thr)、脯氨酸(Pro)等[17];COOH、CO·通过α-酰胺化途径导致多肽骨架链β-断裂;脂质氧化中产生的不饱和醛与蛋白质发生Micheal加成,参与反应的蛋白质基团主要包括组氨酸、咪唑、胱氨酸巯基、赖氨酸侧链残基[9,18-19];还原糖及其氧化产物与赖氨酸反应生成活性羰基衍生物[4](图2)。
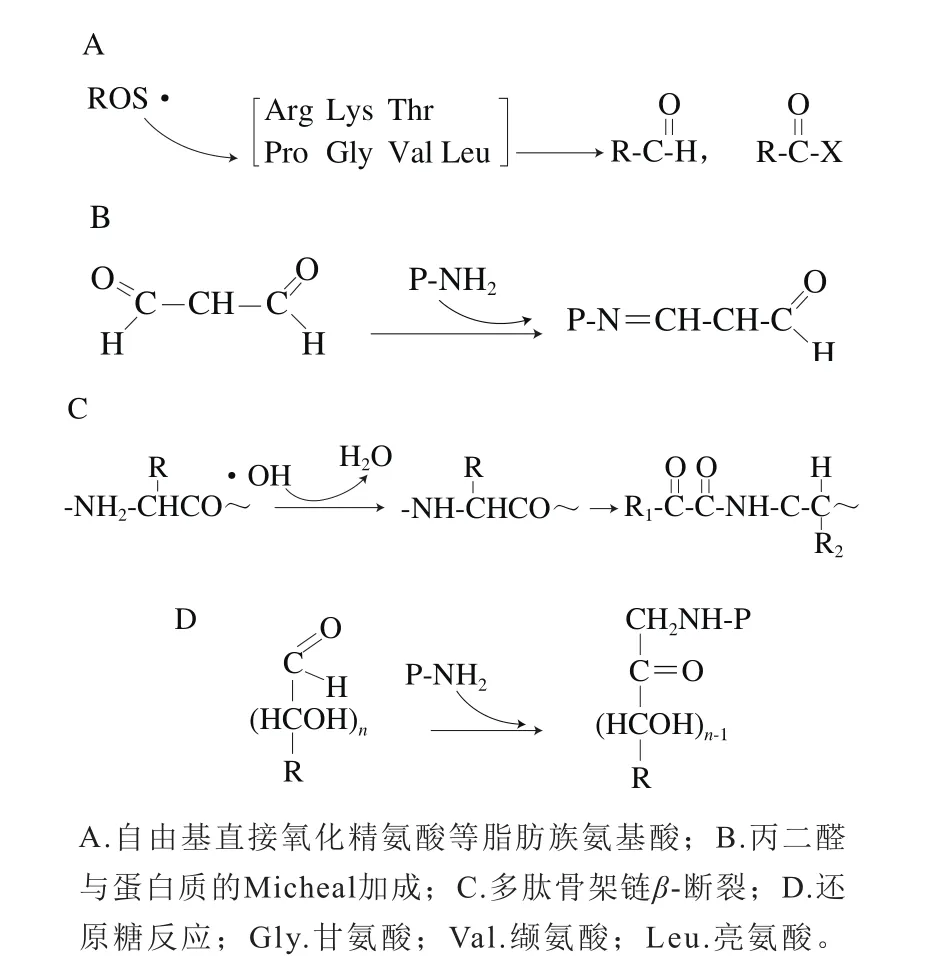
图2 在加工肉中蛋白质氧化过程中羰基基团的产生机制[20]Fig.2 Mechanisms for the generation of carbonyl groups caused by protein oxidation in processed meat[20]
羰基含量测定的常用方法包括荧光素胺法、免疫杂交法、荧光素肼法、硼氢化钠法、酶联免疫法、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)比色法[21-23]。其中DNPH比色法被认为是最简便的测定方法,其原理是羰基基团与DNPH反应生产成棕红色的2,4-二硝基苯腙沉淀,经盐酸胍溶解后在370 nm波长处有吸收,利用苯类腙的吸附系数为21 000 L/(mol·cm),计算蛋白质中羰基含量/(nmol/mg)[24]。尽管,DNPH比色法经典有效,但测定易受反应残留的DNPH干扰,测量结果往往偏高,若将吸收波长从370 nm提高到450 nm,能有效避免其干扰[25]。此外,反应中得到的沉淀颜色并不唯一,沉淀颜色可能与被检蛋白质的结构有关,含有不共轭双键醛、酮的蛋白质分子与DNPH产生黄色沉淀,含有碳碳双键较多或芳环共轭的分子与其反应得到红色沉淀。
2.2 巯基含量
蛋白质氧化会造成巯基含量减少,因此巯基含量可作为检测蛋白质氧化程度的指标。在蛋白质分子中,半胱氨酸和蛋氨酸均含有硫原子,且对ROS十分敏感,易被氧化生成二硫键。其中半胱氨酸形成磺酸、亚磺酸、次磺酸[26-27]。蛋氨酸的氧化产物主要是形成亚砜和砜[28]。Ellman法是目前公认的测定蛋白质中游离巯基和二硫键含量最快速、简捷的方法。利用5,5-二硫基(2-双硝基苯甲酸)(5,5-dithio-bis-(2-nitrobenzoic acid),DTNB)与游离的巯基反应生成黄色物质2-硝基-5-巯基苯甲酸(2-nitro-5-mercaptobenzoic acid,TNB),采用分光度计法测定TNB含量。DTNB作为一种衍生剂与游离的巯基反应生成二硫键,并释放出一个硫离子。由于蛋白质巯基和所产生的TNB物质的量之比为1∶1,通过在412 nm波长处测定吸光度计算得到的TNB含量即是蛋白质巯基含量[29]。
2.3 蛋白质的裂解与交联聚合程度
蛋白质氧化往往会导致蛋白质分子发生裂解或交联聚合变化。蛋白质分子发生氧化变性后生成的COOH和烷基自由基衍生物能通过α-酰胺化途径或二酰胺途径导致肽链骨架断裂,形成碎片。另外蛋白质上谷氨酸和天冬氨酸的残基氧化可以导致的肽键裂解形成N-末端碎片[1]。通过4-氨基丁酸法可检出的这些碎片中的2-吡咯烷酮衍生物,但这种断裂的机理尚不清楚[30]。
蛋白质氧化也能造成分子聚合。链式反应初期生成的C·在氧不足的情况下相互结合。而巯基和酪氨酸残基的氧化或者亚硝基化能分别形成二硫键和双酪氨酸键,促使蛋白质内部或分子间发生交联聚合。测定二酪氨酸的含量能明确氧化反应后蛋白质的交联聚合程度,而十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)能够依据分子质量大小分离并富集各种蛋白质分子,在电泳图谱上比较实验组和对照组(标准蛋白)条带间的差异,判别是否存在断裂、交联聚合反应,并依据条带灰度定量计算反应程度[31]。
2.4 其他
除以上3 项指标外,可用来评价蛋白质氧化程度的指标还有许多,如蛋白质表面疏水性、蛋氨酸含量、席伏碱含量、游离氨基含量等,但这些指标不具有广泛性和普遍性,且评价结果受原料肉种类、检测仪器的制约。相比较之下,蛋白质羰基含量、巯基含量、裂解与聚合程度这3 个指标的测定是更简单、实用的研究方法。
3 影响肉品加工中蛋白质氧化的原因及其控制方法
3.1 原料
3.1.1 高铁肌红蛋白
肉品中含有化学性质极不稳定的肌红蛋白,并以3 种形式(脱氧肌红蛋白、氧合肌红蛋白、高铁肌红蛋白)存在肌肉中[32],其中高铁肌红蛋白含量与脂质氧化和蛋白质氧化作用紧密相关。动物死后,高铁肌红蛋白还原酶被耗尽后,高铁肌红蛋白无法按正常代谢途径被还原为脱氧肌红蛋白,逐渐积累增多。高铁肌红蛋白(含Fe3+)积累增多并与H2O2反应促使自由基向肌球蛋白间传递、扩散、氧化。高铁肌红蛋白含量积累越高,氧化速率越快[33]。肉的品种和部位影响高铁肌红蛋白含量,进而影响蛋白质氧化变性程度,通常畜禽类肉中的高铁肌红蛋白含量最高,其次是水产品红肉,白肉的含量最低。徐坤华等[34]研究蓝鳍金枪鱼不同部位肌肉在不同贮藏条件下的高铁肌红蛋白的积累情况,在-18 ℃和-30 ℃条件贮藏,肌肉中的高铁肌红蛋白在100 d内迅速大量积累,在低于-50 ℃的条件下,各部位的高铁肌红蛋白增速缓慢。
各种原料肉在实际加工中都不可避免与氧气接触,造成氧合肌红蛋白大量转化高铁肌红蛋白,例如在绞肉或者斩拌工艺中,肌肉组织破碎,蛋白质与氧气接触的表面积增加,同时肉品内部中含氧量急剧增加,加剧了蛋白质氧化反应,控制加工工艺参数是常用的控制蛋白质氧化的方法,例如采取低速、低温、低氧的肉破碎条件。严玉玲等[35]研究了中红外-热风干燥和单一热风干燥技术对牛肉干中肌红蛋白、氧合肌红蛋白和高铁肌红蛋白含量的影响,发现中红外-热风干燥处理后的牛肉中高铁肌红蛋白含量显著低于传统热风干燥,且中红外-热风干燥能有效维持肉品的色泽。
一些工艺如漂洗处理能减少肉品加工过程中高铁肌红蛋白的积累。在此工艺操作中,大部分水溶性的血红色素蛋白被去除,原料肉中高铁肌红蛋白含量基数大量减少,因此能有效控制高铁肌红蛋白的积累。Eymard等[36]对金枪鱼碎肉进行漂洗处理,随后低温贮藏,结果表明随漂洗次数增多,低温贮藏过程中蛋白质氧化速率减慢且氧化程度降低。
目前鲜有关于高铁肌红蛋白对蛋白质氧化变性直接影响的研究,相关研究集中于高铁肌红蛋白的含量与肉品色泽的相关性及不同加工方式的处理对肉品中高铁肌红蛋白积累的影响,故研究高铁肌红蛋白含量对蛋白质氧化的直接影响有实际意义。
3.1.2 脂肪
原料肉尤其水产品肉中含有大量多不饱和脂肪酸,如二十二碳六烯酸(docosahexenoic acid,DHA)、二十碳五烯酸(eicosapentenoic acid,EPA)、花生四烯酸(arachidonic acid,ARA)等,反刍动物和白肉动物肉中不饱和脂肪酸含量低[37]。脂肪酸发生氧化反应,产生大量活性中间产物,能直接参与或间接加速蛋白质氧化。黄莉等[38]研究脂肪添加量对冷冻水饺肉馅肌原纤维蛋白氧化的影响,发现随着脂肪添加量的增加,水饺肉馅中肌原纤维蛋白中羰基含量显著增加。SDS-PAGE图显示贮藏过程中肌球蛋白重链和肌动蛋白的含量下降,肌球蛋白轻链在贮藏180 d后消失,蛋白质交联聚合现象明显。在肉品加工中,脂肪的氧化持续发生,抑制脂肪氧化在一定程度上能够抑制蛋白质的氧化。在食品中添加抗坏血酸或多酚类等抗氧化剂,或者尽量除去原料肉中的脂肪可以控制脂肪氧化。例如在鱼糜加工过程中,可通过增加漂洗次数和增大料液比减少脂肪含量,从而达到控制氧化的目的。
3.1.3 金属离子
温度或氧气浓度等条件的变化会刺激血红素铁向非血红素铁转变[39]。在H2O2存在的条件下,非血红素铁和其他过渡金属离子可催化蛋白质氧化和脂类氧化,其中Fe3+和H2O2参与的氧化反应为费顿反应。分子氧存在时,肉(如鱼肉)组织中的Fe3+和Cu2+可以对肌肉蛋白质进行催化氧化作用。这些过渡金属引发的氧化通常作用于碱性氨基酸(如组氨酸、精氨酸、赖氨酸)和含硫氨基酸(半胱氨酸和蛋氨酸),可导致组氨酸转变为天冬氨酸或天冬酰胺,脯氨酸转变为谷氨酸和γ-谷氨半醛,赖氨酸可能转变为2-氨基半醛[40]。
为抑制金属离子的促氧化作用,最常见的加工方式是添加一些抗氧化剂,如儿茶素、芦丁等天然提取物。此类添加物作用的可能机制包括两方面:一是作为金属螯合剂使非血红素铁的促氧化能力失活;另外,可清除费顿反应产生的·OH或其他自由基[41]。
3.2 外源添加物
肉制品工业的发展离不开添加剂的使用,添加剂种类丰富,包括防腐剂、抗氧化剂、护色剂、增香剂、乳化剂、水分保持剂、增稠剂等。在肉质品加工及贮藏过程中,为增强肉品的加工或风味品质,往往加入一些添加物如食盐(NaCl)、多聚磷酸盐、亚硝酸盐、多酚化合物、香辛料、天然抗氧化物质等,不同添加物对蛋白氧化产生不同影响。
其中NaCl的添加对蛋白质氧化的影响尤其重要,高浓度的盐分破坏细胞膜的完整结构,使得胞内脂质和蛋白质能与活性诱导物质自由接触,高浓度的NaCl能够降低肉中抗氧化酶活性,NaCl也能促进高铁肌红蛋白的积累[41]。Liu Zaiqun等[42]研究发现高浓度的NaCl(0.6 mol/L)直接影响蛋白质的结构和溶解度,该浓度的NaCl直接破坏肌原纤维蛋白之间的静电斥力,使得蛋白质分子结构疏松,易受活性基团的攻击。因此在腌制等加工过程中,须避免不均匀的操作方式造成局部盐含量过高,加速蛋白质氧化变性。
多聚磷酸盐是肉制品加工中常用的品质改良剂,能够增强肉制品的保水性,提高成品率[43]。添加的磷酸盐同时具有封闭金属阳离子、减缓蛋白质及脂质氧化的作用[44]。陆玉芹[45]研究焦磷酸盐和多聚磷酸盐处理对冰温贮藏过程中罗非鱼肉的蛋白质、脂质氧化及其品质的影响,发现质量分数3%的焦磷酸钠处理可明显延缓蛋白质中二硫键含量的升髙,并减缓蛋白质表面疏水性的升高,抑制蛋白氧化,同时保证鱼片较好的品质。
亚硝酸盐除作为发色剂外,还具有抑菌和增加肉制品食用风味的作用。它能通过与不饱和脂肪酸反应稳定脂质组成;螯合微量元素阻止金属离子催化氧化作用;配位中心铁原子,与血红素形成稳定的化合物;抑制脂质降解产生的中间过氧化物[46]。Vossen等[47]曾指出亚硝酸的抗氧化作用归因于其转化产物NO,NO通过螯合铁元素,打破自由基链反应。李晨伊[48]研究亚硝酸盐对西式火腿肌原纤维蛋白氧化的影响,发现亚硝酸盐所具备的抗氧化性随其添加量增多而提高,主要表现在亚硝酸盐能抑制羰基和二聚酪氨酸的形成,从而阻止肌原纤维蛋白的变性。
多酚类化合物是较好的脂质和蛋白质抗氧化剂,其抗氧化机理主要通过猝灭自由基剂或螯合金属离子等方式阻断链式反应。张慧芸等[49]研究发现质量分数0.05%鞣酸和0.25%没食子酸可显著抑制蛋白中羰基和二聚酪氨酸的积累,同时提高肌原纤维蛋白的最大热变性温度和凝胶保水性。Jongberg等[50]通过研究白葡萄提取物对牛心肉糜氧化的抑制效果,验证了白葡萄多酚提取物可通过同蛋白质结合占据巯基反应位点,阻止蛋白质间巯基相互结合,避免蛋白质因氧化产生交联聚合反应。
其他类添加物对蛋白质氧化变性的影响各异,同时与添加量密切相关。如作为抗氧化添加物广泛使用的抗坏血酸,其用量不同会对蛋白质氧化造成不同影响。抗坏血酸浓度为0.1~0.2 mmol/L时,能够促进金属离子与蛋白质之间发生氧化还原循环,产生更多的·OH,促进蛋白质的氧化;当浓度大于2 mmol/L才能发挥其抗氧化作用[51]。
3.3 加工及保藏方式
肉制品的加工方式多样,如漂洗、过滤、绞肉、碾压、擂溃、发酵、烟熏、加热、辐照等,各种加工方式都可能引起蛋白质的氧化。例如加工过程中高强度机械作用可能导致原料肉局部温度过高、带入氧化诱导因子、增大蛋白质与氧气接触的表面积、造成水分活度过高等情况都可能加速蛋白质氧化速率[52]。
制作中式香肠过程中,切片和研磨破碎肌肉组织,可能增大蛋白质分子与氧气接触的表面积,暴露出更多的氧化反应位点,导致蛋白质羰基大量生成[53]。在组织破碎过程中应控制斩拌速率,因为速率过低,不利于细胞内蛋白质析出,影响后续加工;而速率过高,会增大蛋白质的氧化程度。干法陈化(风干武昌鱼的制作方式)是一种在可控温湿度条件下,不包装的原料肉通过放置进行发酵处理,此过程中蛋白质的氧化程度增强,有助于肉制品形成独特的食用风味和增强产品食用品质。但此工艺中,蛋白质易发生水解,其水解产物会干扰氧化程度的结果,因此需要严格控制肉品的水分活度。Gatellier等[54]研究发现温度为123~207 ℃、热处理时间为120~300 s的条件能够造成牛肉蛋白质羰基大量生成,这表明瞬时的高温处理能促进蛋白质氧化,这一发现为肉制品的促氧化加工工艺研究提供了理论参考。
包装方式和贮藏条件也对蛋白质氧化变性有重要影响。就冷鲜肉而言,包装方式影响蛋白质品质,间接决定产品的营养风味和货架期。例如高氧气调包装会促进牛肉中脂质和肌红蛋白氧化,最终导致牛肉肉色显著退色,品质下降。Lund等[55]通过凝胶电泳等实验发现不同包装方式影响猪背肉的肌球蛋白重链发生不同程度降解,并能够造成蛋白质总巯基含量显著下降。高氧气调易造成蛋白质发生氧化损伤,同时导致蛋白质水解,进而对肉制品的嫩度、色泽、滋味造成负作用[56-58]。Kim等[59]发现当包装条件中氧气体积分数高于70%时,风干羊肉的蛋白质发生显著的交联作用,同时加工后的风干羊肉所需剪切力增加,品质急剧下降。而过低的氧气包装,则会促进肌肉无氧代谢,大量的乳酸积累会降低肌肉内部的pH值,降低抗氧化酶活性,促进蛋白质氧化。
针对不同原料,控制贮藏温度和冻融次数也是贮藏技术的关键,选择最佳温度可避免肉品发生严重冷冻损伤,从而达到保持肉品品质的目的。市场流通中加工肉品难以避免经历反复冻融,温度的波动会刺激产生活性自由基诱导蛋白质氧化,其原因可能是肌肉内多次形成冰晶,导致肌肉细胞结构破坏,溶酶体酶和促氧化物质释放,进而促进蛋白质氧化。因此,控制贮藏时间,避免冷链中断,对降低贮藏过程中蛋白质氧化变性程度至关重要[60-62]。
4 结 语
近十几年来,肉品中蛋白质氧化逐渐成为研究关注热点。绝大多数研究集中于不同促氧化体系、氧化评价体系的建立和蛋白质氧化对肉品食用品质的影响上。虽然对蛋白氧化规律有一定程度的认识,但不同条件下蛋白质氧化发生的具体机制还较为模糊,导致无法选择准确的指标检测加工及贮藏过程中蛋白质氧化过程。针对肉制品加工工艺中影响蛋白质氧化的关键因素的研究尚少,无法为工业中蛋白质氧化的控制提供直接理论依据。在食品和临床医学领域上关于蛋白质氧化的研究倾向其负作用,对其益作用的研究极少。因此将蛋白质氧化结合到实际环境中,选取合适的检测指标,细化蛋白质氧化规律,建立具体环境中蛋白质氧化的评价体系,从而控制蛋白质氧化,对食品加工具有重要的指导意义。另外,关于蛋白质的氧化机理、氧化程度测定方法及实际加工过程中控制利用技术还需要更深入的研究。
[1] GRUNE T, CATALGOL B, JUNG T. Protein oxidation and aging:different model systems and affecting factors[M]// UVERSKY V N.Protein oxidation and aging. Hoboken: John Wiley & Sons, Inc. 2012:295-370.
[2] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition & Food Research,2011, 55(1): 83-95. DOI:10.1002/mnfr.201000453.
[3] SHACTER E. Quantif i cation and signif i cance of protein oxidation in biological samples[J]. Drug Metabolism Reviews, 2000, 32(3/4): 307-326. DOI:10.1081/DMR-100102336.
[4] ADEYEMI K D, SABOW A B, SHITTU R M, et al. Impact of chill storage on antioxidant status, lipid and protein oxidation, color, drip loss and fatty acids of semimembranosus muscle in goats[J]. CyTA-Journal of Food, 2016, 14(3): 405-414. DOI:10.1080/19476337.2015.1114974.
[5] STADTMAN E R, LEVINE R L. Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J]. Amino Acids,2003, 25(3/4): 207-218. DOI:10.1007/s00726-003-0011-2.
[6] SOLADOYE O P, JUÁREZ M L, AALHUS J L, et al. Protein oxidation in processed meat: mechanisms and potential implications on human health[J]. Comprehensive Reviews in Food Science & Food Safety, 2015, 14(2): 106-122. DOI:10.1111/1541-4337.12127.
[7] STADTMAN E R, LEVINE R L. Protein oxidation[J]. Annals of the New York Academy of Sciences, 2000, 899(1): 191-208.DOI:10.1111/j.1749-6632.2000.tb06187.x.
[8] THOMPSON L V, DURAND D, FUGERE N A, et al. Myosin and actin expression and oxidation in aging muscle[J]. Journal of Applied Physiology, 2006, 101(6): 1581-1587. DOI:10.1152/japplphysiol.00426.2006.
[9] SHARMAN E H. Reactive oxygen species and protein oxidation in neurodegenerative disease[J]. Biomedical and Life Sciences, 2016,12(15) : 199-210. DOI:10.1007/978-3-319-33486-8_11.
[10] STADTMAN E R. Protein oxidation in aging and age-related diseases[J]. Annals of the New York Academy of Sciences, 2001,928(1): 22-38. DOI:10.1111/j.1749-6632.2001.tb05632.x.
[11] STADTMAN E R, BERLETT B S. Reactive oxygen-mediated protein oxidation in aging and disease[J]. Chemical Research in Toxicology,1997, 10(5): 485-494. DOI:10.1021/tx960133r.
[12] DAVIES M J, FU S, WANG H, et al. Stable markers of oxidant damage to proteins and their application in the study of human disease[J]. Free Radical Biology & Medicine, 1999, 27(11/12): 1151-1163. DOI:10.1016/S0891-5849(99)00206-3.
[13] DOUNY C, TIHON A, BAYONNET P, et al. Validation of the analytical procedure for the determination of malondialdehyde and three other aldehydes in vegetable oil using liquid chromatography coupled to tandem mass spectrometry (LC-MS/MS) and application to linseed oil[J]. Food Analytical Methods, 2015, 89(6): 1-11.DOI:10.1016/0891-5849(91)90192-6.
[14] WILLIAMS T I, LYNN B C, MARKESBERY W R, et al. Increased levels of 4-hydroxynonenal and acrolein, neurotoxic markers of lipid peroxidation, in the brain in Mild Cognitive Impairment and early Alzheimer’s disease[J]. Neurobiology of Aging, 2006, 27(8):1094-1099. DOI:10.1016/j.neurobiolaging.2005.06.004.
[15] MELLO C F, SULTANA R, PIRODDI M, et al. Acrolein induces selective protein carbonylation in synapto-somes[J]. Neuroscience,2007, 147(3): 674-679. DOI:10.1016/j.neuroscience.2007.04.003.
[16] ZHANG W G, XIAO S, AHN D U. Protein oxidation: basic principles and implications for meat quality[J]. Critical Reviews in Food Science & Nutrition, 2013, 53(11): 1191-1201.DOI:10.1080/10408392011.577540.
[17] FLOOR E, MAPLES A M, RANKIN C A, et al. A one-carbon modif i cation of protein lysine associated with elevated oxidative stress in human substantia nigra[J]. Journal of Neurochemistry, 2006, 97(2):504-514. DOI:10.1111/j.1471-4159.2006.03768.x.
[18] BURCHAM P C, KUHAN Y T. Introduction of carbonyl groups into proteins by the lipid peroxidation product, malondialdehyde[J].Biochemical & Biophysical Research Communications, 1996, 220(3):996-1001. DOI:10.1006/bbrc.1996.0521.
[19] REFSGAARD H H F, TSAI L, STADTMAN E R. Modifications of proteins by polyunsaturated fatty acid peroxidation products[J].Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(2): 611-616. DOI:1073/pnas.97.2.611.
[20] 李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D]. 哈尔滨: 东北农业大学, 2013:10-11.
[21] YAN L J, SOHAL R S. Gel electrophoretic quantitation of protein carbonyls derivatized with tritiated sodium borohydride[J]. Analytical Biochemistry, 1998, 265(1): 176-182. DOI:10.1006/abio.1998.2868.
[22] ROBINSON C E, KESHAVARZIAN A, PASCO D S, et al.Determination of protein carbonyl groups by immunoblotting[J].Analytical Biochemistry, 1999, 266(1): 48-57. DOI:10.1006/abio.1998.2932.
[23] BUSS H, CHAN T P, SLUIS K B, et al. Protein carbonyl measurement by a sensitive ELISA method[J]. Free Radical Biology & Medicine,1997, 23(3): 361-366. DOI:10.1016/S0891-5849(97)00104-4.
[24] ARMENTEROS M, HEINONEN M, OLLILAINEN V, et al. Analysis of protein carbonyls in meat products by using the DNPH-method,fluorescence spectroscopy and liquid chromatography-electrospray ionization mass spectrometry (LC-ESI-MS)[J]. Meat Science, 2009,83(1): 104-112. DOI:10.1016/j.meatsci.2009.04.007.
[25] MESQUITA C S, OLIVEIRA R, BENTO F, et al. Simplified 2,4-dinitrophenylhydrazine spectrophotometric assay for quantif i cation of carbonyls in oxidized proteins[J]. Analytical Biochemistry, 2014,458(5): 69-71. DOI:10.1016/j.ab.2014.04.034.
[26] CLAIBORNE A, YEH J I, MALLETT T C, et al. Protein-sulfenic acids: diverse roles for an unlikely player in enzyme catalysis and redox regulation[J]. Biochemistry, 1999, 38(47): 15407-15416.
[27] TURELL L, BOTTI H, CARBALLAL S, et al. Reactivity of sulfenic acid in human serum albumin[J]. Biochemistry, 2008, 47(1): 358-367.DOI:10.1021/bi701520y.
[28] BARELLI S, CANELLINI G, THADIKKARAN L, et al. Oxidation of proteins: basic principles and perspectives for blood proteomics[J].Proteomics-Clinical Applications, 2008, 2(2): 142-157. DOI:10.1002/prca.200780009.
[29] HAWKINS C L, MORGAN P E, DAVIES M J. Quantification of protein modif i cation by oxidants[J]. Free Radical Biology & Medicine,2009, 46(8): 965-988. DOI:10.1002/prca.200780009.
[30] UCHIDA K, KATO Y, KAWAKISHI S. A novel mechanism for oxidative cleavage of prolyl peptides induced by the hydroxyl radical[J]. Biochemical & Biophysical Research Communications,1990, 169(1): 265-271. DOI:10.1016/0006-291X(90)91463-3.
[31] UTRERA M, ESTÉVEZ M. Oxidation of myofibrillar proteins and impaired functionality: underlying mechanisms of the carbonylation pathway[J]. Journal of Agricultural & Food Chemistry, 2012, 60(32):8002-8011. DOI:10.1021/jf302111j.
[32] MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121. DOI:10.1016/j.meatsci.2005.03.003.
[33] FAUSTMAN C, SUN Q, MANCINI R, et al. Myoglobin and lipid oxidation interactions: mechanistic bases and control[J]. Meat Science,2010, 86(1): 86-94. DOI:10.1016/j.meatsci.2010.04.025.
[34] 徐坤华, 廖明涛, 林森森, 等. 蓝鳍金枪鱼脂质和肌红蛋白的氧化动力学研究[J]. 中国食品学报, 2015, 15(2): 64-71. DOI:10.16429/j.1009-7848.2015.02.010.
[35] 严玉玲, 郭焰, 豆一玲. 不同干燥方式对牛肉干物性特性的影响[J].农业与技术, 2015, 35(14): 12. DOI:10.11974/nyyjs.20150733012.
[36] EYMARD S, BARON C P, JACOBSEN C. Oxidation of lipid and protein in horse mackerel (Trachurus trachurus) mince and washed minces during processing and storage[J]. Food Chemistry, 2009,114(1): 57-65. DOI:10.1016/j.foodchem.2008.09.030.
[37] WOOD J D, RICHARDSON R I, NUTE G R, et al. Effects of fatty acids on meat quality: a review[J]. Meat Science, 2004, 66(1): 21-32.DOI:10.1016/S0309-1740(03)00022-6.
[38] 黄莉, 孔保华, 夏秀芳, 等. 脂肪添加量和冻藏时间对冷冻水饺肉馅肌原纤维蛋白氧化和凝胶特性的影响[J]. 食品科学, 2013, 34(4):261-266.
[39] CHEN C C, PEARSON A M, GRAY J I, et al. Some factors influencing the nonheme iron content of meat and its implications in oxidation[J]. Journal of Food Science, 1984, 49(2): 581-584.DOI:10.1111/j.1365-2621.1984.tb12473.x.
[40] DECKER E A, HULTIN H O. Factors inf l uencing catalysis of lipid oxidation by the soluble fraction of mackerel muscle[J]. Journal of Food Science, 1990, 55(4): 947-950. DOI:10.1111/j.1365-2621-1990.tb01571.x.
[41] 张春江, 黄峰, 胡宏海, 等. 蛋白质氧化与腊肉品质调控[J]. 肉类研究, 2014, 28(5): 41-45.
[42] LIU Zaiqun, YU Wei, LIU Zhongli. Antioxidative and prooxidative effects of coumarin derivatives on free radicalinitiated and photosensitized peroxidation of human low-density lipoprotein[J].Chemistry & Physics of Lipids, 1999, 103(1/2): 125-135.
[43] 黄雯, 陈文和, 金定斌, 等. 添加剂在肉制品加工中的应用[J]. 食品工业科技, 2012, 33(3): 400-406. DOI:1002-0306(2012)03-0400-07.
[44] KIM H W, HWANG K E, SONG D H, et al. Effects of soy sauce on physicochemical and textural properties of tumbled chicken breast[J].Poultry science, 2014, 93(3): 680-686. DOI:10.3382/ps.2012-02930.
[45] 陆玉芹. 磷酸盐处理对罗非鱼片蛋白质和脂质氧化及品质的影响[D].南宁: 广西大学, 2015: 71-79.
[46] HONIKEL K O. The use and control of nitrate and nitrite for the processing of meat products[J]. Meat Science, 2008, 78(1/2): 68-76.DOI:10.1016/j.meatsci.2007.05.030.
[47] VOSSEN E, SMET S D. Protein oxidation and protein nitration inf l uenced by sodium nitrite in two different meat model systems[J].Journal of Agricultural and Food Chemistry, 2015, 63(9): 2550-2556.DOI:10.1021/jf505775u.
[48] 李晨伊. 亚硝酸钠对西式火腿中肌原纤维蛋白氧化影响的研究[D].杨凌: 西北农林科技大学, 2016: 47-58.
[49] 张慧芸, 吴静娟, 郭新宇. 多酚对猪肉肌原纤维蛋白氧化和凝胶特性的影响[J]. 食品科学, 2016, 37(21): 43-47. DOI:10.7506/spkx1002-6630-201621008.
[50] JONGBERG S, SKOV S H, TORNGREN M A, et al. Effect of white grape extract and modif i ed atmosphere packaging on lipid and protein oxidation in chill stored beef patties[J]. Food Chemistry, 2011, 128(2):276-283. DOI:10.1016/j.foodchem.2011.03.015.
[51] 刘建垒, 景浩. 4 种水溶性维生素对酪蛋白氧化的保护作用[J]. 中国食品学报, 2016, 16(10): 36-46. DOI:10.16429/j.1009-7848.2016.10.005.
[52] JUNG S, NAM K C, AHN D U, et al. Effect of phosvitin on lipid and protein oxidation in ground beef treated with high hydrostatic pressure[J].Meat Science, 2013, 95(1): 8-13. DOI:10.1016/j.meatsci.2013.04.005.
[53] 吴雪燕. 中式香肠中蛋白氧化对蛋白功能性质和香肠品质的影响[D].扬州: 扬州大学, 2014: 33-45.
[54] GATELLIER P, KONDJOYAN A, PORTANGUEN S, et al. Effect of cooking on protein oxidation in n-3 polyun-saturated fatty acids enriched beef. implication on nutritional quality[J]. Meat Science,2010, 85(4): 645-650. DOI:10.1016/j.meatsci.2010.03.018.
[55] LUND M N, LAMETSCH R, HVIID M S, et al. High-oxygen packaging atmosphere inf l uences protein oxidation and tenderness of porcine longissimus dorsi during chill storage[J]. Meat Science, 2007,77(3): 295-303. DOI:10.1016/j.meatsci.2007.03.016.
[56] KIM Y H, HUFF-LONERGAN E, SEBRANEK J G, et al. Highoxygen modified atmosphere packaging system induces lipid and myoglobin oxidation and protein polymerization[J]. Meat Science,2010, 85(4): 759-767. DOI:10.1016/j.meatsci.2010.04.001.
[57] CLAUSEN I, JAKOBSEN M, ERTBJERG P, et al. Modified atmosphere packaging affects lipid oxidation, myofibrillar fragmentation index and eating quality of beef[J]. Packaging Technology and Science, 2009, 22(2): 85-96. DOI:10.1002/pts.828.
[58] LIU Z, XIONG Youling L., CHEN J. Protein oxidation enhances hydration but suppresses water-holding capacity in porcine longissimus muscle[J]. Journal of Agricultural & Food Chemistry, 2010, 58(19):10697-10704. DOI:10.1021/jf102043k.
[59] KIM Y H B, BØDKER D, ROSEVOLD K. Influence of lamb age and high-oxygen modified atmosphere packaging on protein polymerization of long-term aged lamb loins[J]. Food Chemistry,2012, 135(1): 122-126. DOI:10.1016/j.foodchem.2012.04.109.
[60] 陈茜茜, 黄明, 邹玉峰, 等. 辐照和反复冻融对牛肉蛋白质氧化及食用品质的影响[J]. 食品科学, 2014, 35(19): 1-5. DOI:10.7506/spkx1002-6630-201419001.
[61] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: review[J]. Meat Science, 2012, 91(2):93-98. DOI:10.1016/j.meatsci.2012.01.013.
[62] PÉREZ-PALACIOS T, RUIZ J, MARTÍN D, et al. Pre-cure freezing effect on physicochemical, texture and sensory characteristics of Iberian ham[J]. Food science and Technology International, 2011,17(2): 127-133. DOI:10.1177/1082013210381435.
